从实验学化学[第二课时]
文档属性
| 名称 | 从实验学化学[第二课时] |  | |
| 格式 | rar | ||
| 文件大小 | 464.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-12-29 08:28:00 | ||
图片预览






文档简介
课件15张PPT。第一章
从实验学化学二、混合物的分离和提纯2、蒸馏和萃取:(1) 蒸馏:利用混合物中各组成成分的沸点不同,用加热的方法将其分离的过程。
对象:沸点不同液态混合物;
目的:分离(或除去)难挥发(或不挥发)的杂质。
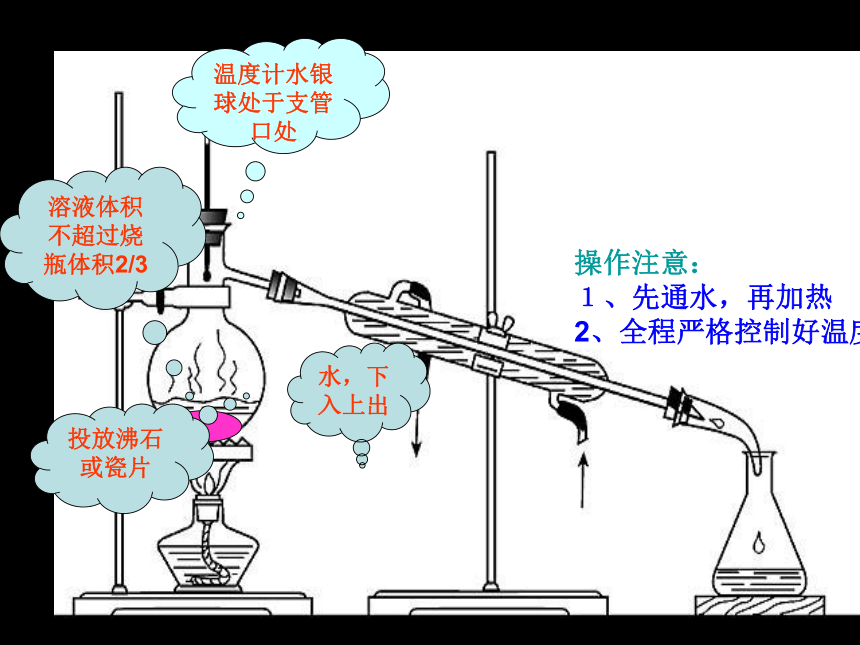
如:利用自来水制备蒸馏水蒸馏烧瓶冷凝管温度计尾接管冷水热水使用前要检查装置的气密性!投放沸石或瓷片温度计水银球处于支管口处水,下入上出操作注意:
1、先通水,再加热
2、全程严格控制好温度溶液体积不超过烧瓶体积2/3 加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,
水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-(2) 分液2、分离互不相溶、密度不同的混合物的方法一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水分液注意事项:(1)分液漏斗在使用前须检验是否漏水。
(2)把盛有待分液体的分液漏斗放在铁架台的铁圈上,使漏斗颈末端紧贴在烧杯内壁,静置片刻。
( 3 )下层液体从漏斗颈流出,上层液体须从漏斗上口倾倒出。(3) 萃取:原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。 A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来.▲萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应萃取实验步骤:装液---振荡---静置---分液主要仪器:分液漏斗P9P9 实验1-4注意事项:
(1)振荡时,须不断放气,以减少分液漏斗内的气压。
(2)萃取原则:少量多次。
(3)选择萃取剂的要求:与原溶剂不相溶;溶质在其中的溶解度要比在原溶剂中大;溶质、原溶剂、萃取剂之间均不反应。练习:
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应.
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小B2.阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( )苯,CCl43、CCl4能把碘酒中的碘萃取出来么?不能,酒精与CCl4混溶(4).升华法:分离易升华的物质。
碘、萘的提纯要提取食盐中的单质碘,你设计的最佳方法是什么?【问题】小结:混合物的分离和提纯蒸馏
分液
萃取
升华课堂练习:
1.在实验里进行分液操作,下列仪器中用不着的是
A.锥形瓶 B.分液漏斗 C.玻璃棒 D.温度计D2.已知丙酮通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃.要从水与丙酮的混合物里将丙酮分离出来,下列方法最合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发B3.检验某未知溶液是否含有SO42-,下列操作最合理的是( )
A. 先加稀硝酸酸化,再加Ba(NO3)2溶液.
B. 加BaCl2溶液即可.
C. 先加稀盐酸酸化,再加BaCl2溶液.
D. 加Ba(NO3)2溶液即可C
对象:沸点不同液态混合物;
目的:分离(或除去)难挥发(或不挥发)的杂质。
如:利用自来水制备蒸馏水蒸馏烧瓶冷凝管温度计尾接管冷水热水使用前要检查装置的气密性!投放沸石或瓷片温度计水银球处于支管口处水,下入上出操作注意:
1、先通水,再加热
2、全程严格控制好温度溶液体积不超过烧瓶体积2/3 加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,
水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-(2) 分液2、分离互不相溶、密度不同的混合物的方法一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水分液注意事项:(1)分液漏斗在使用前须检验是否漏水。
(2)把盛有待分液体的分液漏斗放在铁架台的铁圈上,使漏斗颈末端紧贴在烧杯内壁,静置片刻。
( 3 )下层液体从漏斗颈流出,上层液体须从漏斗上口倾倒出。(3) 萃取:原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。 A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来.▲萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应萃取实验步骤:装液---振荡---静置---分液主要仪器:分液漏斗P9P9 实验1-4注意事项:
(1)振荡时,须不断放气,以减少分液漏斗内的气压。
(2)萃取原则:少量多次。
(3)选择萃取剂的要求:与原溶剂不相溶;溶质在其中的溶解度要比在原溶剂中大;溶质、原溶剂、萃取剂之间均不反应。练习:
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应.
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小B2.阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( )苯,CCl43、CCl4能把碘酒中的碘萃取出来么?不能,酒精与CCl4混溶(4).升华法:分离易升华的物质。
碘、萘的提纯要提取食盐中的单质碘,你设计的最佳方法是什么?【问题】小结:混合物的分离和提纯蒸馏
分液
萃取
升华课堂练习:
1.在实验里进行分液操作,下列仪器中用不着的是
A.锥形瓶 B.分液漏斗 C.玻璃棒 D.温度计D2.已知丙酮通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃.要从水与丙酮的混合物里将丙酮分离出来,下列方法最合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发B3.检验某未知溶液是否含有SO42-,下列操作最合理的是( )
A. 先加稀硝酸酸化,再加Ba(NO3)2溶液.
B. 加BaCl2溶液即可.
C. 先加稀盐酸酸化,再加BaCl2溶液.
D. 加Ba(NO3)2溶液即可C
