第一节 原电池(广东省深圳市)
文档属性
| 名称 | 第一节 原电池(广东省深圳市) |

|
|
| 格式 | rar | ||
| 文件大小 | 911.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-01 00:00:00 | ||
图片预览



文档简介
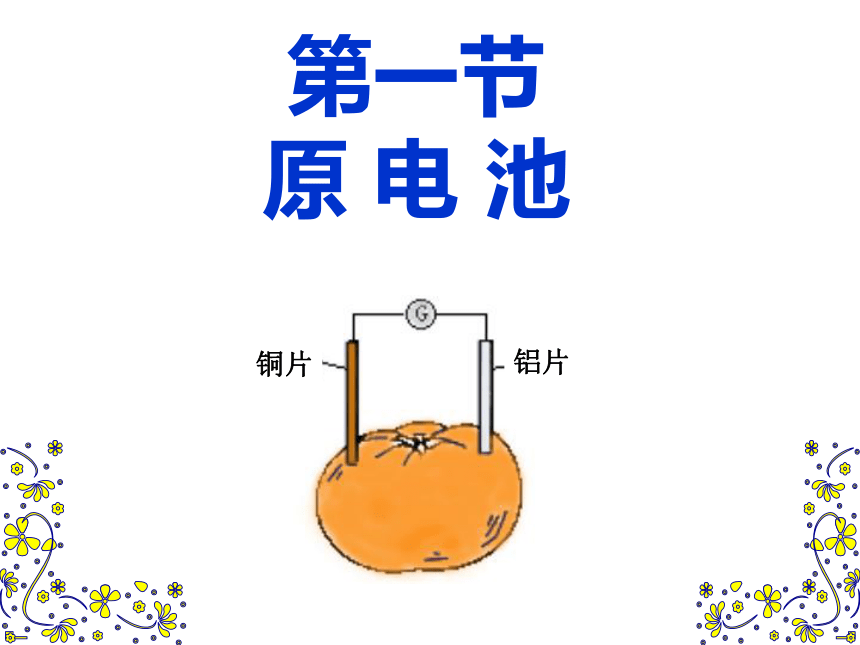
课件28张PPT。第四章
电化学基础电化学:指研究化学能与电能之间相互转
换的装置、过程和效率的科学。过程及装置分按电化学反应2. 借助电流而发生反应及装置 (如:电解池){1. 产生电流的化学反应及装置 (如:原电池等)第一节
原 电 池【复习回顾】1、原电池是______________________ 的装置。
原电池反应的本质是____________反应。氧化还原2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”下同)
反应;Cu电极是______极,其电极反应为
_______________,该反应是_________反应。(2)当电解质溶液为CuSO4溶液时:
负极--Zn电极电极反应是否改变?
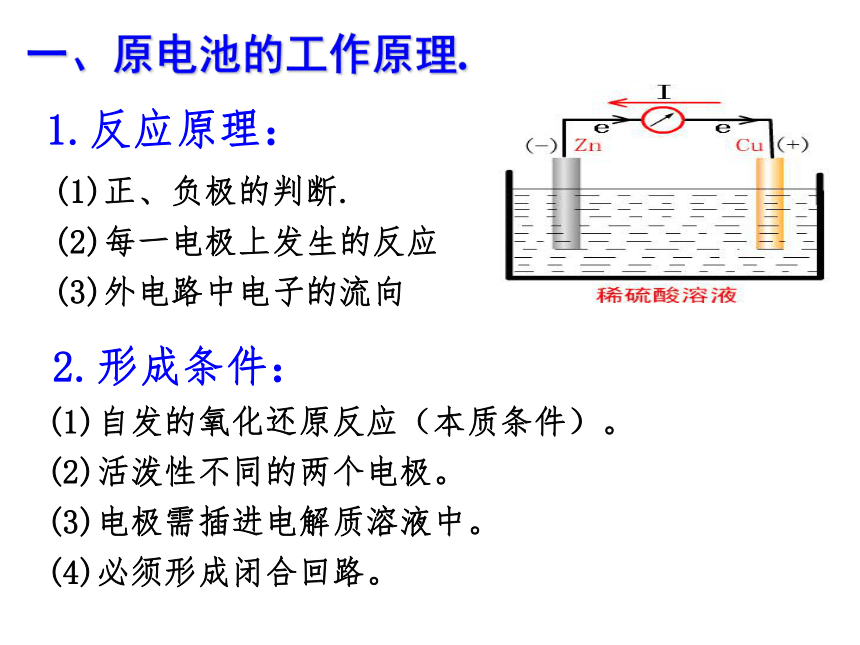
正极--Cu电极电极反应是否改变?负Zn -2e- = Zn2+氧化正2H+ +2e- =H2↑还原Cu2+ +2e- =Cu化学能转化为电能的装置Zn -2e- = Zn2+一、原电池的工作原理.1.反应原理:2.形成条件:(1)自发的氧化还原反应(本质条件)。
(2)活泼性不同的两个电极。
(3)电极需插进电解质溶液中。
(4)必须形成闭合回路。(1)正、负极的判断.
(2)每一电极上发生的反应
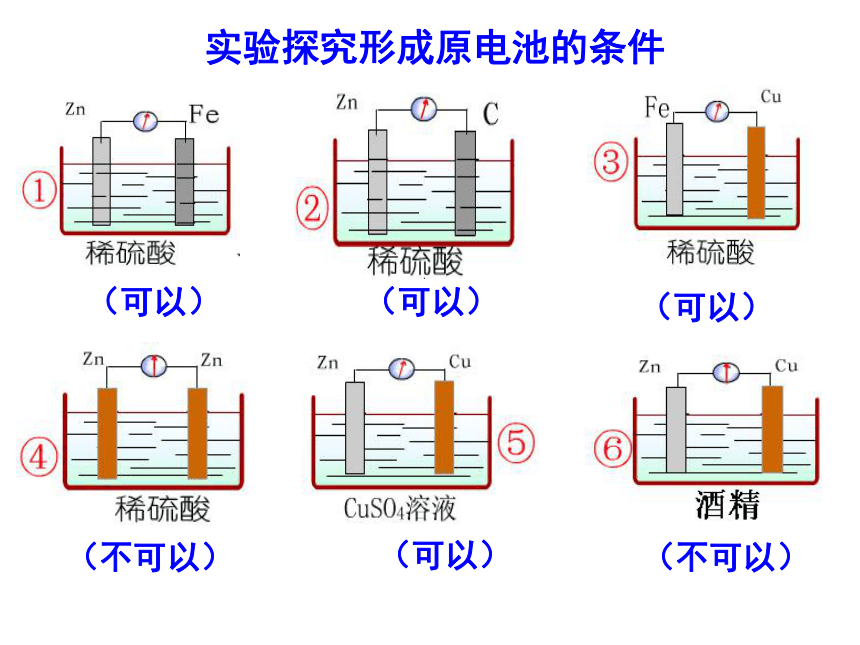
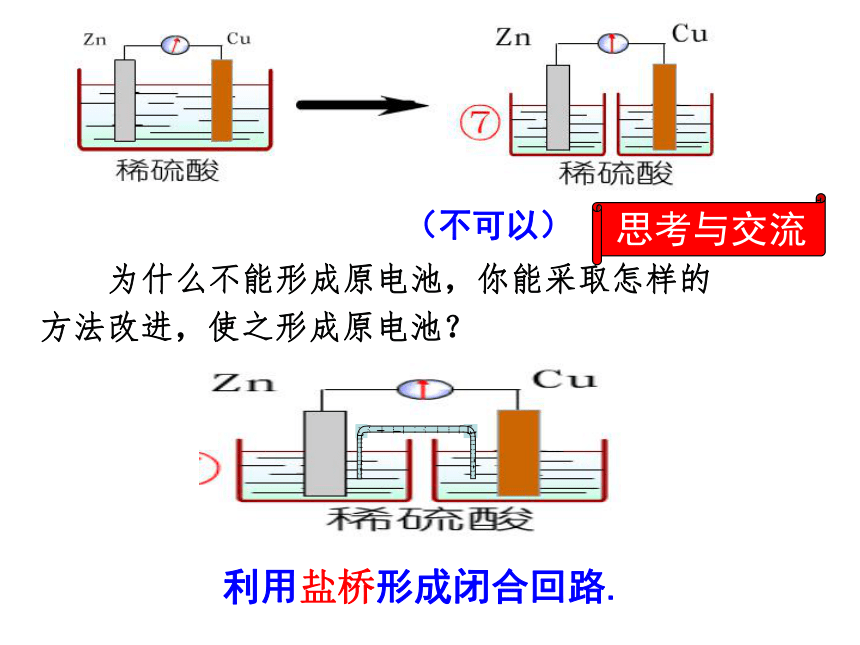
(3)外电路中电子的流向实验探究形成原电池的条件(可以)(可以)(可以)(不可以)(可以)(不可以)(不可以) 为什么不能形成原电池,你能采取怎样的
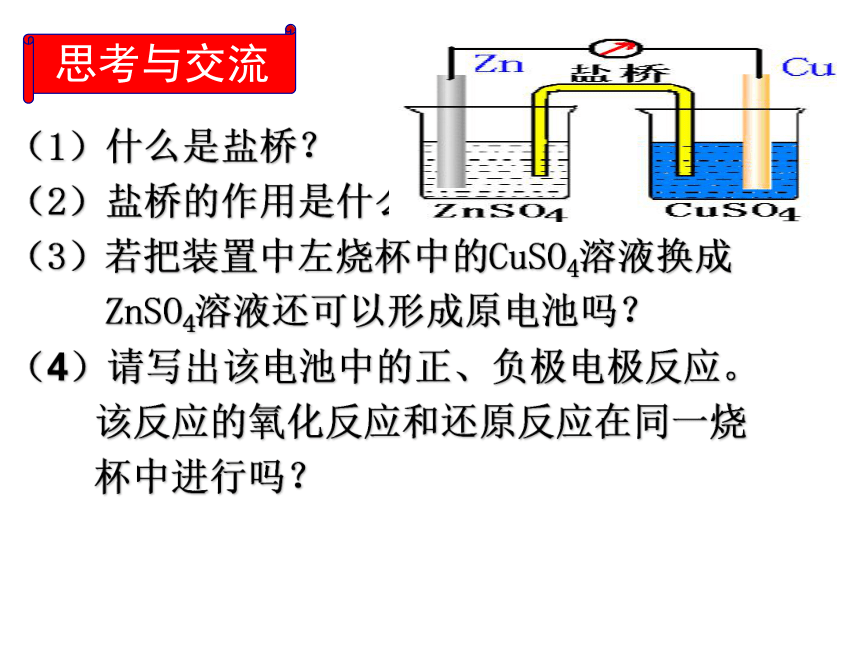
方法改进,使之形成原电池?利用盐桥形成闭合回路.思考与交流(1)什么是盐桥?
(2)盐桥的作用是什么?
(3)若把装置中左烧杯中的CuSO4溶液换成
ZnSO4溶液还可以形成原电池吗?
(4)请写出该电池中的正、负极电极反应。
该反应的氧化反应和还原反应在同一烧
杯中进行吗?
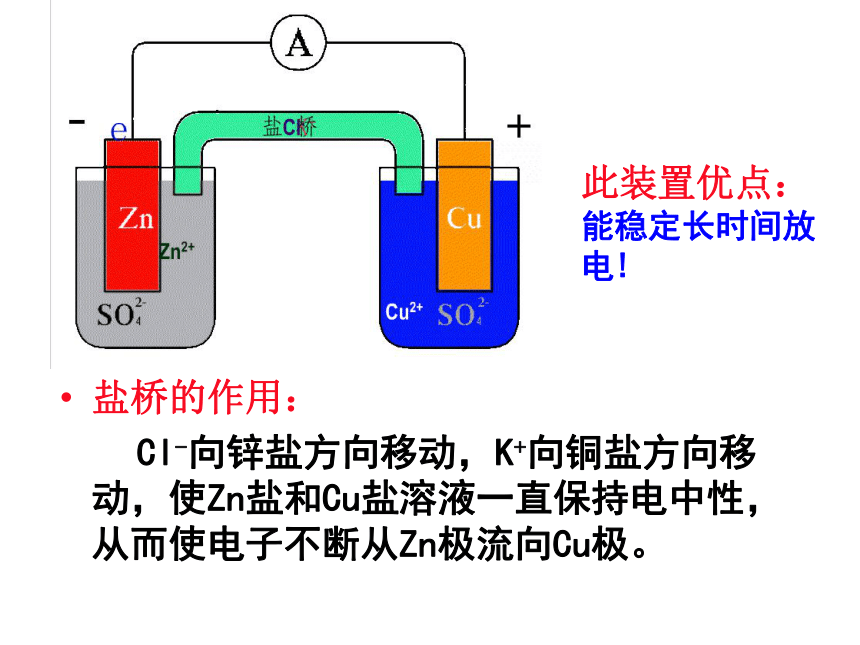
思考与交流盐桥的作用:
Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。此装置优点:能稳定长时间放电!二、盐桥 1、盐桥中装有饱和的KCl溶液和琼脂制成 的胶冻,胶冻的作用是防止管中溶液流出。 2、盐桥的作用:通过阴、阳离子的定向移动,沟通内电路。负极(锌片): Zn -2e - = Zn 2+ (氧化反应) 正极(铜片): Cu2+ + 2e - = Cu (还原反应)电池反应(总化学方程式):Zn + Cu2+ = Zn 2+ + Cu 1、盐桥的使用有利于产生持续、稳定的电流;
2、盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维模式,使氧化剂和还原剂在不同的区域之间通过特定的装置实现了电子的定向转移。小结知识拓展几个概念
1、原电池是由两个半电池组成的;
2、半电池中的反应就是半反应,即电极反应。
3、半反应(电极反应)涉及同一元素的氧化价态和还原价态:原电池的表示方法:
(-)Zn|Zn2+ (C1) ‖ Cu2+ (C2)|Cu(+)
“|”表示液-固相有一界面;“‖”表示盐桥。
在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。ABCDEFMN1.下列哪几个装置能形成原电池?VXVVXXVX原电池构成条件典型例题:2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件典型例题:3.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B4.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小C典型例题:5.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B6、如图所示,在铁圈和银圈的焊接处,用一根棉线
将其悬在盛水的烧杯中,使之平衡;小心的向烧杯
中央滴入CuSO4溶液,片刻后可观察到的现象是( D )A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜?1.利用原电池原理设计新型化学电池;2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;3.进行金属活动性强弱比较;4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。三、原电池的主要应用:5.解释某些化学现象(1)比较金属活动性强弱。(C)原电池原理应用:(2)比较反应速率( D )原电池原理应用:例3:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)原电池原理应用:(3)比较金属腐蚀的快慢(4)判断溶液pH值变化例4:在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==3.75× 10﹣ 4(mol/L )∴pH =-lg3.75 ×10-4=4 -lg3.75 答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4x y 0.168解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑大0.015原电池原理应用:(5)原电池原理的综合应用例5:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀原电池原理应用:已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O
是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表
指针偏转;(Ⅱ)若改往(B)烧杯中滴加40%NaOH
溶液,发现微安培表指针向前述相反方向偏转.
试回答:
(1)两次操作过程中指针为什么会发生偏转?
答: 。
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:____________________________________________________。
(3)(Ⅰ)操作过程中C1棒上发生的反应为 。
(4)(Ⅱ)操作过程中C2棒上发生的反应为 。 这是原电池,指针偏转是由于电子流过电流表 B中加盐酸,AsO43—发生得电子反应为正极;而当加入NaOH后,AsO33—发生失电子反应,为负极; 2I——2e— =I2 AsO33——2e—+2OH- = AsO43—+H2O 拓展练习
1、若烧杯中溶液为稀硫酸,则观察到的
现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
2、若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e—=H2↑Mg-2e—=Mg2+ 化学能电能Al2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.Cu、Fe作两极,浓硝酸作电解质溶液的原电池中:
①.Cu作 极, ②.Fe作 极
电极反应式是:负极 。
正极 。
总反应式是: 。负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 +2H2OCu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O 复杂的电极反应式可以由总反应式减去另一较简单的电极反应式得到.拓展练习小 结1定义:(1)由两个半电池组成的锌铜原电池的工作原理 原电池把化学能转化成电能的装置。2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 (2)形成原电池的条件(3)原电池的正负极的判断方法(4)电极材料的选择(电池的电极必须导电)
电化学基础电化学:指研究化学能与电能之间相互转
换的装置、过程和效率的科学。过程及装置分按电化学反应2. 借助电流而发生反应及装置 (如:电解池){1. 产生电流的化学反应及装置 (如:原电池等)第一节
原 电 池【复习回顾】1、原电池是______________________ 的装置。
原电池反应的本质是____________反应。氧化还原2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”下同)
反应;Cu电极是______极,其电极反应为
_______________,该反应是_________反应。(2)当电解质溶液为CuSO4溶液时:
负极--Zn电极电极反应是否改变?
正极--Cu电极电极反应是否改变?负Zn -2e- = Zn2+氧化正2H+ +2e- =H2↑还原Cu2+ +2e- =Cu化学能转化为电能的装置Zn -2e- = Zn2+一、原电池的工作原理.1.反应原理:2.形成条件:(1)自发的氧化还原反应(本质条件)。
(2)活泼性不同的两个电极。
(3)电极需插进电解质溶液中。
(4)必须形成闭合回路。(1)正、负极的判断.
(2)每一电极上发生的反应
(3)外电路中电子的流向实验探究形成原电池的条件(可以)(可以)(可以)(不可以)(可以)(不可以)(不可以) 为什么不能形成原电池,你能采取怎样的
方法改进,使之形成原电池?利用盐桥形成闭合回路.思考与交流(1)什么是盐桥?
(2)盐桥的作用是什么?
(3)若把装置中左烧杯中的CuSO4溶液换成
ZnSO4溶液还可以形成原电池吗?
(4)请写出该电池中的正、负极电极反应。
该反应的氧化反应和还原反应在同一烧
杯中进行吗?
思考与交流盐桥的作用:
Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。此装置优点:能稳定长时间放电!二、盐桥 1、盐桥中装有饱和的KCl溶液和琼脂制成 的胶冻,胶冻的作用是防止管中溶液流出。 2、盐桥的作用:通过阴、阳离子的定向移动,沟通内电路。负极(锌片): Zn -2e - = Zn 2+ (氧化反应) 正极(铜片): Cu2+ + 2e - = Cu (还原反应)电池反应(总化学方程式):Zn + Cu2+ = Zn 2+ + Cu 1、盐桥的使用有利于产生持续、稳定的电流;
2、盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维模式,使氧化剂和还原剂在不同的区域之间通过特定的装置实现了电子的定向转移。小结知识拓展几个概念
1、原电池是由两个半电池组成的;
2、半电池中的反应就是半反应,即电极反应。
3、半反应(电极反应)涉及同一元素的氧化价态和还原价态:原电池的表示方法:
(-)Zn|Zn2+ (C1) ‖ Cu2+ (C2)|Cu(+)
“|”表示液-固相有一界面;“‖”表示盐桥。
在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。ABCDEFMN1.下列哪几个装置能形成原电池?VXVVXXVX原电池构成条件典型例题:2.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件典型例题:3.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B4.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小C典型例题:5.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B6、如图所示,在铁圈和银圈的焊接处,用一根棉线
将其悬在盛水的烧杯中,使之平衡;小心的向烧杯
中央滴入CuSO4溶液,片刻后可观察到的现象是( D )A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜?1.利用原电池原理设计新型化学电池;2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;3.进行金属活动性强弱比较;4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。三、原电池的主要应用:5.解释某些化学现象(1)比较金属活动性强弱。(C)原电池原理应用:(2)比较反应速率( D )原电池原理应用:例3:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)原电池原理应用:(3)比较金属腐蚀的快慢(4)判断溶液pH值变化例4:在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==3.75× 10﹣ 4(mol/L )∴pH =-lg3.75 ×10-4=4 -lg3.75 答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4x y 0.168解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑大0.015原电池原理应用:(5)原电池原理的综合应用例5:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀原电池原理应用:已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O
是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表
指针偏转;(Ⅱ)若改往(B)烧杯中滴加40%NaOH
溶液,发现微安培表指针向前述相反方向偏转.
试回答:
(1)两次操作过程中指针为什么会发生偏转?
答: 。
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:____________________________________________________。
(3)(Ⅰ)操作过程中C1棒上发生的反应为 。
(4)(Ⅱ)操作过程中C2棒上发生的反应为 。 这是原电池,指针偏转是由于电子流过电流表 B中加盐酸,AsO43—发生得电子反应为正极;而当加入NaOH后,AsO33—发生失电子反应,为负极; 2I——2e— =I2 AsO33——2e—+2OH- = AsO43—+H2O 拓展练习
1、若烧杯中溶液为稀硫酸,则观察到的
现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
2、若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e—=H2↑Mg-2e—=Mg2+ 化学能电能Al2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.Cu、Fe作两极,浓硝酸作电解质溶液的原电池中:
①.Cu作 极, ②.Fe作 极
电极反应式是:负极 。
正极 。
总反应式是: 。负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 +2H2OCu+4HNO3(浓)=Cu(NO3)2+2NO2 +2H2O 复杂的电极反应式可以由总反应式减去另一较简单的电极反应式得到.拓展练习小 结1定义:(1)由两个半电池组成的锌铜原电池的工作原理 原电池把化学能转化成电能的装置。2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 (2)形成原电池的条件(3)原电池的正负极的判断方法(4)电极材料的选择(电池的电极必须导电)
