第二节 化学电源(广东省深圳市)
文档属性
| 名称 | 第二节 化学电源(广东省深圳市) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-01 00:00:00 | ||
图片预览







文档简介
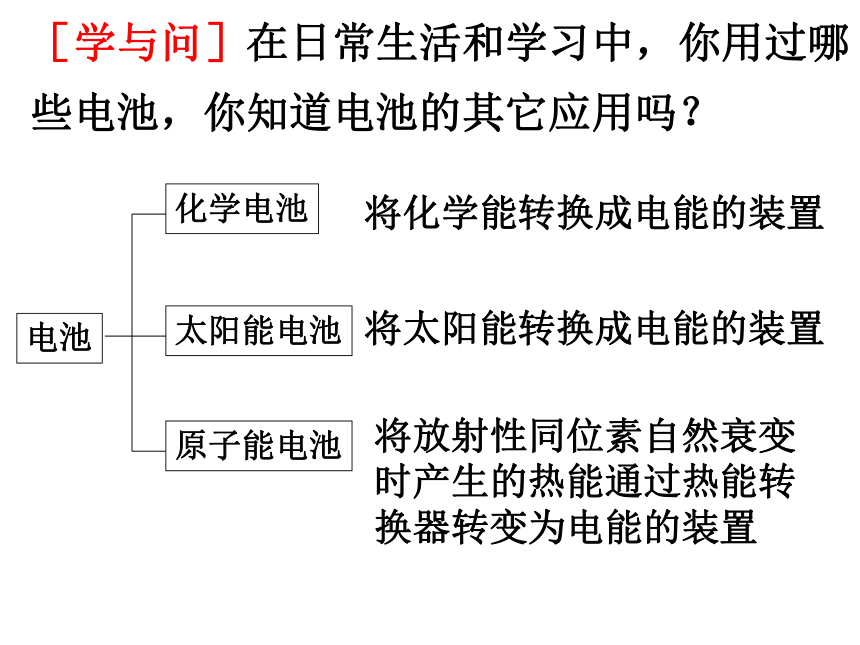
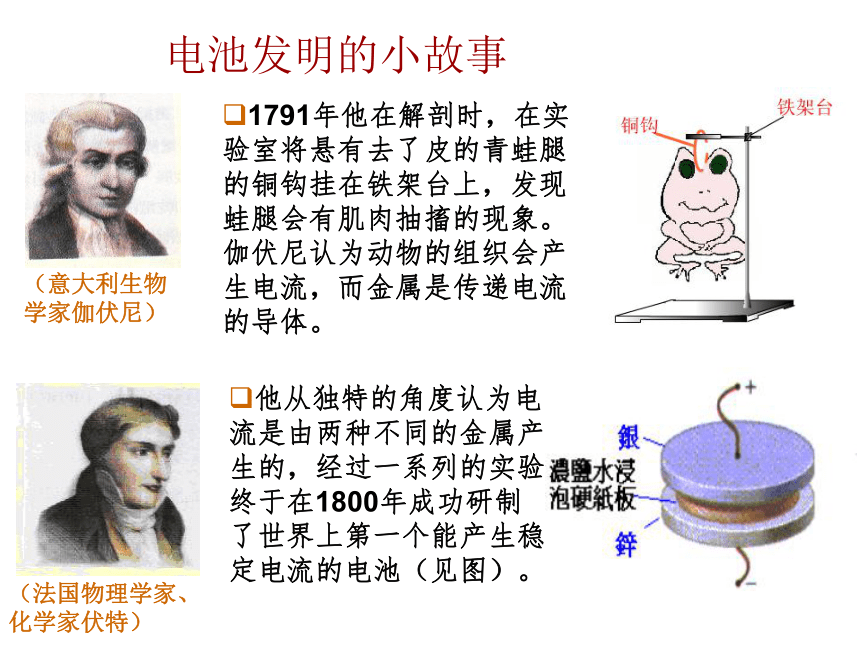
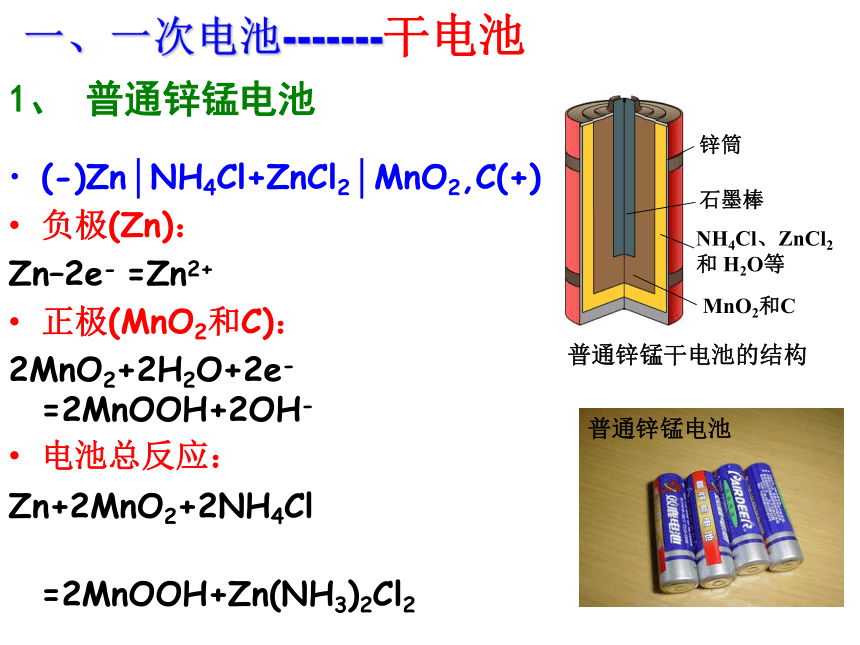
课件33张PPT。第二节 化学电源[学与问]在日常生活和学习中,你用过哪些电池,你知道电池的其它应用吗? 电池化学电池太阳能电池原子能电池将化学能转换成电能的装置将太阳能转换成电能的装置将放射性同位素自然衰变时产生的热能通过热能转换器转变为电能的装置用途广泛的电池用于汽车的铅蓄电池和燃料电池用途广泛的电池用于“神六”的太阳能电池笔记本电脑专用电池手机专用电池摄像机专用电池各式各样的纽扣电池小型高性能燃料电池 化学电池氢气、甲醇、天然气、煤气与氧气组成燃料电池 电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用。 又称充电电池或蓄电池。放电后经充电可使电池中的活性物质获得重生,恢复工作能力,可多次重复使用。 是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电源,又称连续电池。优点:电池优劣的判断标准:①能量转换效率高,供能稳定可靠。②可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。③易维护,可在各种环境下工作。①比能量[符号(A·h/kg),(A·h/L)]指电池单位质量或单位体积所能输出电能的多少②比功率[符号是W/kg,W/L)]指电池单位质量或单位体积所能输出功率的大小③电池的储存时间的长短电池发明的小故事1791年他在解剖时,在实验室将悬有去了皮的青蛙腿的铜钩挂在铁架台上,发现蛙腿会有肌肉抽搐的现象。伽伏尼认为动物的组织会产生电流,而金属是传递电流的导体。 他从独特的角度认为电流是由两种不同的金属产生的,经过一系列的实验,终于在1800年成功研制了世界上第一个能产生稳定电流的电池(见图)。 (法国物理学家、化学家伏特)一、一次电池-------干电池(-)Zn│NH4Cl+ZnCl2│MnO2,C(+)
负极(Zn):
Zn–2e- =Zn2+
正极(MnO2和C):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2NH4Cl
=2MnOOH+Zn(NH3)2Cl21、 普通锌锰电池碱性锌锰电池构造示意图(-) Zn│KOH│MnO2 (+)
负极(Zn):
Zn + 2OH- - 2e- = Zn(OH)2
正极(MnO2):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2H2O
=2MnOOH+Zn(OH)2
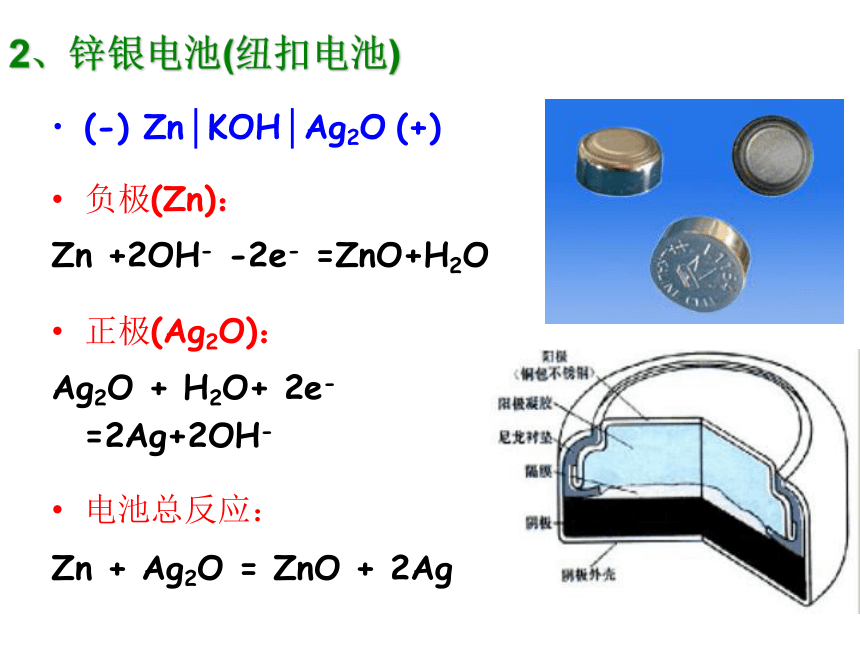
优缺点简析:只能一次使用,不能充电;价格较贵;比能量和储存时间有所提高,适用于大电流和连续放电。2、锌银电池(纽扣电池)(-) Zn│KOH│Ag2O (+)
负极(Zn):
Zn +2OH- -2e- =ZnO+H2O
正极(Ag2O):
Ag2O + H2O+ 2e- =2Ag+2OH-
电池总反应:
Zn + Ag2O = ZnO + 2Ag3、锂电池锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2=6LiCl+Li2SO3+2S
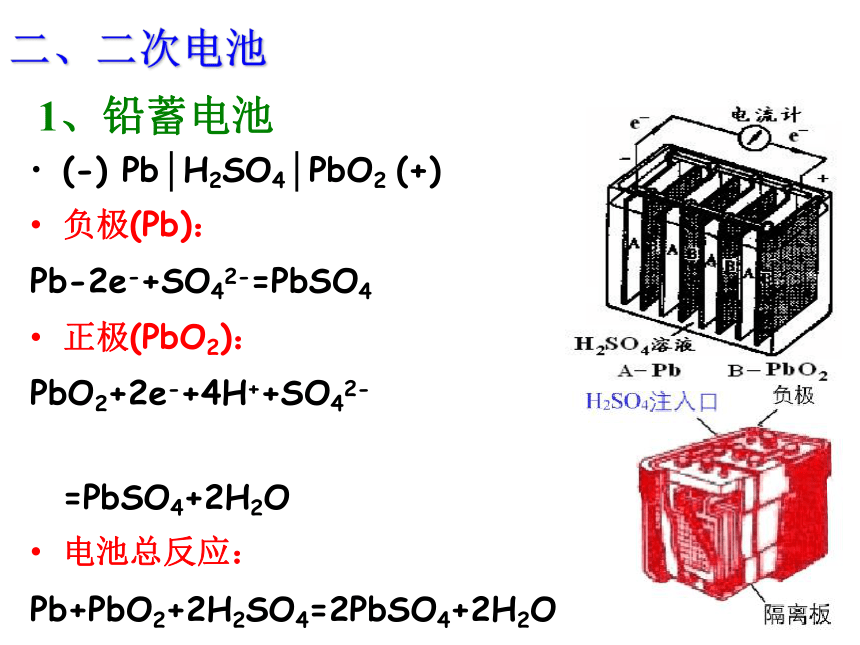
负极: ;正极: 。用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工作温度宽、高使用寿命,广泛应用于军事和航空领域。8Li-8e-=8Li+3SOCl2+8e-=6Cl-+SO32-+2S二、二次电池(-) Pb│H2SO4│PbO2 (+)
负极(Pb):
Pb-2e-+SO42-=PbSO4
正极(PbO2):
PbO2+2e-+4H++SO42-
=PbSO4+2H2O
电池总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O 1、铅蓄电池 缺点:比能量低、笨重、废弃电池污染环境
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池:镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……铅蓄电池的充放电过程:铅蓄电池的优缺点简析:2、银锌蓄电池负极:Zn-2e-+2OH-=Zn(OH)2 正极:Ag2O+2e-+H2O=2Ag+2OH-银-锌蓄电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:3、镉镍电池负极材料:Cd; 正极材料:涂有NiO2,
电解质:KOH溶液。 特点:比铅蓄电池耐用,可密封反复使用。 负极:Cd-2e-+2OH-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-大有发展前景的燃料电池
??????? 燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能的一类原电池。目前燃料电池的能量转化率可达近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池的噪声及硫氧化物、氮氧化物等废气污染都接近零;燃料电池发明于19世纪30年代末,经反复试验、改进,到20世纪60年代才开始进入实用阶段。第一代燃料电池的?大致情况如下: ???三、燃料电池氢氧燃料电池燃料电池 优点:能量转化率高,可持续使用,对环境友好 用途:宇宙飞船,应用前景广阔负极 : 2H2+4OH--4e-=4H2O 正极 : O2+2H2O+4e-=4OH- 总反应方程式 :
2H2+O2=2H2O燃 料 电 池2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-2H2 +4OH-- 4e- = 4H2O O2 + 2H2O + 4e-= 4OH-固体燃料电池2H2 - 4e- +2O2-= 2H2O O2 + 4e-= 2O2- 2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O 航天技术上使用的一种电池,它具有高能、轻便、不污染环境等优点。用Pt做电极,KOH溶液做电解液,因其反应与氢氧燃烧相似,故称为氢氧燃烧电池。请写出各电极的电极反应。氢氧燃料电池若将氢气换成甲烷,写出各电极的电极反应将铂丝插入KOH溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池,根据两极上反应的实质判断,通入甲烷的一极为____,这一极的电极反应为___________________;通入氧气的一极为_______,电极反应为
__________________________________,总反应为__________________________。负极CH4-8e-+10OH-=CO32-+7H2O正极O2+4e-+2H2O=4OH-CH4+2O2+2KOH=K2CO3+3H2O若将氢气换成甲烷,写出各电极的电极反应1、仅有一个电极材料参与反应的原电池:
负极:M-xe=Mx+
正极:析氢或吸氧或析出不活泼金属
2、两个电极均参与反应的原电池
(如蓄电池,纽扣电池)
①电极材料:金属为负极,金属化合物为正极.课 堂 总 结②电子得失均由两电极本身发生.
③电极反应需考虑电解质溶液的参与.
3、电极材料本身均不参与反应的电池(燃料电池)
①两电极材料均为惰性电极.
②负极-可燃性气体失电子,正极-助燃性气体得
电子.
③电极反应考虑电解质溶液.书写电极反应式应注意以下几点:1.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。1、在含有H2S气体的空气中,银器表面易变黑(生成了
Ag2S),原因是银发生了 (填析氢或吸氧)腐蚀,其电极反应式为:负极 正极 ,最终在表面生成Ag2S的离子反应方程式为 .为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,请用电极反应式和离子方程式表示上述过程.巩 固 练 习Al-3e-=Al3+Ag2S+2e-=2Ag+S2-2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S?2、熔融盐燃料电池具有较高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在65℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2CO32-=4CO2+4e
正极反应式:
总反应式:O2+4e-+2CO2=2CO32-2CO+O2=2CO23.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+B4Al-12e=4Al3+3O2+6H2O+12e=12OH-不活泼金属或碳Cu2Fe3++2e=2Fe2+Cu-2e=Cu2+6、已知:铅蓄电池充电完毕后,电池中硫酸的密度为?1,放电完毕后,溶液的密度变为? 2。又铅蓄电池充电时的反应:
2PbSO4+2H2O Pb+PbO2+2H2SO4
法拉第常数:F=96500C/mol
⑴写出铅蓄电池使用时所产生的总反应式及两电极上的半反应。
⑵已知充放电完毕后,溶液的密度是下列两个数据:1.10g/cm3,相当于含14.35%(质量)的硫酸,1.28g/cm3,相当于含36.87% (质量)的硫酸请指出分别?1, ? 2对应于哪一个数据?
⑶用什么方法可以确定什么时候该充电什么时候该停止充电?
⑷按方程式计算生成及消耗的水和硫酸的质量。
⑸计算一个电容量为4.32×106C的蓄电池中需加多少硫酸?
⑹用久了的铅蓄电池会对环境造成污染,为什么?充电中学化学资料网版权所有 http://www.e-huaxue.com 7、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2mol电子,锌的质量理论上减小6?5gC8、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
________________________
此时电池内总的反应式 :
________________________CH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O
负极(Zn):
Zn–2e- =Zn2+
正极(MnO2和C):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2NH4Cl
=2MnOOH+Zn(NH3)2Cl21、 普通锌锰电池碱性锌锰电池构造示意图(-) Zn│KOH│MnO2 (+)
负极(Zn):
Zn + 2OH- - 2e- = Zn(OH)2
正极(MnO2):
2MnO2+2H2O+2e- =2MnOOH+2OH-
电池总反应:
Zn+2MnO2+2H2O
=2MnOOH+Zn(OH)2
优缺点简析:只能一次使用,不能充电;价格较贵;比能量和储存时间有所提高,适用于大电流和连续放电。2、锌银电池(纽扣电池)(-) Zn│KOH│Ag2O (+)
负极(Zn):
Zn +2OH- -2e- =ZnO+H2O
正极(Ag2O):
Ag2O + H2O+ 2e- =2Ag+2OH-
电池总反应:
Zn + Ag2O = ZnO + 2Ag3、锂电池锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2=6LiCl+Li2SO3+2S
负极: ;正极: 。用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工作温度宽、高使用寿命,广泛应用于军事和航空领域。8Li-8e-=8Li+3SOCl2+8e-=6Cl-+SO32-+2S二、二次电池(-) Pb│H2SO4│PbO2 (+)
负极(Pb):
Pb-2e-+SO42-=PbSO4
正极(PbO2):
PbO2+2e-+4H++SO42-
=PbSO4+2H2O
电池总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O 1、铅蓄电池 缺点:比能量低、笨重、废弃电池污染环境
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池:镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……铅蓄电池的充放电过程:铅蓄电池的优缺点简析:2、银锌蓄电池负极:Zn-2e-+2OH-=Zn(OH)2 正极:Ag2O+2e-+H2O=2Ag+2OH-银-锌蓄电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:3、镉镍电池负极材料:Cd; 正极材料:涂有NiO2,
电解质:KOH溶液。 特点:比铅蓄电池耐用,可密封反复使用。 负极:Cd-2e-+2OH-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-大有发展前景的燃料电池
??????? 燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能的一类原电池。目前燃料电池的能量转化率可达近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池的噪声及硫氧化物、氮氧化物等废气污染都接近零;燃料电池发明于19世纪30年代末,经反复试验、改进,到20世纪60年代才开始进入实用阶段。第一代燃料电池的?大致情况如下: ???三、燃料电池氢氧燃料电池燃料电池 优点:能量转化率高,可持续使用,对环境友好 用途:宇宙飞船,应用前景广阔负极 : 2H2+4OH--4e-=4H2O 正极 : O2+2H2O+4e-=4OH- 总反应方程式 :
2H2+O2=2H2O燃 料 电 池2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-2H2 +4OH-- 4e- = 4H2O O2 + 2H2O + 4e-= 4OH-固体燃料电池2H2 - 4e- +2O2-= 2H2O O2 + 4e-= 2O2- 2H2 - 4e- = 4H+ O2 + 4H+ + 4e-= 2H2O 航天技术上使用的一种电池,它具有高能、轻便、不污染环境等优点。用Pt做电极,KOH溶液做电解液,因其反应与氢氧燃烧相似,故称为氢氧燃烧电池。请写出各电极的电极反应。氢氧燃料电池若将氢气换成甲烷,写出各电极的电极反应将铂丝插入KOH溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池,根据两极上反应的实质判断,通入甲烷的一极为____,这一极的电极反应为___________________;通入氧气的一极为_______,电极反应为
__________________________________,总反应为__________________________。负极CH4-8e-+10OH-=CO32-+7H2O正极O2+4e-+2H2O=4OH-CH4+2O2+2KOH=K2CO3+3H2O若将氢气换成甲烷,写出各电极的电极反应1、仅有一个电极材料参与反应的原电池:
负极:M-xe=Mx+
正极:析氢或吸氧或析出不活泼金属
2、两个电极均参与反应的原电池
(如蓄电池,纽扣电池)
①电极材料:金属为负极,金属化合物为正极.课 堂 总 结②电子得失均由两电极本身发生.
③电极反应需考虑电解质溶液的参与.
3、电极材料本身均不参与反应的电池(燃料电池)
①两电极材料均为惰性电极.
②负极-可燃性气体失电子,正极-助燃性气体得
电子.
③电极反应考虑电解质溶液.书写电极反应式应注意以下几点:1.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。1、在含有H2S气体的空气中,银器表面易变黑(生成了
Ag2S),原因是银发生了 (填析氢或吸氧)腐蚀,其电极反应式为:负极 正极 ,最终在表面生成Ag2S的离子反应方程式为 .为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,请用电极反应式和离子方程式表示上述过程.巩 固 练 习Al-3e-=Al3+Ag2S+2e-=2Ag+S2-2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S?2、熔融盐燃料电池具有较高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极燃气,制得在65℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2CO32-=4CO2+4e
正极反应式:
总反应式:O2+4e-+2CO2=2CO32-2CO+O2=2CO23.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+B4Al-12e=4Al3+3O2+6H2O+12e=12OH-不活泼金属或碳Cu2Fe3++2e=2Fe2+Cu-2e=Cu2+6、已知:铅蓄电池充电完毕后,电池中硫酸的密度为?1,放电完毕后,溶液的密度变为? 2。又铅蓄电池充电时的反应:
2PbSO4+2H2O Pb+PbO2+2H2SO4
法拉第常数:F=96500C/mol
⑴写出铅蓄电池使用时所产生的总反应式及两电极上的半反应。
⑵已知充放电完毕后,溶液的密度是下列两个数据:1.10g/cm3,相当于含14.35%(质量)的硫酸,1.28g/cm3,相当于含36.87% (质量)的硫酸请指出分别?1, ? 2对应于哪一个数据?
⑶用什么方法可以确定什么时候该充电什么时候该停止充电?
⑷按方程式计算生成及消耗的水和硫酸的质量。
⑸计算一个电容量为4.32×106C的蓄电池中需加多少硫酸?
⑹用久了的铅蓄电池会对环境造成污染,为什么?充电中学化学资料网版权所有 http://www.e-huaxue.com 7、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2mol电子,锌的质量理论上减小6?5gC8、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
________________________
此时电池内总的反应式 :
________________________CH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O
