第四节 金属的电化学腐蚀与防护(广东省深圳市)
文档属性
| 名称 | 第四节 金属的电化学腐蚀与防护(广东省深圳市) |

|
|
| 格式 | rar | ||
| 文件大小 | 254.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-01 00:00:00 | ||
图片预览





文档简介
课件17张PPT。金 属 的
存在形式K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au冶炼
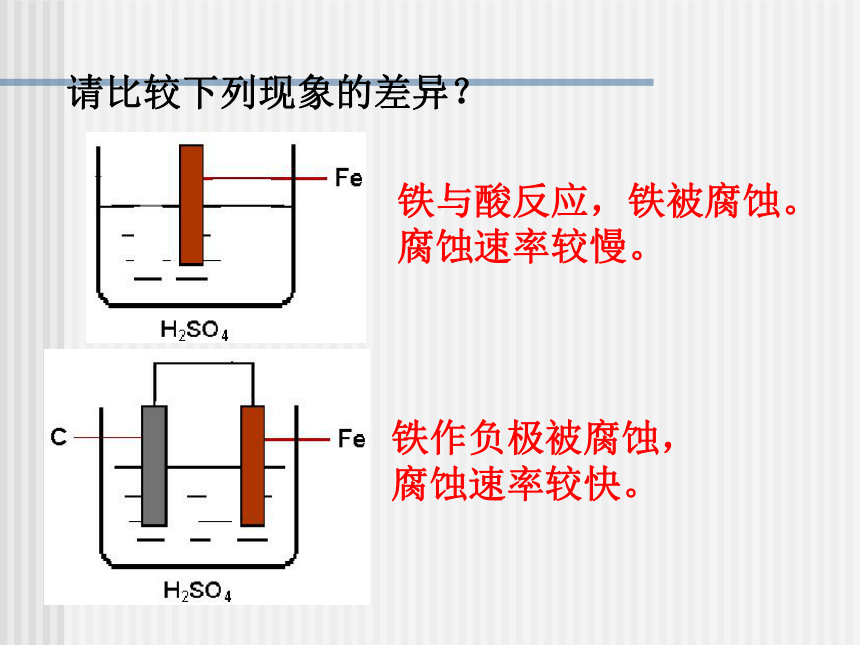
方法关于金属冶炼的补充知识1、电解法(K—Al)2、还原法(Zn—Cu)常用还原剂有:C、CO、H2、Al等3、热分解法(Hg—Ag) 第四章 电化学基础第4节 金属的电化学腐蚀与防护请比较下列现象的差异?铁与酸反应,铁被腐蚀。
腐蚀速率较慢。铁作负极被腐蚀,
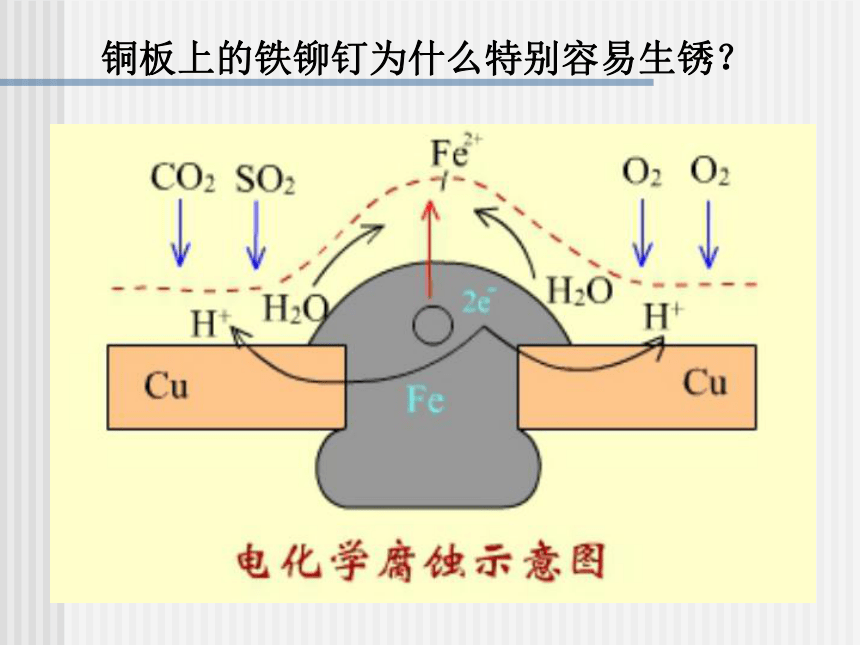
腐蚀速率较快。铜板上的铁铆钉为什么特别容易生锈? 金属制品的腐蚀金属腐蚀给生产生活带来很多不便,造成了巨大的经济损失。
全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%,钢铁因腐蚀而报废的数量约占钢铁当年产量的25%-30%。
金属腐蚀还可能造成环境污染。资
料
在
线一、金属腐蚀的本质:
是金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
M - ne- = Mn+
二、金属腐蚀的类型:
(1)化学腐蚀
金属跟接触到的物质直接发生化学反应而引起的腐蚀叫做化学腐蚀。
(2)电化学腐蚀
不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,
但电化学腐蚀更普遍钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图钢铁在潮湿的空气中发生的电化学腐蚀的原理:
负极(Fe): Fe—2e— = Fe2+
正极(C): 2H++2e— = H2↑
或2H2O+O2+4e— = 4OH—钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)水膜呈酸性水膜呈中性或酸性很弱Fe-2e-=Fe2+2Fe-4e-=2Fe2+2H2O+2e-=H2↑+2OH-O2+2H2O+4e-=4OH-Fe+2H2O=Fe(OH)2+H2↑2Fe+2H2O+O2=2Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3金属的腐蚀以电化腐蚀为主,
电化腐蚀又以吸氧腐蚀为主(pH≥5.6时)
若pH<5.6时则为析氢腐蚀。2H++2e— = H2↑Fe +2H+= Fe2+ H2↑三、金属的防护
(1)制成合金(不锈钢)——改善金属的内部组织结构(内因)
(2)在金属表面覆盖保护层——电镀、油漆、钝化等
(3)电化学保护法——牺牲阳极的阴极保护法、外加直流电源的阴极保护法 牺牲阳极保护法
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。外加电流法
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。[交流研讨]
你知道自行车的金属部件采用了什么样的防护措施吗?金属常用防腐蚀方法的比较1.解释下列现象并写出有关原电池的电极反应:
(1)马口铁(镀Sn铁皮)做的罐头,打开后为什么极易生锈?
(2) 轮船船壳的水线以下部分,为什么要装上一定数量Zn块?
(3)在一块表面无锈的铁片上滴一滴含酚酞的食盐水,放置一段时间后可以看到液滴周围逐渐呈现红色,并慢慢形成红褐色的锈斑。
(4)烧过菜的铁锅未及时洗净(残液NaCl),第二天便出现红褐色锈斑。练习2、分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:
_________________________
(2)碳棒上的电极反应式为:
_________________________
(3)溶液中发生反应的化学方程式:
_________________________
_________________________2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+练习 H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率 Zn置换出Cu形成了原电池,从而加快了反应速率3、盐酸与锌片反应时,若加入可溶性醋酸铜晶体[(CH3COO)2Cu],将产生两种影响生成速率的因素,其一是:___________________________
_____________________________________,其二是:_______________________________
_____________________________________。练习
存在形式K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au冶炼
方法关于金属冶炼的补充知识1、电解法(K—Al)2、还原法(Zn—Cu)常用还原剂有:C、CO、H2、Al等3、热分解法(Hg—Ag) 第四章 电化学基础第4节 金属的电化学腐蚀与防护请比较下列现象的差异?铁与酸反应,铁被腐蚀。
腐蚀速率较慢。铁作负极被腐蚀,
腐蚀速率较快。铜板上的铁铆钉为什么特别容易生锈? 金属制品的腐蚀金属腐蚀给生产生活带来很多不便,造成了巨大的经济损失。
全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
我国因金属腐蚀造成的损失占国民生产总值(GNP)的4%,钢铁因腐蚀而报废的数量约占钢铁当年产量的25%-30%。
金属腐蚀还可能造成环境污染。资
料
在
线一、金属腐蚀的本质:
是金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
M - ne- = Mn+
二、金属腐蚀的类型:
(1)化学腐蚀
金属跟接触到的物质直接发生化学反应而引起的腐蚀叫做化学腐蚀。
(2)电化学腐蚀
不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化的腐蚀叫做电化学腐蚀。化学腐蚀和电化学腐蚀的比较化学腐蚀和电化学腐蚀同时发生,
但电化学腐蚀更普遍钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图钢铁在潮湿的空气中发生的电化学腐蚀的原理:
负极(Fe): Fe—2e— = Fe2+
正极(C): 2H++2e— = H2↑
或2H2O+O2+4e— = 4OH—钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)水膜呈酸性水膜呈中性或酸性很弱Fe-2e-=Fe2+2Fe-4e-=2Fe2+2H2O+2e-=H2↑+2OH-O2+2H2O+4e-=4OH-Fe+2H2O=Fe(OH)2+H2↑2Fe+2H2O+O2=2Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3金属的腐蚀以电化腐蚀为主,
电化腐蚀又以吸氧腐蚀为主(pH≥5.6时)
若pH<5.6时则为析氢腐蚀。2H++2e— = H2↑Fe +2H+= Fe2+ H2↑三、金属的防护
(1)制成合金(不锈钢)——改善金属的内部组织结构(内因)
(2)在金属表面覆盖保护层——电镀、油漆、钝化等
(3)电化学保护法——牺牲阳极的阴极保护法、外加直流电源的阴极保护法 牺牲阳极保护法
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。外加电流法
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。[交流研讨]
你知道自行车的金属部件采用了什么样的防护措施吗?金属常用防腐蚀方法的比较1.解释下列现象并写出有关原电池的电极反应:
(1)马口铁(镀Sn铁皮)做的罐头,打开后为什么极易生锈?
(2) 轮船船壳的水线以下部分,为什么要装上一定数量Zn块?
(3)在一块表面无锈的铁片上滴一滴含酚酞的食盐水,放置一段时间后可以看到液滴周围逐渐呈现红色,并慢慢形成红褐色的锈斑。
(4)烧过菜的铁锅未及时洗净(残液NaCl),第二天便出现红褐色锈斑。练习2、分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:
_________________________
(2)碳棒上的电极反应式为:
_________________________
(3)溶液中发生反应的化学方程式:
_________________________
_________________________2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+练习 H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率 Zn置换出Cu形成了原电池,从而加快了反应速率3、盐酸与锌片反应时,若加入可溶性醋酸铜晶体[(CH3COO)2Cu],将产生两种影响生成速率的因素,其一是:___________________________
_____________________________________,其二是:_______________________________
_____________________________________。练习
