第三节 化学反应热的计算(广东省深圳市)
文档属性
| 名称 | 第三节 化学反应热的计算(广东省深圳市) |

|
|
| 格式 | rar | ||
| 文件大小 | 274.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-01 00:00:00 | ||
图片预览






文档简介
课件21张PPT。第三节 化学反应热的计算H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol 下列数据△H1表示H2的燃烧热吗?复习25℃,101kPa下,1mol纯物质完全燃烧生成最稳定的化合物所放出的热量。H2(g)+1/2O2(g)==H2O(l) △H2=-285.8kJ/mol那么,H2的燃烧热△H究竟是多少?【交流研讨】对于下列化学反应:
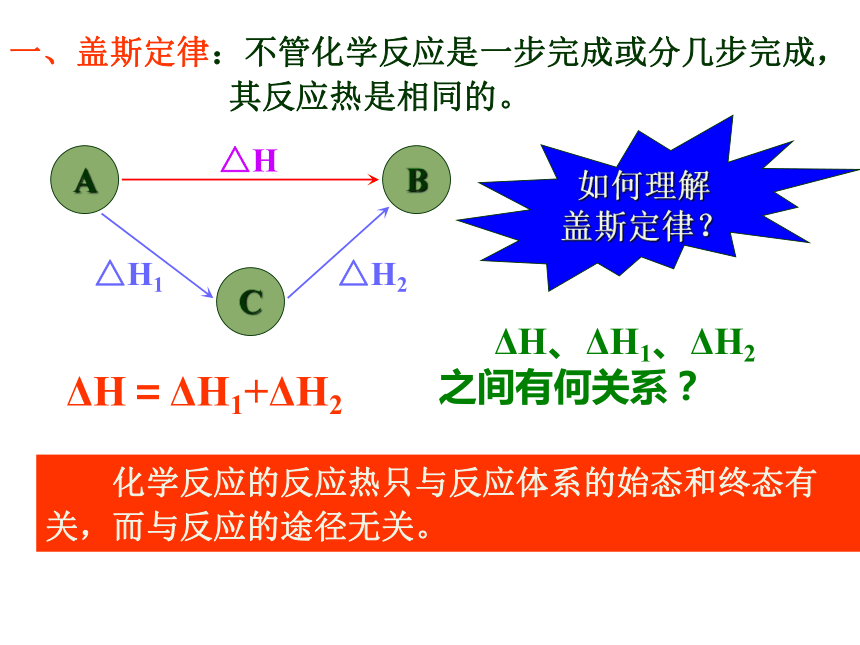
C(s)+1/2O2(g)==CO(g) ΔH1=?1.其反应热能否直接准确测出?如果能,应如何测?如果不能,为什么?2.怎样解决这个问题呢?一、盖斯定律一、盖斯定律:不管化学反应是一步完成或分几步完成,
其反应热是相同的。 化学反应的反应热只与反应体系的始态和终态有
关,而与反应的途径无关。 ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2△H△H1△H2如何理解
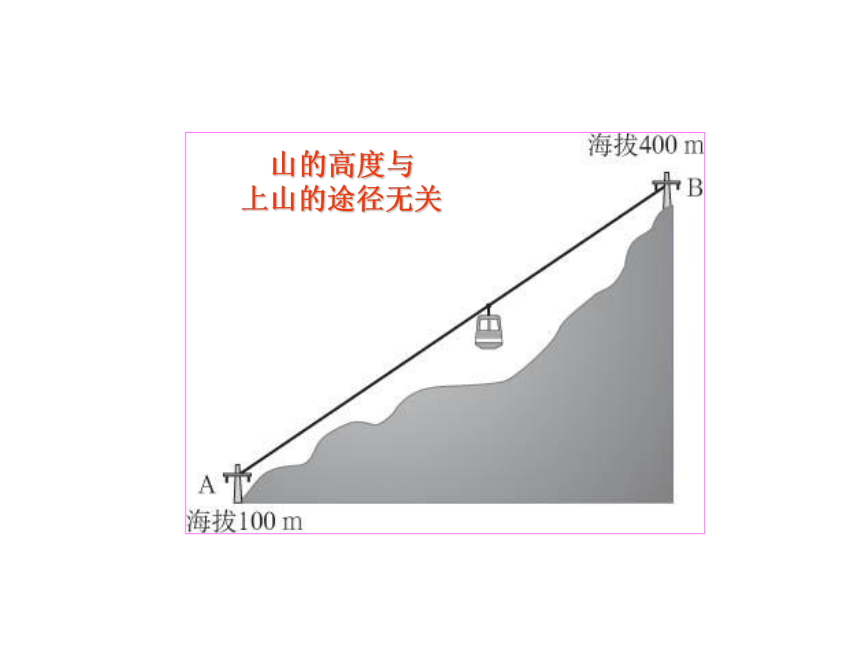
盖斯定律?山的高度与
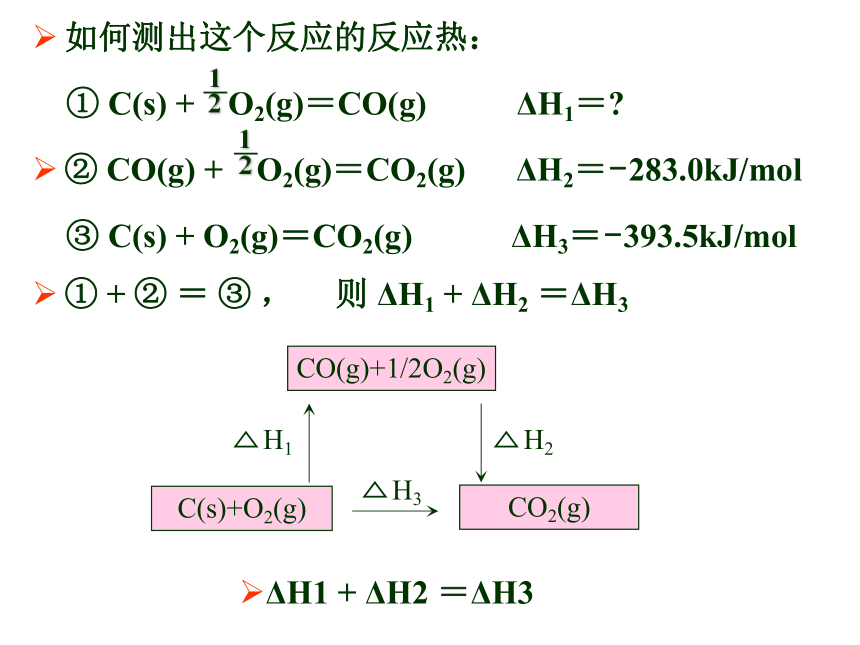
上山的途径无关如何测出这个反应的反应热:
① C(s) + O2(g)=CO(g) ΔH1=?
② CO(g) + O2(g)=CO2(g) ΔH2=-283.0kJ/mol
③ C(s) + O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3
ΔH1=ΔH3-ΔH2
=-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol应用了什么规律 ?如何测出这个反应的反应热:
① C(s) + O2(g)=CO(g) ΔH1=?
② CO(g) + O2(g)=CO2(g) ΔH2=-283.0kJ/mol
③ C(s) + O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3CO(g)+1/2O2(g)C(s)+O2(g)CO2(g)ΔH1 + ΔH2 =ΔH3一、盖斯定律二、盖斯定律的应用: 因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来。三、反应热的 计算【解】钠与氯气起反应的化学方程式如下Na(s) + 1/2Cl2(g)== NaCl (s)23g △H 1.0g -17.87kJ/mol △H=23g×(-17.87kJ/mol)÷ 1.0g
=-411kJ/mol答: 【例1】25℃、101kPa时,将1.0g钠跟足量的氯气
反应,生成氯化钠晶体并放出17.87kJ的热量,求生成
1mol氯化钠的反应热。【解】C2H6O(l) + 3O2(g)=2CO2(g)+3H2O (l) 46g -1366.8 1000g XX=(-1366.8kJ × 1000g)/ 46g
=-29710kJ答:1kg乙醇燃烧后放出29710kJ热量解:设1kg乙醇燃烧后放出的热量为X【例2】乙醇的燃烧热△H=-1 366.8kJ·mol-1,在25℃、101kPa时,1kg乙醇充分燃烧后放出多少热量?课本P13 例3:【思考】你能利用盖斯定律设计合理的反应途径吗?试用图示来表示你的思路。方法:
将物质与反应热建立关系,列比例求解。盖斯定律的应用关键:设计合理的反应过程,正确进行已知方程式和反应热的加减合并,以得到目标方程式和所求反应热。 某次发射火箭,用N2H4(肼)
在NO2中燃烧,生成N2、液态H2O。
已知:
N2(g) + 2O2(g)=2NO2(g) △H1=+67.2kJ/mol
N2H4(g) + O2(g)=N2(g) + 2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热
化学方程式。
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(l)
△H=-1135.2kJ/mol 你知道神六的火箭燃料是什么吗?1.已知下列热化学方程式:
(1)Zn(s)+1/2O2(s)===ZnO(s) ΔH1= -351.1kJ/mol
(2)Hg(l)+1/2O2(g)===HgO(s) ΔH2= -90.71kJ/mol
则反应:
(3)Zn(s)十HgO(s)==ZnO(s)+Hg(l) ΔH3,其中ΔH3的值为( )
A.-441.8kJ/mol B.-254.6kJ/mol
C.-438.9kJ/mol D.-260.4kJ/mol【巩固练习】D2.已知298K时,合成氨反应:
N2(g)+3H2(g)=2NH3(g) △H1=-92.0kJ/mol ,
将此温度下的1molN2和3molH2放在密闭容器中反应,测得反应放出的热的数值为( )
A一定小于92.0kJ B一定大于92.0kJ
C一定等于92.0kJ D无法确定3.充分燃烧一定量的丁烷,放出热为Q.完全吸收它生成CO2生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热△H为______________。A-16QKJ/mol4.已知: H2O ( g ) = H2O( l ) ΔH = Q1 kJ/mol C2H5OH(g) = C2H5OH(l) ΔH = Q2kJ/mol C2H5OH(g) +3O2 (g) = 3H2O(g)+ 2CO2 (g) ΔH=Q3kJ/mol 若使23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为_____________ KJ 。(Q3-Q2+3Q1)/24、已知0.5 mol甲烷与0.5 mol水蒸汽在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是: 。
5、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);
△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);
△H=-1 400 kJ/molD 6.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A 7.已知H2 ( g ) + 1/2O2 ( g ) = H2O ( g ) ,反应过程中能量变化如下图:反应过程能量abH2 ( g ) + 1/2O2 ( g )=2H ( g ) + O ( g )
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”) (1)活化能,反应热;(2)放热, △H<0;8、已知(a)2H2(g)+O2=2H2O(g) △H = -Q1
(b)2H2(g)+O2=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1 (填>、=、<)Q2,因
为 。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是:
。 (1)<,H2O(g)=H2O(l) △H<0 (2)Q1/Q3
C(s)+1/2O2(g)==CO(g) ΔH1=?1.其反应热能否直接准确测出?如果能,应如何测?如果不能,为什么?2.怎样解决这个问题呢?一、盖斯定律一、盖斯定律:不管化学反应是一步完成或分几步完成,
其反应热是相同的。 化学反应的反应热只与反应体系的始态和终态有
关,而与反应的途径无关。 ΔH、ΔH1、ΔH2
之间有何关系?ΔH=ΔH1+ΔH2△H△H1△H2如何理解
盖斯定律?山的高度与
上山的途径无关如何测出这个反应的反应热:
① C(s) + O2(g)=CO(g) ΔH1=?
② CO(g) + O2(g)=CO2(g) ΔH2=-283.0kJ/mol
③ C(s) + O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3
ΔH1=ΔH3-ΔH2
=-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol应用了什么规律 ?如何测出这个反应的反应热:
① C(s) + O2(g)=CO(g) ΔH1=?
② CO(g) + O2(g)=CO2(g) ΔH2=-283.0kJ/mol
③ C(s) + O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ , 则 ΔH1 + ΔH2 =ΔH3CO(g)+1/2O2(g)C(s)+O2(g)CO2(g)ΔH1 + ΔH2 =ΔH3一、盖斯定律二、盖斯定律的应用: 因为有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接地把它们的反应热计算出来。三、反应热的 计算【解】钠与氯气起反应的化学方程式如下Na(s) + 1/2Cl2(g)== NaCl (s)23g △H 1.0g -17.87kJ/mol △H=23g×(-17.87kJ/mol)÷ 1.0g
=-411kJ/mol答: 【例1】25℃、101kPa时,将1.0g钠跟足量的氯气
反应,生成氯化钠晶体并放出17.87kJ的热量,求生成
1mol氯化钠的反应热。【解】C2H6O(l) + 3O2(g)=2CO2(g)+3H2O (l) 46g -1366.8 1000g XX=(-1366.8kJ × 1000g)/ 46g
=-29710kJ答:1kg乙醇燃烧后放出29710kJ热量解:设1kg乙醇燃烧后放出的热量为X【例2】乙醇的燃烧热△H=-1 366.8kJ·mol-1,在25℃、101kPa时,1kg乙醇充分燃烧后放出多少热量?课本P13 例3:【思考】你能利用盖斯定律设计合理的反应途径吗?试用图示来表示你的思路。方法:
将物质与反应热建立关系,列比例求解。盖斯定律的应用关键:设计合理的反应过程,正确进行已知方程式和反应热的加减合并,以得到目标方程式和所求反应热。 某次发射火箭,用N2H4(肼)
在NO2中燃烧,生成N2、液态H2O。
已知:
N2(g) + 2O2(g)=2NO2(g) △H1=+67.2kJ/mol
N2H4(g) + O2(g)=N2(g) + 2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热
化学方程式。
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(l)
△H=-1135.2kJ/mol 你知道神六的火箭燃料是什么吗?1.已知下列热化学方程式:
(1)Zn(s)+1/2O2(s)===ZnO(s) ΔH1= -351.1kJ/mol
(2)Hg(l)+1/2O2(g)===HgO(s) ΔH2= -90.71kJ/mol
则反应:
(3)Zn(s)十HgO(s)==ZnO(s)+Hg(l) ΔH3,其中ΔH3的值为( )
A.-441.8kJ/mol B.-254.6kJ/mol
C.-438.9kJ/mol D.-260.4kJ/mol【巩固练习】D2.已知298K时,合成氨反应:
N2(g)+3H2(g)=2NH3(g) △H1=-92.0kJ/mol ,
将此温度下的1molN2和3molH2放在密闭容器中反应,测得反应放出的热的数值为( )
A一定小于92.0kJ B一定大于92.0kJ
C一定等于92.0kJ D无法确定3.充分燃烧一定量的丁烷,放出热为Q.完全吸收它生成CO2生成正盐,需5mol/L的KOH溶液100mL,则丁烷的燃烧热△H为______________。A-16QKJ/mol4.已知: H2O ( g ) = H2O( l ) ΔH = Q1 kJ/mol C2H5OH(g) = C2H5OH(l) ΔH = Q2kJ/mol C2H5OH(g) +3O2 (g) = 3H2O(g)+ 2CO2 (g) ΔH=Q3kJ/mol 若使23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为_____________ KJ 。(Q3-Q2+3Q1)/24、已知0.5 mol甲烷与0.5 mol水蒸汽在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是: 。
5、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);
△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);
△H=-1 400 kJ/molD 6.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A 7.已知H2 ( g ) + 1/2O2 ( g ) = H2O ( g ) ,反应过程中能量变化如下图:反应过程能量abH2 ( g ) + 1/2O2 ( g )=2H ( g ) + O ( g )
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”) (1)活化能,反应热;(2)放热, △H<0;8、已知(a)2H2(g)+O2=2H2O(g) △H = -Q1
(b)2H2(g)+O2=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1 (填>、=、<)Q2,因
为 。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是:
。 (1)<,H2O(g)=H2O(l) △H<0 (2)Q1/Q3
