水的净化与污水处理
图片预览











文档简介
课件50张PPT。第一单元
水的净化与污水处理
专题1 多样化的水处理技术我们的将来…… 我们都知道水是宝贵的自然资源,那么自然界中的水都是纯水吗?一、珍惜水资源天然水中所含的杂质(见P2表1-1 )
回顾分散系的有关性质你知道吗?
1、除了固体杂质和悬浮物以外,还需要除去天然水中的哪些杂质,才能符合生活用水的标准?
2、要给天然水杀菌消毒,可以使用哪些方法?
3、人们有时候觉得自来水“有漂白粉气味”,这是什么原因?用氯气给自来水消毒利用了氯气的什么性质?请写出有关反应的化学方程式。
4、结合图1-3完成课后P8的习题3,体会自来水厂净化天然水的设计意图,写出相关的方程式。
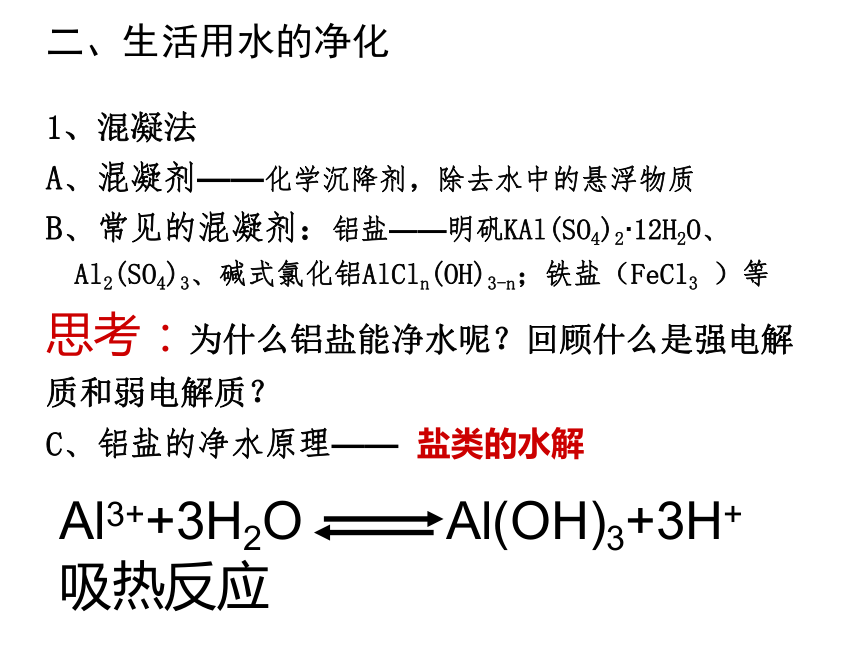
5、自来水能直接饮用吗?理由是什么?二、生活用水的净化
1、混凝法
A、混凝剂——化学沉降剂,除去水中的悬浮物质
B、常见的混凝剂:铝盐——明矾KAl(SO4)2·12H2O、
Al2(SO4)3、碱式氯化铝AlCln(OH)3-n;铁盐(FeCl3 )等
思考:为什么铝盐能净水呢?回顾什么是强电解质和弱电解质?
C、铝盐的净水原理—— 盐类的水解习题巩固:
1、在净水过程中用到混凝剂,其中可以作为混凝剂使用的是 ( ) A、偏铝酸钠 B、氧化铝
C、氯化铝 D、明矾
2、下列广告用语在科学上没有错误的是( )A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.没有水就没有生命习题巩固:
3、下列过程中,不涉及化学变化的是 ( ) A.甘油加水作护肤剂
B.用明矾净水 C.烹鱼时加入少量的料酒和食醋可减少腥味,
增加香味 D.烧菜用过的铁锅,经放置常出现红棕色斑迹
4、长时间烧沸的天然水不宜喝的主要原因是
( ) A.水中的氧气少了
B.水中的亚硝酸盐浓度大了 C.水中的钙镁离子多了
D.水中的二氧化碳多了观看自来水净化过程录像,讨论:1、处理过程包括了哪些环节?每个环节中涉及了哪些化学反应?
2、用了什么消毒剂?氯气对人体有害吗?有哪些更好的消毒剂?
3、有些自来水厂在Cl2对水进行消毒时,还加入一定量的氨,使氨和Cl2生成氯胺(NH2Cl)。氯胺能在水中缓慢水解生成HClO,延长对水的消毒时间,提高消毒效果。你知道这是为什么吗?
4、你对该厂的自来水处理过程有什么意见和建议?思考:
天然水中含有细菌,主要成分为蛋白质。请你举出几种杀死水中细菌的简单方法。2、消毒、杀菌
A、少量的水常用加热煮沸法使细菌蛋白质变性杀菌
消毒
B、大量的水采用强氧化剂(杀菌消毒剂)
常用杀菌消毒剂:氯气、漂白粉、臭氧、二氧化氯3、沉降、消毒二合一: Na2FeO4
4、除臭剂:活性炭练习:目前,科学家致力于研制高效、安全、无毒的饮用水消毒剂。 (1)近年来,某些自来水厂在用液氯进行处理的同时还加入少量液氨,其反应的化学方程为:NH3+HClO==H2O+NH2Cl(一氯氨)。NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因是:_____________________________________________________。 (2)科研人员发现在氯消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。世界环保联盟即将全面禁止在自来水中加氯气,推广采用光谱性高效杀菌消毒剂二氧化氯(ClO2,黄绿色气体)。目前欧洲和我国主要采用Kesting法(原料为氯酸钠和盐酸)制ClO2,该法的缺点是同时产生Cl2(占ClO2体积的一半),使产物纯度低。 ①试写出该法制ClO2的化学反应方程式:______________________________________________。 ②Cl2和ClO2都是通过氧化作用而杀菌消毒,试计算在等质量时,ClO2的氧化能力是Cl2的 倍。 加液氨后,使HClO部分转化为稳定的NH2Cl,当HClO开始消耗后,平衡左移又产生HClO起杀菌作用 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O 2.63 三、城市自来水的获取——生产流程
1、取水
2、曝气:把水暴露在空气中,使水与空气接触面增
大,增大水中氧气的含量,以加速有机物
的分解。
3、沉降:在沉淀池中加入混凝剂静止,水中的悬浮
无可沉降到池底。
4、过滤:使水通过粗沙、细沙,除去沉淀和残余的
悬浮物。
5、消毒:加入消毒剂杀灭水中有毒微生物曝气池生活向导终端净水
自来水需要经过很长的管道才能进入千家万户,由于种种原因自来水在使用之前便受到污染,这种污染称为二次污染。现在提倡终端净水即:在家中的出水点前加装净化设备,消除二次污染,使饮用水更安全、更可靠。
人类生存离不开阳光、空气和水。当人类步入21世纪之时,人的生命之源——水却向人们发出了警报:世界缺水,中国缺水 水污染是导致缺水的一个重要因素,我国的
水污染已十分严重。三、水污染
1、水污染:由于人类的生活或生产活动改变了天然水的物
理、化学或生物学的性质和组成,影响人类对
水的利用价值或危害人类健康,称为水污染 在洗“牛奶浴”的赞比亚民工水上垃圾随处可见城 市 水 污 染缺水造成土地沙漠化臭美溃烂黑水和泡末愁容调查研究:
1、阅读本节调查研究思考水体富营养化是如何产生的?你认为该污染主要由表中哪些因素导致?
2、DO和BOD的含义是什么?BOD5的含义是什么?为什么BOD5高,河水就会出现恶臭?
3、你了解的处理污水的方法有哪些?该方法主要用于处理怎样的污水?水的第四种形态五十年代淘米洗菜 ; 六十年代洗衣灌溉; 七十年代水质败坏 ; 八十年代鱼虾绝代 ; 九十年代拉稀生癌。水啊水,爱你就是爱自己习题巩固:
1、国际上提出“预防污染”这一新概念,绿色化学是“预防污染”的基本手段,下列各项中属于绿色化学的是 A、处理废弃物 B、治理污染点
C、减少有毒物 D、杜绝污染源
2、新华社报道:我国太湖因蓝藻疯狂繁殖而造成水质的严重污染。
(1)蓝藻的疯狂生长说明湖水中哪些元素超标 ;
(2)蓝藻的疯长会如何破坏生态平衡?
(3)已知洗衣粉的成分为(Na5P3O10),三聚磷酸钠,已知三聚磷酸是三个H3PO4分子脱2分子水形成的,写出H3PO4、三聚磷酸的结构式。
(4)青岛市政府规定从今年禁止磷洗衣粉使用,而把其中的Na5P3O10用Na2SiO3代替,写出其软化硬水时离子方程式。 N、P3、工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法: 以铁作为电极进行电解 鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准,其原理是: ① 将Cr2O72-离子还原为可溶性三价铬离子。 ②电解除铬过程中,使溶液的PH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变成不溶性氢氧化物除去。 根据上述内容回答下列问题: (1)用铁作电极电解时,电极反应式为: 阳极 ,阴极 。 (2)在水溶液中将Cr2O72-离子还原成Cr3+的还原剂是溶液中的 离子,此氧化还原反应的离子方程式是 。 (3)在处理废水中使溶液的PH不断升高,由酸性转变碱性是通过 和 途径来实现的。 (4)将Cr3+转变成不溶性氢氧化物的离子反应式为 ,同时还有 生成Fe - 2e- = Fe2+2H+ + 2e- = H2 ↑Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2)反应消耗H+阴极H+放电Fe(OH)35、河道旁有甲乙两工厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。 (1)甲厂的废水明显呈碱性,故甲厂废水中所含三种离子是 、 、 。 (2)乙厂的废水中含有另外三种离子,如果加一定量 (活性炭、FeSO4、铁粉)可以回收其中的金属 。 (3)另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的 转化为沉淀,经过滤后的废水主要含 ,可用来_______。 OH-K+Cl-FeAgCl、Fe(OH)3KNO3施肥2、 污水中的主要污染物四、水污染的检测项目
1、水的理化性质——色度、浊度、PH等
2、无机物——溶解氧(DO)、某些金属离子、氯离
子、硫酸根离子、氮和磷的化合物等
3、有机物——通常测定生化需氧量(BOD)资料卡
水的DO与BOD
DO——水中的溶解氧量(单位:mg/L)
BOD——水中有机物经微生物分解所需的氧气量(单位:mg/L)
污水中有机物的含量越大,BOD越高,水的富营养化程度越高4、在自然净化中要把有机污染物自发地转变为简单的无机物质,需要水中含有一定的氧气,使有机物(C,H,O)+O2→CO2+H2O。1 L水中含有的有机物质转变为无机物所需要的氧的量称为生化需氧量(BOD),用g·L-1为单位表示。如果水中的氧气比BOD少,水就发臭,鱼和其他淡水生物就不能生存。若某地区一条河水中含有机物0.01g/L,此有机物分子式用C6H10O5表示,而在正常大气条件下,氧气在水中的溶解量是0.0092 g·L-1。 (1)写出有机物在有氧条件下转化为无机物的化学方程式。 (2)这条河水的BOD是多少?河水中的鱼类能否维持生命?C6H10O5 + 6O2 → 6CO2 + 5H2O 设每升水中有机物需氧气X,则 ??? C6H10O5 + 6O2 → 6CO2 + 5H2O ??? 162???? 192 ??? 0.01? ??? X ??? 解得X= 0.0119克/升 ??? 河水中的鱼类能否维持生命?不.说明原因:BOD超过水中的含氧量,所以鱼类等到不能生存1、物理处理法——主要是利用物理原理和机械作用对废水进行治理,如过滤、离心、沉淀分离等方法
2、化学处理法——通过施用化学试剂或采用其他化学手段进行废水处理的方法,
如化学混凝法
中和法[轧钢厂中的废水(酸性)]
化学沉淀法(废水中重金属离子的除去)
氧化还原法(油类、氰化物、硫化物)等方法五、污水处理的主要方法常用的氧化剂:空气、臭氧、氯气等如:1、Fe2+的除去:用石灰水、空气将Fe2+转化Fe(OH)3除去
2、Cr3+的除去:用石灰水调节PH至8∽9时, Cr3+形成沉淀除去2Cr3+ + 3Ca(OH)2 = Cr(OH)3 + 3Ca2+3、物理化学处理法 ——通过物理化学过程来除去污染
物的方法,如吸附、电渗析、反渗透、超过滤等方法 4、 生物处理法——利用微生物的作用,除去废水中的
溶胶物质及有机物质的方法,如好氧生物处理、活性
污泥法、生物滤池、厌氧生物处理法 等减少污水的排放量——从源头处理污水的有效手段六、城市污水的再利用
城市污水中工业污水约占70%,其次是生活污水。工业污
水中含有含有某些宝贵的资源,可回收加工利用
水的区别
天然水——取自地面或地下的水;商品中经过包括过滤、臭氧
化或其他消毒处理过程,而不改变其矿化度的瓶装
泉水、矿泉水或井水也称为天然水
自来水——经过自来水厂过滤、消毒等方法处理过的水
中水——城市污水处理后,进行二次利用的一类水
蒸馏水——利用蒸馏设备使水蒸发汽化,然后使水蒸气冷凝而
成的水磁化水——经磁场作用,交叉切割磁力线,分
子结构发生改变,完成磁化过程的水。
矿泉水——流经某些岩石层的深层地下水。
纯净水——经纯化处理后的水。因宇航员最早饮 用的是这种水,故也叫太空水。但是在纯化过程中,不仅除去了水中的细菌、病毒、污染物等杂质,也除去了对人体有益的微量元素和矿物质,如钙、镁等几乎被除净。 使用自来水时应注意:
1、警惕早晨“死水杀手”
2、拒绝饮用反复煮沸的水
3、不喝没有完全煮沸的水来水,水中的有 害病菌必须达到100℃时才能被完全杀死。
4、家用滤水器 自制简易净水装置第二单元 硬水软化专题1 多样化的水处理技术被污染的河水自来水海水矿泉水蒸馏水纯净水 水是生命之源,同学你会喝水吗?同学你有过“水土不服”的体验吗?下列是生活中常见的一些水,它们都是纯净物吗?都能直接饮用吗?一、软水和硬水1.天然水成分:
Ca2+、Mg2+、Na+、Mg2+、HCO3-、CO32-、Cl-、SO42-、NO3-
2.硬水:
溶有较多量的Ca2+和Mg2+的水
3.软水:
只溶有较少量或不含Ca2+和Mg2+的水简单鉴别:肥皂反应
软水中产生泡沫多;
硬水中形成较多白色垢状物。软水与硬水的简单鉴别1、硬度:一般是指水里的钙、镁离子浓度的总和。
水的硬度的表示方法:阅读P9表1-3
2、硬水——8度以上的水
3、暂时硬度
若水的硬度是由碳酸氢钙或碳酸氢镁引起的,这种硬度称为暂时硬度
4、永久硬度
若水的硬度是由含有钙、镁的硫酸盐或氯化物引起的,这种硬度称为永久硬度。
以上两种硬度合称为总硬度。二、暂时硬度和永久硬度联想与启示
烧水的水壶内壁常会形成白色水垢,可以用食醋溶解去除。你知道这些水垢是怎么形成的吗?为什么可用食醋溶解去除?信息提示P10
沉淀的转化——在含有沉淀的溶液中,加入适当的沉
淀剂,使其与溶液中某一离子结合成
更难溶的物质。
如锅炉中的水垢,其中含有硫酸钙较难消除,可用碳酸钠溶液处理,使硫酸钙转化为疏松且可溶于酸的碳酸钙沉淀,这样就比较容易消除。试写出该反应的化学反应方程式。硬水的危害?和肥皂反应时产生不溶性的沉淀,降低洗涤效果。(利用这点也可以区分硬水和软水)
工业上,钙盐镁盐的沉淀会造成锅垢,妨碍热传导,严重时还会导致锅炉爆炸。由于硬水问题,工业上每年因设备、管线的维修和更换要耗资数千万元。
硬水的饮用还会对人体健康与日常生活造成一定的影响。没有经常饮硬水的人偶尔饮硬水,会造成肠胃功能紊乱,即所谓的“水土不服”;
用硬水烹调鱼肉、蔬菜,会因不易煮熟而破坏或降低食物的营养价值;
用硬水泡茶会改变茶的色香味而降低其饮用价值;
用硬水做豆腐不仅会使产量降低、而且影响豆腐
的营养成分。? 资料卡 那么硬水毫无是处了吗?不对,否则怎么会有那么多的人买矿泉水喝呢?。原来钙和镁都是生命必需元素中的宏量金属元素。科学家和医学家们调查发现,人的某些心血管疾病,如高血压和动脉硬化性心脏病的死亡率,与饮水的硬度成反比,水质硬度低,死亡率反而高。其实,长期饮用过硬或者过软的水都不利与人体健康。
我国规定:饮用水的硬度不得超过25度?,人的饮用水硬度最好介于8度—18度之间。 资料卡三、硬水软化1、加热煮沸法(此法只能消除暂时硬度,永久硬度没变化)2、药剂软化法
常用的药剂有石灰、纯碱等
Ca(HCO3)2 CaCO3
Mg(HCO3)2 Mg(OH)2
MgCl2 Mg(OH)2
CaCl2 CaCO3
Ca(OH)2 CaCO3 加入石灰,可使水中的二氧化碳、碳酸氢钙和碳酸氢镁生成碳酸钙和氢氧化镁的沉淀,对永久硬度大的硬水,可再加适量纯碱。软化时石灰添加量,根据经验,每降低一千升水中暂时硬度一度,需加纯氧化钙10克。
反应过程中,镁都是以氢氧化镁的形式沉淀,而钙都是以碳酸钙的形式沉淀。? 3、离子交换法
(1)磺化煤法
2NaR + Ca2+ = CaR2 + 2Na+
2NaR + Mg2+ = MgR2 + 2Na+
注:1、能消除暂时硬度、永久硬度
2、磺化煤可以再生利用工业上常用阴、阳离子交换树脂来软化硬水
饮料用水大都采用有机合成离子交换树脂作离子交换剂。 A、离子交换树脂的定义、组成?、类型
B、基本原理:
用离子交换树脂软化硬水时,先把水通过阳柱(装有阳离子交换树脂的离子交换柱),使水中的金属离子被阳离子交换树脂吸附,阳离子交换树脂中的氢离子被交换到水中去;然后再通过阴柱,使水中的阴离子被阴离子树脂吸附,阴离子树脂将氢氧根离子交换到水中,和氢离子化合成水,使水得到净化。
C、离子交换树脂软化硬水的方法比药剂软化法质量高、设备简单、占用面积小、操作方便? 3、离子交换法
(2)离子交换树脂?练习:
1、怎样证明天然水具有暂时硬度和永久硬度,或是软水,简述实验步骤,并写出有关化学方程式 .
2、现有纯碱、石灰、明矾和磺化煤,可用作净水的是 ,可用作软化只含CaSO4 CaCl2的硬水的是 ,可用于软化暂时硬水的是 .3、我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量。通常把1升水中含有10毫克CaO称为1度。水中的Ca2+、Mg2+可用一定浓度的Y溶液进行滴定,Y跟Ca2+、Mg2+都以等物质的量完全反应. (1) 现取某地区的地下水样品25.0毫升,用0.01摩尔/升Y溶液滴定,完全反应时消耗Y溶液15.0毫升.试计算该地下水的硬度,并判断是否符合饮用标准. (2) 如果每次分析时取的水样都是25.0毫升,为了便于计算,要求每消耗0.50毫升Y溶液即相当于水的硬度为1度.则Y溶液的物质的量浓度应为多少?(1)25.0毫升水中含Ca2+和Mg2+的总物质的量为 0.0100×0.0150=1.50×10-4 mol 折合成CaO的质量为1.50×10-4×56=8.40×10-3 g 水的硬度为8.40×10-3×(1000/25.0)×(1000/10)=33.6(度) 因硬度超过25度,故不符合饮用水标准. 或列成总式: 0.0100×0.0150×56×(1000/25.0)×(1000/10)=33.6(度) 因硬度超过25度,故不符合饮用水标准.
(2)[解法一] 25.0毫升水(硬度为1度)中含CaO的物质的量为 (0.010/56)×(2.5/1000)=4.46×10-3 mol Y溶液的浓度为4.46×10-3/0.50=8.92×10-3 mol/L [解法二][利用(1)的结果计算] 设Y溶液的浓度为C,则(0.0100×15.0):33.6=(C×0.50):1 C=8.92×10-3 mol/L正常人每天需要2500mL的水,不是饮水越多越好。
经常喝未烧开的自来水,可加大膀胱癌和直肠癌的发病率。
经常喝硬水者可增加结石的患病率。
运动员喝保健饮料,稍加点盐和糖料。
高血压病人,一般应少盐少水。
老年人和小孩最好是饮用温开水
在吃饭时适当补充水,即多增加些汤羹食品是有利于消化的。浅谈健康饮水生活向导
水的净化与污水处理
专题1 多样化的水处理技术我们的将来…… 我们都知道水是宝贵的自然资源,那么自然界中的水都是纯水吗?一、珍惜水资源天然水中所含的杂质(见P2表1-1 )
回顾分散系的有关性质你知道吗?
1、除了固体杂质和悬浮物以外,还需要除去天然水中的哪些杂质,才能符合生活用水的标准?
2、要给天然水杀菌消毒,可以使用哪些方法?
3、人们有时候觉得自来水“有漂白粉气味”,这是什么原因?用氯气给自来水消毒利用了氯气的什么性质?请写出有关反应的化学方程式。
4、结合图1-3完成课后P8的习题3,体会自来水厂净化天然水的设计意图,写出相关的方程式。
5、自来水能直接饮用吗?理由是什么?二、生活用水的净化
1、混凝法
A、混凝剂——化学沉降剂,除去水中的悬浮物质
B、常见的混凝剂:铝盐——明矾KAl(SO4)2·12H2O、
Al2(SO4)3、碱式氯化铝AlCln(OH)3-n;铁盐(FeCl3 )等
思考:为什么铝盐能净水呢?回顾什么是强电解质和弱电解质?
C、铝盐的净水原理—— 盐类的水解习题巩固:
1、在净水过程中用到混凝剂,其中可以作为混凝剂使用的是 ( ) A、偏铝酸钠 B、氧化铝
C、氯化铝 D、明矾
2、下列广告用语在科学上没有错误的是( )A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.没有水就没有生命习题巩固:
3、下列过程中,不涉及化学变化的是 ( ) A.甘油加水作护肤剂
B.用明矾净水 C.烹鱼时加入少量的料酒和食醋可减少腥味,
增加香味 D.烧菜用过的铁锅,经放置常出现红棕色斑迹
4、长时间烧沸的天然水不宜喝的主要原因是
( ) A.水中的氧气少了
B.水中的亚硝酸盐浓度大了 C.水中的钙镁离子多了
D.水中的二氧化碳多了观看自来水净化过程录像,讨论:1、处理过程包括了哪些环节?每个环节中涉及了哪些化学反应?
2、用了什么消毒剂?氯气对人体有害吗?有哪些更好的消毒剂?
3、有些自来水厂在Cl2对水进行消毒时,还加入一定量的氨,使氨和Cl2生成氯胺(NH2Cl)。氯胺能在水中缓慢水解生成HClO,延长对水的消毒时间,提高消毒效果。你知道这是为什么吗?
4、你对该厂的自来水处理过程有什么意见和建议?思考:
天然水中含有细菌,主要成分为蛋白质。请你举出几种杀死水中细菌的简单方法。2、消毒、杀菌
A、少量的水常用加热煮沸法使细菌蛋白质变性杀菌
消毒
B、大量的水采用强氧化剂(杀菌消毒剂)
常用杀菌消毒剂:氯气、漂白粉、臭氧、二氧化氯3、沉降、消毒二合一: Na2FeO4
4、除臭剂:活性炭练习:目前,科学家致力于研制高效、安全、无毒的饮用水消毒剂。 (1)近年来,某些自来水厂在用液氯进行处理的同时还加入少量液氨,其反应的化学方程为:NH3+HClO==H2O+NH2Cl(一氯氨)。NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因是:_____________________________________________________。 (2)科研人员发现在氯消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。世界环保联盟即将全面禁止在自来水中加氯气,推广采用光谱性高效杀菌消毒剂二氧化氯(ClO2,黄绿色气体)。目前欧洲和我国主要采用Kesting法(原料为氯酸钠和盐酸)制ClO2,该法的缺点是同时产生Cl2(占ClO2体积的一半),使产物纯度低。 ①试写出该法制ClO2的化学反应方程式:______________________________________________。 ②Cl2和ClO2都是通过氧化作用而杀菌消毒,试计算在等质量时,ClO2的氧化能力是Cl2的 倍。 加液氨后,使HClO部分转化为稳定的NH2Cl,当HClO开始消耗后,平衡左移又产生HClO起杀菌作用 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O 2.63 三、城市自来水的获取——生产流程
1、取水
2、曝气:把水暴露在空气中,使水与空气接触面增
大,增大水中氧气的含量,以加速有机物
的分解。
3、沉降:在沉淀池中加入混凝剂静止,水中的悬浮
无可沉降到池底。
4、过滤:使水通过粗沙、细沙,除去沉淀和残余的
悬浮物。
5、消毒:加入消毒剂杀灭水中有毒微生物曝气池生活向导终端净水
自来水需要经过很长的管道才能进入千家万户,由于种种原因自来水在使用之前便受到污染,这种污染称为二次污染。现在提倡终端净水即:在家中的出水点前加装净化设备,消除二次污染,使饮用水更安全、更可靠。
人类生存离不开阳光、空气和水。当人类步入21世纪之时,人的生命之源——水却向人们发出了警报:世界缺水,中国缺水 水污染是导致缺水的一个重要因素,我国的
水污染已十分严重。三、水污染
1、水污染:由于人类的生活或生产活动改变了天然水的物
理、化学或生物学的性质和组成,影响人类对
水的利用价值或危害人类健康,称为水污染 在洗“牛奶浴”的赞比亚民工水上垃圾随处可见城 市 水 污 染缺水造成土地沙漠化臭美溃烂黑水和泡末愁容调查研究:
1、阅读本节调查研究思考水体富营养化是如何产生的?你认为该污染主要由表中哪些因素导致?
2、DO和BOD的含义是什么?BOD5的含义是什么?为什么BOD5高,河水就会出现恶臭?
3、你了解的处理污水的方法有哪些?该方法主要用于处理怎样的污水?水的第四种形态五十年代淘米洗菜 ; 六十年代洗衣灌溉; 七十年代水质败坏 ; 八十年代鱼虾绝代 ; 九十年代拉稀生癌。水啊水,爱你就是爱自己习题巩固:
1、国际上提出“预防污染”这一新概念,绿色化学是“预防污染”的基本手段,下列各项中属于绿色化学的是 A、处理废弃物 B、治理污染点
C、减少有毒物 D、杜绝污染源
2、新华社报道:我国太湖因蓝藻疯狂繁殖而造成水质的严重污染。
(1)蓝藻的疯狂生长说明湖水中哪些元素超标 ;
(2)蓝藻的疯长会如何破坏生态平衡?
(3)已知洗衣粉的成分为(Na5P3O10),三聚磷酸钠,已知三聚磷酸是三个H3PO4分子脱2分子水形成的,写出H3PO4、三聚磷酸的结构式。
(4)青岛市政府规定从今年禁止磷洗衣粉使用,而把其中的Na5P3O10用Na2SiO3代替,写出其软化硬水时离子方程式。 N、P3、工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法: 以铁作为电极进行电解 鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准,其原理是: ① 将Cr2O72-离子还原为可溶性三价铬离子。 ②电解除铬过程中,使溶液的PH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变成不溶性氢氧化物除去。 根据上述内容回答下列问题: (1)用铁作电极电解时,电极反应式为: 阳极 ,阴极 。 (2)在水溶液中将Cr2O72-离子还原成Cr3+的还原剂是溶液中的 离子,此氧化还原反应的离子方程式是 。 (3)在处理废水中使溶液的PH不断升高,由酸性转变碱性是通过 和 途径来实现的。 (4)将Cr3+转变成不溶性氢氧化物的离子反应式为 ,同时还有 生成Fe - 2e- = Fe2+2H+ + 2e- = H2 ↑Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O (2)反应消耗H+阴极H+放电Fe(OH)35、河道旁有甲乙两工厂,它们排放的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。 (1)甲厂的废水明显呈碱性,故甲厂废水中所含三种离子是 、 、 。 (2)乙厂的废水中含有另外三种离子,如果加一定量 (活性炭、FeSO4、铁粉)可以回收其中的金属 。 (3)另一种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的 转化为沉淀,经过滤后的废水主要含 ,可用来_______。 OH-K+Cl-FeAgCl、Fe(OH)3KNO3施肥2、 污水中的主要污染物四、水污染的检测项目
1、水的理化性质——色度、浊度、PH等
2、无机物——溶解氧(DO)、某些金属离子、氯离
子、硫酸根离子、氮和磷的化合物等
3、有机物——通常测定生化需氧量(BOD)资料卡
水的DO与BOD
DO——水中的溶解氧量(单位:mg/L)
BOD——水中有机物经微生物分解所需的氧气量(单位:mg/L)
污水中有机物的含量越大,BOD越高,水的富营养化程度越高4、在自然净化中要把有机污染物自发地转变为简单的无机物质,需要水中含有一定的氧气,使有机物(C,H,O)+O2→CO2+H2O。1 L水中含有的有机物质转变为无机物所需要的氧的量称为生化需氧量(BOD),用g·L-1为单位表示。如果水中的氧气比BOD少,水就发臭,鱼和其他淡水生物就不能生存。若某地区一条河水中含有机物0.01g/L,此有机物分子式用C6H10O5表示,而在正常大气条件下,氧气在水中的溶解量是0.0092 g·L-1。 (1)写出有机物在有氧条件下转化为无机物的化学方程式。 (2)这条河水的BOD是多少?河水中的鱼类能否维持生命?C6H10O5 + 6O2 → 6CO2 + 5H2O 设每升水中有机物需氧气X,则 ??? C6H10O5 + 6O2 → 6CO2 + 5H2O ??? 162???? 192 ??? 0.01? ??? X ??? 解得X= 0.0119克/升 ??? 河水中的鱼类能否维持生命?不.说明原因:BOD超过水中的含氧量,所以鱼类等到不能生存1、物理处理法——主要是利用物理原理和机械作用对废水进行治理,如过滤、离心、沉淀分离等方法
2、化学处理法——通过施用化学试剂或采用其他化学手段进行废水处理的方法,
如化学混凝法
中和法[轧钢厂中的废水(酸性)]
化学沉淀法(废水中重金属离子的除去)
氧化还原法(油类、氰化物、硫化物)等方法五、污水处理的主要方法常用的氧化剂:空气、臭氧、氯气等如:1、Fe2+的除去:用石灰水、空气将Fe2+转化Fe(OH)3除去
2、Cr3+的除去:用石灰水调节PH至8∽9时, Cr3+形成沉淀除去2Cr3+ + 3Ca(OH)2 = Cr(OH)3 + 3Ca2+3、物理化学处理法 ——通过物理化学过程来除去污染
物的方法,如吸附、电渗析、反渗透、超过滤等方法 4、 生物处理法——利用微生物的作用,除去废水中的
溶胶物质及有机物质的方法,如好氧生物处理、活性
污泥法、生物滤池、厌氧生物处理法 等减少污水的排放量——从源头处理污水的有效手段六、城市污水的再利用
城市污水中工业污水约占70%,其次是生活污水。工业污
水中含有含有某些宝贵的资源,可回收加工利用
水的区别
天然水——取自地面或地下的水;商品中经过包括过滤、臭氧
化或其他消毒处理过程,而不改变其矿化度的瓶装
泉水、矿泉水或井水也称为天然水
自来水——经过自来水厂过滤、消毒等方法处理过的水
中水——城市污水处理后,进行二次利用的一类水
蒸馏水——利用蒸馏设备使水蒸发汽化,然后使水蒸气冷凝而
成的水磁化水——经磁场作用,交叉切割磁力线,分
子结构发生改变,完成磁化过程的水。
矿泉水——流经某些岩石层的深层地下水。
纯净水——经纯化处理后的水。因宇航员最早饮 用的是这种水,故也叫太空水。但是在纯化过程中,不仅除去了水中的细菌、病毒、污染物等杂质,也除去了对人体有益的微量元素和矿物质,如钙、镁等几乎被除净。 使用自来水时应注意:
1、警惕早晨“死水杀手”
2、拒绝饮用反复煮沸的水
3、不喝没有完全煮沸的水来水,水中的有 害病菌必须达到100℃时才能被完全杀死。
4、家用滤水器 自制简易净水装置第二单元 硬水软化专题1 多样化的水处理技术被污染的河水自来水海水矿泉水蒸馏水纯净水 水是生命之源,同学你会喝水吗?同学你有过“水土不服”的体验吗?下列是生活中常见的一些水,它们都是纯净物吗?都能直接饮用吗?一、软水和硬水1.天然水成分:
Ca2+、Mg2+、Na+、Mg2+、HCO3-、CO32-、Cl-、SO42-、NO3-
2.硬水:
溶有较多量的Ca2+和Mg2+的水
3.软水:
只溶有较少量或不含Ca2+和Mg2+的水简单鉴别:肥皂反应
软水中产生泡沫多;
硬水中形成较多白色垢状物。软水与硬水的简单鉴别1、硬度:一般是指水里的钙、镁离子浓度的总和。
水的硬度的表示方法:阅读P9表1-3
2、硬水——8度以上的水
3、暂时硬度
若水的硬度是由碳酸氢钙或碳酸氢镁引起的,这种硬度称为暂时硬度
4、永久硬度
若水的硬度是由含有钙、镁的硫酸盐或氯化物引起的,这种硬度称为永久硬度。
以上两种硬度合称为总硬度。二、暂时硬度和永久硬度联想与启示
烧水的水壶内壁常会形成白色水垢,可以用食醋溶解去除。你知道这些水垢是怎么形成的吗?为什么可用食醋溶解去除?信息提示P10
沉淀的转化——在含有沉淀的溶液中,加入适当的沉
淀剂,使其与溶液中某一离子结合成
更难溶的物质。
如锅炉中的水垢,其中含有硫酸钙较难消除,可用碳酸钠溶液处理,使硫酸钙转化为疏松且可溶于酸的碳酸钙沉淀,这样就比较容易消除。试写出该反应的化学反应方程式。硬水的危害?和肥皂反应时产生不溶性的沉淀,降低洗涤效果。(利用这点也可以区分硬水和软水)
工业上,钙盐镁盐的沉淀会造成锅垢,妨碍热传导,严重时还会导致锅炉爆炸。由于硬水问题,工业上每年因设备、管线的维修和更换要耗资数千万元。
硬水的饮用还会对人体健康与日常生活造成一定的影响。没有经常饮硬水的人偶尔饮硬水,会造成肠胃功能紊乱,即所谓的“水土不服”;
用硬水烹调鱼肉、蔬菜,会因不易煮熟而破坏或降低食物的营养价值;
用硬水泡茶会改变茶的色香味而降低其饮用价值;
用硬水做豆腐不仅会使产量降低、而且影响豆腐
的营养成分。? 资料卡 那么硬水毫无是处了吗?不对,否则怎么会有那么多的人买矿泉水喝呢?。原来钙和镁都是生命必需元素中的宏量金属元素。科学家和医学家们调查发现,人的某些心血管疾病,如高血压和动脉硬化性心脏病的死亡率,与饮水的硬度成反比,水质硬度低,死亡率反而高。其实,长期饮用过硬或者过软的水都不利与人体健康。
我国规定:饮用水的硬度不得超过25度?,人的饮用水硬度最好介于8度—18度之间。 资料卡三、硬水软化1、加热煮沸法(此法只能消除暂时硬度,永久硬度没变化)2、药剂软化法
常用的药剂有石灰、纯碱等
Ca(HCO3)2 CaCO3
Mg(HCO3)2 Mg(OH)2
MgCl2 Mg(OH)2
CaCl2 CaCO3
Ca(OH)2 CaCO3 加入石灰,可使水中的二氧化碳、碳酸氢钙和碳酸氢镁生成碳酸钙和氢氧化镁的沉淀,对永久硬度大的硬水,可再加适量纯碱。软化时石灰添加量,根据经验,每降低一千升水中暂时硬度一度,需加纯氧化钙10克。
反应过程中,镁都是以氢氧化镁的形式沉淀,而钙都是以碳酸钙的形式沉淀。? 3、离子交换法
(1)磺化煤法
2NaR + Ca2+ = CaR2 + 2Na+
2NaR + Mg2+ = MgR2 + 2Na+
注:1、能消除暂时硬度、永久硬度
2、磺化煤可以再生利用工业上常用阴、阳离子交换树脂来软化硬水
饮料用水大都采用有机合成离子交换树脂作离子交换剂。 A、离子交换树脂的定义、组成?、类型
B、基本原理:
用离子交换树脂软化硬水时,先把水通过阳柱(装有阳离子交换树脂的离子交换柱),使水中的金属离子被阳离子交换树脂吸附,阳离子交换树脂中的氢离子被交换到水中去;然后再通过阴柱,使水中的阴离子被阴离子树脂吸附,阴离子树脂将氢氧根离子交换到水中,和氢离子化合成水,使水得到净化。
C、离子交换树脂软化硬水的方法比药剂软化法质量高、设备简单、占用面积小、操作方便? 3、离子交换法
(2)离子交换树脂?练习:
1、怎样证明天然水具有暂时硬度和永久硬度,或是软水,简述实验步骤,并写出有关化学方程式 .
2、现有纯碱、石灰、明矾和磺化煤,可用作净水的是 ,可用作软化只含CaSO4 CaCl2的硬水的是 ,可用于软化暂时硬水的是 .3、我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量。通常把1升水中含有10毫克CaO称为1度。水中的Ca2+、Mg2+可用一定浓度的Y溶液进行滴定,Y跟Ca2+、Mg2+都以等物质的量完全反应. (1) 现取某地区的地下水样品25.0毫升,用0.01摩尔/升Y溶液滴定,完全反应时消耗Y溶液15.0毫升.试计算该地下水的硬度,并判断是否符合饮用标准. (2) 如果每次分析时取的水样都是25.0毫升,为了便于计算,要求每消耗0.50毫升Y溶液即相当于水的硬度为1度.则Y溶液的物质的量浓度应为多少?(1)25.0毫升水中含Ca2+和Mg2+的总物质的量为 0.0100×0.0150=1.50×10-4 mol 折合成CaO的质量为1.50×10-4×56=8.40×10-3 g 水的硬度为8.40×10-3×(1000/25.0)×(1000/10)=33.6(度) 因硬度超过25度,故不符合饮用水标准. 或列成总式: 0.0100×0.0150×56×(1000/25.0)×(1000/10)=33.6(度) 因硬度超过25度,故不符合饮用水标准.
(2)[解法一] 25.0毫升水(硬度为1度)中含CaO的物质的量为 (0.010/56)×(2.5/1000)=4.46×10-3 mol Y溶液的浓度为4.46×10-3/0.50=8.92×10-3 mol/L [解法二][利用(1)的结果计算] 设Y溶液的浓度为C,则(0.0100×15.0):33.6=(C×0.50):1 C=8.92×10-3 mol/L正常人每天需要2500mL的水,不是饮水越多越好。
经常喝未烧开的自来水,可加大膀胱癌和直肠癌的发病率。
经常喝硬水者可增加结石的患病率。
运动员喝保健饮料,稍加点盐和糖料。
高血压病人,一般应少盐少水。
老年人和小孩最好是饮用温开水
在吃饭时适当补充水,即多增加些汤羹食品是有利于消化的。浅谈健康饮水生活向导
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
