海水淡化技术
图片预览






文档简介
课件25张PPT。第三单元 海水淡化专题1 多样化的水处理技术 地球是个蓝色的星球,表面积约3/4被海水所覆盖。海水占地球总水量的97%以上,可是它含盐量高,20度时的密度达到1.0243g/cm-3,不适合人类饮用,也不适合作为工农业生产用水。?
从20世纪50年代以来,随着工农业的发展和城市人口的增长,淡水供应逐渐紧张,造成有些城市或地区严重缺水。但海水是一种不可忽略的潜在水源,因此海水淡化的技术,成为开发新水源的重要途径之一。资 料 早在15世纪,航海部门就曾以简易的蒸馏装置来解决海船在长期航行中的淡水供应问题。第二次世界大战期间,出于战争的需要,用蒸馏法淡化海水的技术有较大的发展,已用于供应战舰和岛屿的淡水。 据1980年统计,全世界淡化装置的每天总造水量为 727.5万立方米,其中75.9% 是蒸馏法生产的,其余大部分用膜法 (电渗析法和反渗透法)。?海水淡化方法1、原理:利用液体沸点不同加热液体,使不同
组分在不同温度沸腾汽化,再将蒸汽
冷凝收集在容器中。
2、减压蒸馏的原理:利用压强降低,液体的沸
点也降低
3、蒸馏法优点:设备相对简单、技术比较成熟
淡水质量好
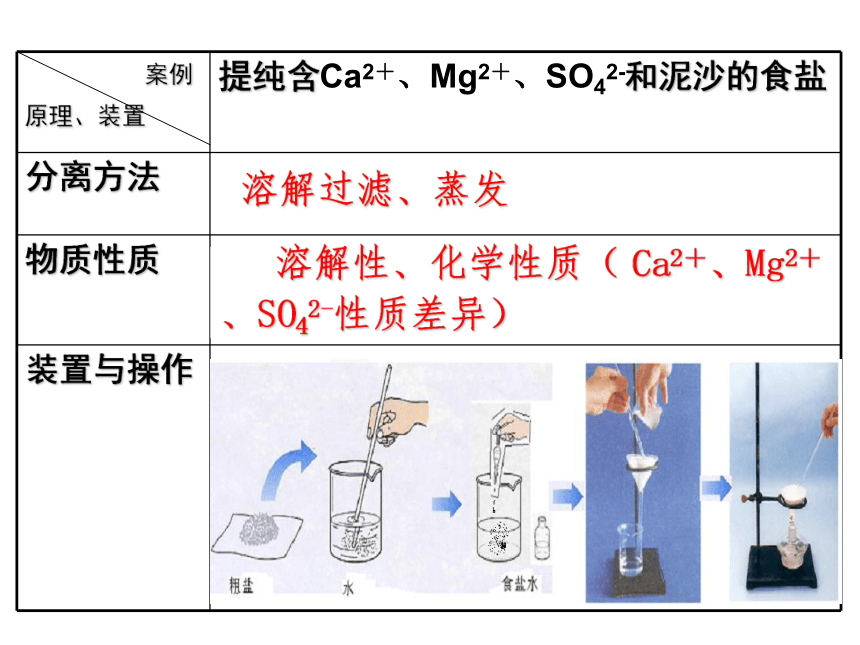
缺点:能耗大一、蒸馏法如何从海水中提取食盐,请简要说明?思考: 现有含Ca2+、Mg2+、SO42-和泥沙等杂质的粗食盐,请设计实验方案,由粗食盐提纯氯化钠。 溶解性、化学性质( Ca2+、Mg2+
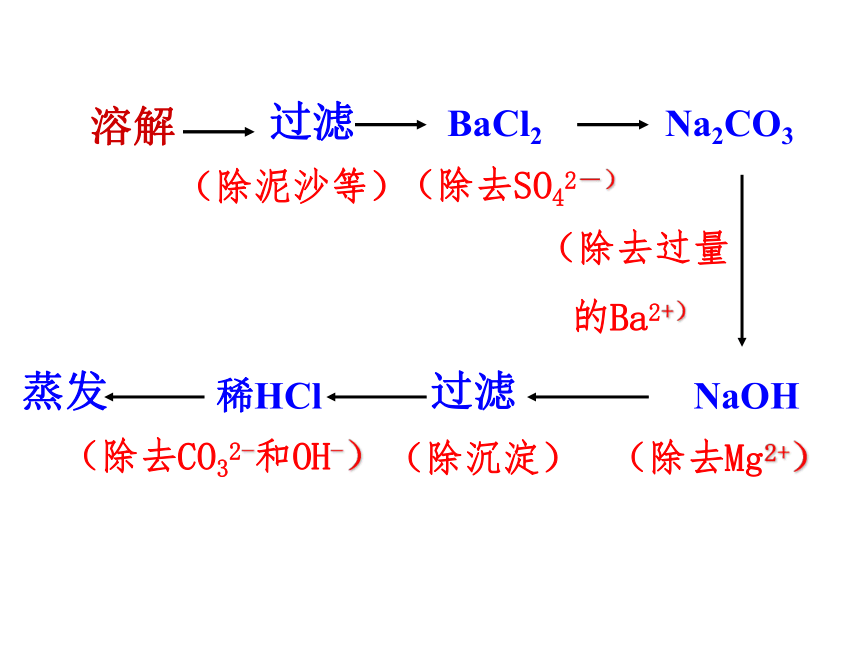
、SO42-性质差异)溶解过滤、蒸发溶解过滤(除泥沙等)Na2CO3NaOH(除去过量
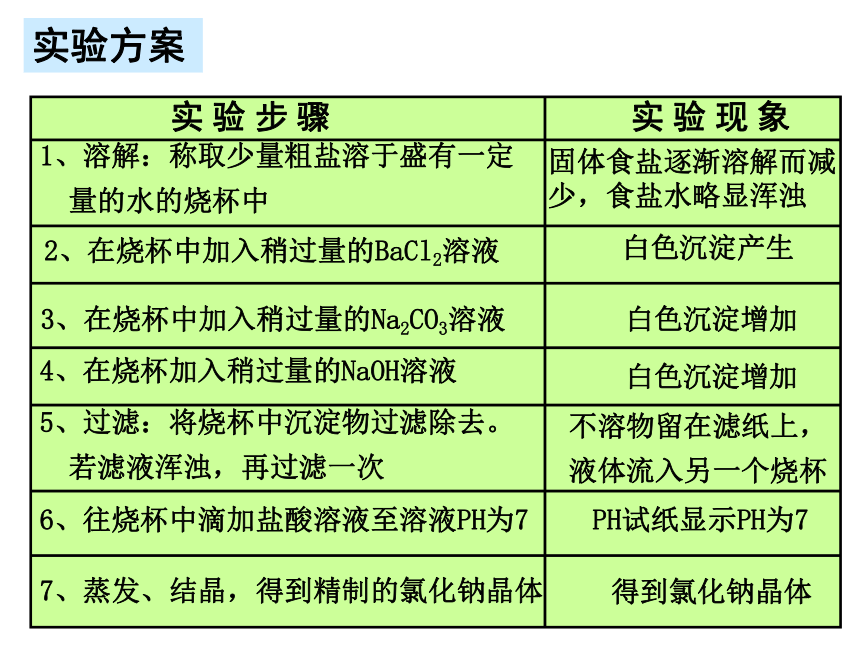
的Ba2+)(除去SO42-)(除去Mg2+)BaCl2过滤(除沉淀)稀HCl(除去CO32-和OH-)蒸发实验方案1、溶解:称取少量粗盐溶于盛有一定
量的水的烧杯中固体食盐逐渐溶解而减少,食盐水略显浑浊2、在烧杯中加入稍过量的BaCl2溶液白色沉淀产生3、在烧杯中加入稍过量的Na2CO3溶液白色沉淀增加4、在烧杯加入稍过量的NaOH溶液白色沉淀增加6、往烧杯中滴加盐酸溶液至溶液PH为75、过滤:将烧杯中沉淀物过滤除去。
若滤液浑浊,再过滤一次不溶物留在滤纸上,
液体流入另一个烧杯PH试纸显示PH为77、蒸发、结晶,得到精制的氯化钠晶体得到氯化钠晶体还可设计为:BaCl2 → NaOH → Na2CO3 → HCl
NaOH → BaCl2 → Na2CO3 → HCl 关键是Na2CO3在BaCl2之后,而稀HCl
必须在最后加。问题、工业上多以硝酸钠和氯化钾为主要原料生产硝酸钾,副产品为氯化钠。反应方程为
NaNO3 + KCl ==NaCl + KNO3
如何分离硝酸钾和氯化钠的混合物?
提纯KNO3(混有NaCl、NH4Cl)的方法提纯NaCl(混有KNO3)的方法根据溶解性曲线图,讨论1、原理:在外加直流电场的作用下,处于中间位置海水槽里的阴离子、阳离子分别透过阴离子交换膜、阳离子交换膜迁移到阳极区、阴极区,中间水槽里的水含盐量就降低了。
2、特点:消耗的电能大,但其成本只有蒸馏法的1/4。
3、离子交换膜:用离子交换树脂制成的薄膜,也称电渗析膜。有阴、阳离子交换膜之分,阴离子只能通过阴离子交换膜,阳离子只能通过阳离子交换膜。?海水淡化方法二、电渗析法电渗析器水质标准 如何从海水中提取氯化镁,请简要说明,用方程式表示氯化镁和得到过程思考:海水的综合利用可以制备金属镁,其流和如下图所示: 若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式
用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl2?6H2O时,能得到无水MgCl2,其原因是Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。 ?海水淡化方法三、反渗透法1、渗透压:浓度较小的溶液中的水分会通过半透膜渗透到浓度较大的溶液中,使原来浓度较大的一侧溶液液面升高,当液面升高产生的压力达到一定数值时能阻止水的继续渗透,这个压力称为渗透压。
?海水淡化方法三、反渗透法1、渗透压:浓度较小的溶液中的水分会通过半透膜渗透到浓度较大的溶液中,使原来浓度较大的一侧溶液液面升高,当液面升高产生的压力达到一定数值时能阻止水的继续渗透,这个压力称为渗透压。
2、反渗透法的原理:如果在含盐浓度较大的溶液一侧施加一定的压力,可以迫使水从浓溶液一侧向稀溶液一侧渗透,使浓溶液浓度增大,得到淡水。
3、特点:节能,可以大量、快速地生产淡水。?海水淡化方法四、冷冻法1、原理:把冷海水喷入真空室,部分海水蒸发吸热
使其余海水冷却形成冰晶。固体冰晶中的
杂质要比原溶液中少得多。将得到的冰晶
用适量的淡水淋洗、熔化,就得到淡水。
2、特点:由于水的比热、汽化热大,这种海水淡化
技术要消耗大量的能量。练习:从海水中提取物质的方法 海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集的问题。例如: (1)从海水中提取溴的主要工艺流程 ①用 法将海水浓缩。用硫酸将浓缩的海水酸化。 ②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质: ③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的,方程式为: ; ④向吸收塔内的溶液中通入适量的氯气反应的方程式为 ; ⑤用 萃取吸收塔内的溶液中的溴单质。 (2)进行从海带中提取碘实验的反应原理及应注意的问题 ①反应原理:海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。如用H2O2做氧化剂,反应的离子方程式是为:蒸馏四氯化碳(或苯) 2I- + H2O2 + 2H+ = I2 + 2H2O 实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的: 溶解时: 过滤时: 蒸发时: 搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,
防止外洒 搅拌,防止因局部过热液滴或晶体飞溅。
从20世纪50年代以来,随着工农业的发展和城市人口的增长,淡水供应逐渐紧张,造成有些城市或地区严重缺水。但海水是一种不可忽略的潜在水源,因此海水淡化的技术,成为开发新水源的重要途径之一。资 料 早在15世纪,航海部门就曾以简易的蒸馏装置来解决海船在长期航行中的淡水供应问题。第二次世界大战期间,出于战争的需要,用蒸馏法淡化海水的技术有较大的发展,已用于供应战舰和岛屿的淡水。 据1980年统计,全世界淡化装置的每天总造水量为 727.5万立方米,其中75.9% 是蒸馏法生产的,其余大部分用膜法 (电渗析法和反渗透法)。?海水淡化方法1、原理:利用液体沸点不同加热液体,使不同
组分在不同温度沸腾汽化,再将蒸汽
冷凝收集在容器中。
2、减压蒸馏的原理:利用压强降低,液体的沸
点也降低
3、蒸馏法优点:设备相对简单、技术比较成熟
淡水质量好
缺点:能耗大一、蒸馏法如何从海水中提取食盐,请简要说明?思考: 现有含Ca2+、Mg2+、SO42-和泥沙等杂质的粗食盐,请设计实验方案,由粗食盐提纯氯化钠。 溶解性、化学性质( Ca2+、Mg2+
、SO42-性质差异)溶解过滤、蒸发溶解过滤(除泥沙等)Na2CO3NaOH(除去过量
的Ba2+)(除去SO42-)(除去Mg2+)BaCl2过滤(除沉淀)稀HCl(除去CO32-和OH-)蒸发实验方案1、溶解:称取少量粗盐溶于盛有一定
量的水的烧杯中固体食盐逐渐溶解而减少,食盐水略显浑浊2、在烧杯中加入稍过量的BaCl2溶液白色沉淀产生3、在烧杯中加入稍过量的Na2CO3溶液白色沉淀增加4、在烧杯加入稍过量的NaOH溶液白色沉淀增加6、往烧杯中滴加盐酸溶液至溶液PH为75、过滤:将烧杯中沉淀物过滤除去。
若滤液浑浊,再过滤一次不溶物留在滤纸上,
液体流入另一个烧杯PH试纸显示PH为77、蒸发、结晶,得到精制的氯化钠晶体得到氯化钠晶体还可设计为:BaCl2 → NaOH → Na2CO3 → HCl
NaOH → BaCl2 → Na2CO3 → HCl 关键是Na2CO3在BaCl2之后,而稀HCl
必须在最后加。问题、工业上多以硝酸钠和氯化钾为主要原料生产硝酸钾,副产品为氯化钠。反应方程为
NaNO3 + KCl ==NaCl + KNO3
如何分离硝酸钾和氯化钠的混合物?
提纯KNO3(混有NaCl、NH4Cl)的方法提纯NaCl(混有KNO3)的方法根据溶解性曲线图,讨论1、原理:在外加直流电场的作用下,处于中间位置海水槽里的阴离子、阳离子分别透过阴离子交换膜、阳离子交换膜迁移到阳极区、阴极区,中间水槽里的水含盐量就降低了。
2、特点:消耗的电能大,但其成本只有蒸馏法的1/4。
3、离子交换膜:用离子交换树脂制成的薄膜,也称电渗析膜。有阴、阳离子交换膜之分,阴离子只能通过阴离子交换膜,阳离子只能通过阳离子交换膜。?海水淡化方法二、电渗析法电渗析器水质标准 如何从海水中提取氯化镁,请简要说明,用方程式表示氯化镁和得到过程思考:海水的综合利用可以制备金属镁,其流和如下图所示: 若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式
用电解法制取金属镁时,需要无水氧化镁。在干燥的HCl气流中加热MgCl2?6H2O时,能得到无水MgCl2,其原因是Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。 ?海水淡化方法三、反渗透法1、渗透压:浓度较小的溶液中的水分会通过半透膜渗透到浓度较大的溶液中,使原来浓度较大的一侧溶液液面升高,当液面升高产生的压力达到一定数值时能阻止水的继续渗透,这个压力称为渗透压。
?海水淡化方法三、反渗透法1、渗透压:浓度较小的溶液中的水分会通过半透膜渗透到浓度较大的溶液中,使原来浓度较大的一侧溶液液面升高,当液面升高产生的压力达到一定数值时能阻止水的继续渗透,这个压力称为渗透压。
2、反渗透法的原理:如果在含盐浓度较大的溶液一侧施加一定的压力,可以迫使水从浓溶液一侧向稀溶液一侧渗透,使浓溶液浓度增大,得到淡水。
3、特点:节能,可以大量、快速地生产淡水。?海水淡化方法四、冷冻法1、原理:把冷海水喷入真空室,部分海水蒸发吸热
使其余海水冷却形成冰晶。固体冰晶中的
杂质要比原溶液中少得多。将得到的冰晶
用适量的淡水淋洗、熔化,就得到淡水。
2、特点:由于水的比热、汽化热大,这种海水淡化
技术要消耗大量的能量。练习:从海水中提取物质的方法 海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集的问题。例如: (1)从海水中提取溴的主要工艺流程 ①用 法将海水浓缩。用硫酸将浓缩的海水酸化。 ②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质: ③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的,方程式为: ; ④向吸收塔内的溶液中通入适量的氯气反应的方程式为 ; ⑤用 萃取吸收塔内的溶液中的溴单质。 (2)进行从海带中提取碘实验的反应原理及应注意的问题 ①反应原理:海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。如用H2O2做氧化剂,反应的离子方程式是为:蒸馏四氯化碳(或苯) 2I- + H2O2 + 2H+ = I2 + 2H2O 实验室时将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的: 溶解时: 过滤时: 蒸发时: 搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,
防止外洒 搅拌,防止因局部过热液滴或晶体飞溅。
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
