从铝土矿到铝合金复习课件
图片预览






文档简介
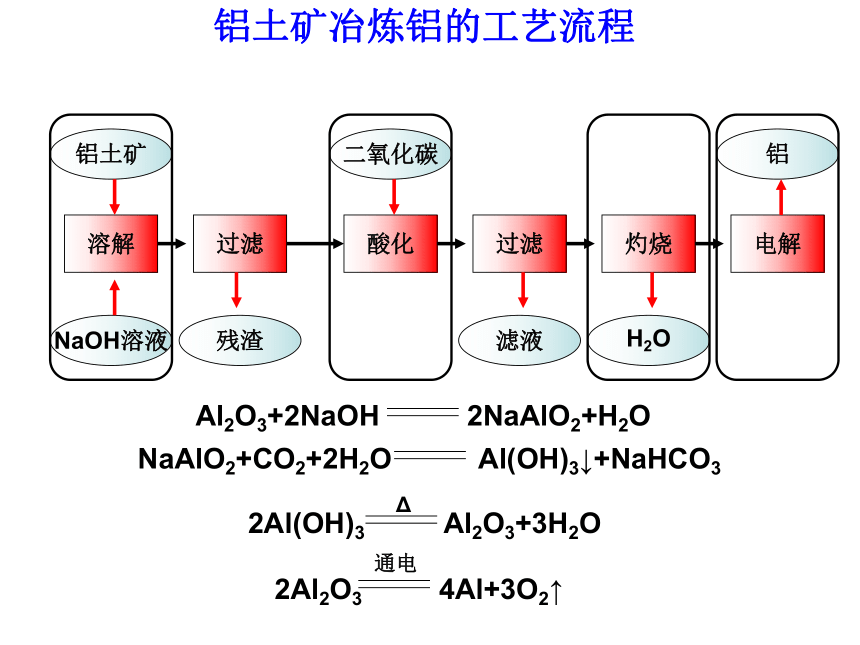
课件21张PPT。考点一、铝的存在和制备1、铝在自然界中全部以 存在,在地壳中的含量仅次于 ,是金属中含量最高的。铝土矿是铝在自然界中的主要存在形式之一,其主要成分是 ,杂质有 和 。化合态形式氧、硅Al2O3SiO2Fe2O3 1-3-1 从铝土矿到铝合金请同学们以铝土矿为原料设计实验制备金属铝铝土矿冶炼铝的工艺流程溶解电解灼烧过滤酸化过滤铝土矿NaOH溶液残渣二氧化碳滤液H2O铝考点二、铝的性质和用途银白色固体,硬度小,熔点低,密度小,导电、导热性、延展性能好做合金、导线、炊具、包装S、Cl2、O2(与铁比较)储存和运输浓硫酸和浓硝酸铝热反应、冶炼金属,焊接铁轨2Al+2H2O+2OH-=2AlO2-+3H2↑2Al+6H+=2Al3++3H2?铝比铁活泼,但铝不像铁那样容易被空气腐蚀?与硫酸铜溶液反应思考1、有同学认为金属Al既能与盐酸又能与氢氧化钠反应,所以具有两性,你认为对吗?试从铝与强碱溶液反应的实质加以解释。该反应还原剂、氧化剂分别是何物质?铝和强碱溶液反应实质:
2Al+6H2O=== 2Al(OH)3 +3H2↑
2Al(OH)3 + 2NaOH===2NaAlO2 +4H2O
2Al+6H2O+2NaOH===2NaAlO2+3H2↑+4H2O
此反应中,还原剂是 ,氧化剂是 。 铝水 说明铝具有金属性考点三、铝的重要化合物1、氧化物和氢氧化物稳定(1)与酸反应
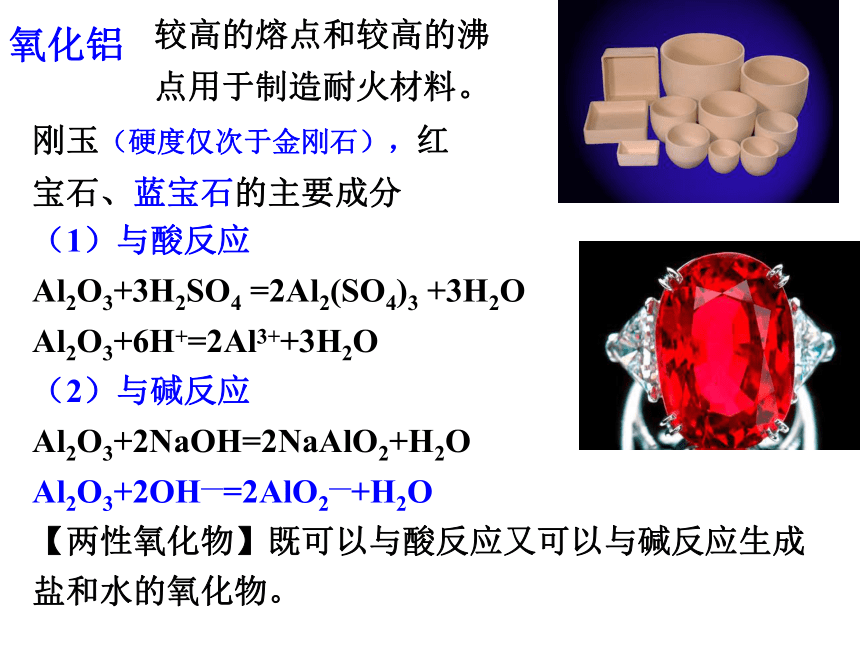
Al2O3+3H2SO4 =2Al2(SO4)3 +3H2O Al2O3+6H+=2Al3++3H2O
(2)与碱反应
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2OH—=2AlO2—+H2O
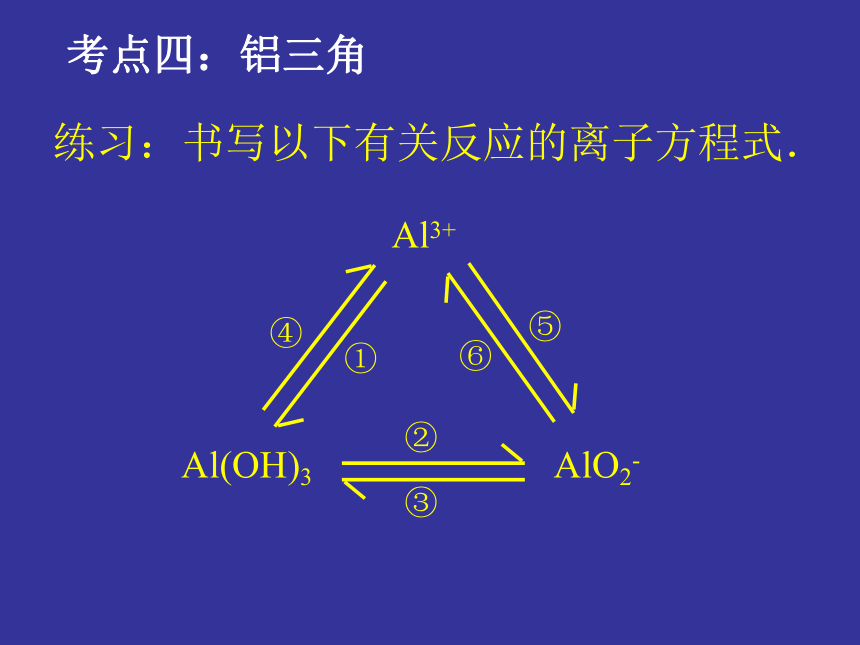
【两性氧化物】既可以与酸反应又可以与碱反应生成盐和水的氧化物。氧化铝较高的熔点和较高的沸点用于制造耐火材料。刚玉(硬度仅次于金刚石),红宝石、蓝宝石的主要成分练习:书写以下有关反应的离子方程式.Al3+Al(OH)3AlO2-①②③④⑤⑥考点四:铝三角思考 2、现在请你用:4molAl、和足量的HCl、NaOH为原料用多种方法制备4mol氢氧化铝,并进行评价Al3++3AlO2-+6H2O==4Al(OH)3↓重要的铝盐明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O];无色晶体,易溶于水KAl(SO4)2==K++Al3++2SO42-明矾在水中的电离方程式复盐:电离时能产生两种金属阳离子和一种阴离子的盐。铝离子的水解:Al3++3H2O Al(OH)3(胶体)+3H+用途:做净水剂明矾的净水作用 Al(OH)3胶体具有很强的吸附能力,它能凝结水中的悬浮物并使之沉降,从而达到净水的目的。目前用于饮用水净化的含铝净水剂正逐步被含铁净水剂所取代。煮好的菜能否放铝锅中过夜? 世界卫生组织提出人体每天的摄铝量不应超过每千克体重1毫克,一般情况下,一个人每天摄取的铝量绝不会超过这个量,但是,经常喝铝盐净化过的水,吃含铝盐的食物,如油条、粉丝、凉粉、油饼、易位罐装的软饮料等,或是经常食用铝制炊具炒出的饭莱,都会使人的摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝。2、某无色溶液与铝作用生成氢气,则溶液中肯定不能大量共存的离子组合为 ( ) A.I-、Mg2+、 NO3- 、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42-、Cl-、CO32-、Na+ D.HCO-、K+、NO3-、 SO42-AD1、下列叙述正确的是 ( ) A.铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应。 B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多。 C.合金的熔点一般比组成它的各成分的熔点都低。 D.工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰。CD1.向AlCl3溶液中逐滴加入NaOH溶液至过量2.向NaOH溶液中逐滴加入AlCl3 溶液至过量3.向NaAlO2溶液中逐滴滴入盐酸至过量Al(OH)3+3H+=Al3++3H2O4.向HCl溶液中逐滴加入NaAlO2溶液至过量5.向AlCl3溶液中逐滴加入氨水溶液至过量6.向NaAlO2溶液中通入CO2至过量AlO2 - + CO2 + 2H2O = Al(OH)3 +H CO3-CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32- 7.向含有物质的量相等的MgCl2 、AlCl3、HCl混合溶液中逐 滴加入NaOH至过量6、把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
A.70% B.52.4% C.47.6% D.30%5、若某氖原子的质量是ag,12C的原子质量是bg,NA表示阿伏加德罗常数。下列说法正确的是
A、氖元素的相对原子质量一定是12a/b
B、该氖原子摩尔质量是aNAg
C、Wg该氖原子的物质的量一定是W/(aNA)mol
D、Wg该氖原子所含质子数是10W/a
6、一个12C原子的质量为bg,A原子的质量为ag,阿伏加德罗常数为NA,则A原子的对相原子质量为
A、12a/b B、aNA C、12b/a D、12NAC、DA、B7、一定量的MgCO3和Cu粉的混合物在空气中高温加热后,固体混合物的总质量仍然不变,则原混合物中MgCO3与Cu粉的物质的量之比为
A、21∶44 B、8∶11
C、4∶11 D21∶22
8、A、B两种化合物均由X、Y元素组成,已知A中Y元素的质量分数是0.44,B中Y元素的质量分数为0.345,A的化学式为YX2,则B的化学式为
A、YX B、Y2X2 C、YX3 D、YX4CC
2Al+6H2O=== 2Al(OH)3 +3H2↑
2Al(OH)3 + 2NaOH===2NaAlO2 +4H2O
2Al+6H2O+2NaOH===2NaAlO2+3H2↑+4H2O
此反应中,还原剂是 ,氧化剂是 。 铝水 说明铝具有金属性考点三、铝的重要化合物1、氧化物和氢氧化物稳定(1)与酸反应
Al2O3+3H2SO4 =2Al2(SO4)3 +3H2O Al2O3+6H+=2Al3++3H2O
(2)与碱反应
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2OH—=2AlO2—+H2O
【两性氧化物】既可以与酸反应又可以与碱反应生成盐和水的氧化物。氧化铝较高的熔点和较高的沸点用于制造耐火材料。刚玉(硬度仅次于金刚石),红宝石、蓝宝石的主要成分练习:书写以下有关反应的离子方程式.Al3+Al(OH)3AlO2-①②③④⑤⑥考点四:铝三角思考 2、现在请你用:4molAl、和足量的HCl、NaOH为原料用多种方法制备4mol氢氧化铝,并进行评价Al3++3AlO2-+6H2O==4Al(OH)3↓重要的铝盐明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O];无色晶体,易溶于水KAl(SO4)2==K++Al3++2SO42-明矾在水中的电离方程式复盐:电离时能产生两种金属阳离子和一种阴离子的盐。铝离子的水解:Al3++3H2O Al(OH)3(胶体)+3H+用途:做净水剂明矾的净水作用 Al(OH)3胶体具有很强的吸附能力,它能凝结水中的悬浮物并使之沉降,从而达到净水的目的。目前用于饮用水净化的含铝净水剂正逐步被含铁净水剂所取代。煮好的菜能否放铝锅中过夜? 世界卫生组织提出人体每天的摄铝量不应超过每千克体重1毫克,一般情况下,一个人每天摄取的铝量绝不会超过这个量,但是,经常喝铝盐净化过的水,吃含铝盐的食物,如油条、粉丝、凉粉、油饼、易位罐装的软饮料等,或是经常食用铝制炊具炒出的饭莱,都会使人的摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝。2、某无色溶液与铝作用生成氢气,则溶液中肯定不能大量共存的离子组合为 ( ) A.I-、Mg2+、 NO3- 、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42-、Cl-、CO32-、Na+ D.HCO-、K+、NO3-、 SO42-AD1、下列叙述正确的是 ( ) A.铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应。 B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多。 C.合金的熔点一般比组成它的各成分的熔点都低。 D.工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰。CD1.向AlCl3溶液中逐滴加入NaOH溶液至过量2.向NaOH溶液中逐滴加入AlCl3 溶液至过量3.向NaAlO2溶液中逐滴滴入盐酸至过量Al(OH)3+3H+=Al3++3H2O4.向HCl溶液中逐滴加入NaAlO2溶液至过量5.向AlCl3溶液中逐滴加入氨水溶液至过量6.向NaAlO2溶液中通入CO2至过量AlO2 - + CO2 + 2H2O = Al(OH)3 +H CO3-CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32- 7.向含有物质的量相等的MgCl2 、AlCl3、HCl混合溶液中逐 滴加入NaOH至过量6、把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
A.70% B.52.4% C.47.6% D.30%5、若某氖原子的质量是ag,12C的原子质量是bg,NA表示阿伏加德罗常数。下列说法正确的是
A、氖元素的相对原子质量一定是12a/b
B、该氖原子摩尔质量是aNAg
C、Wg该氖原子的物质的量一定是W/(aNA)mol
D、Wg该氖原子所含质子数是10W/a
6、一个12C原子的质量为bg,A原子的质量为ag,阿伏加德罗常数为NA,则A原子的对相原子质量为
A、12a/b B、aNA C、12b/a D、12NAC、DA、B7、一定量的MgCO3和Cu粉的混合物在空气中高温加热后,固体混合物的总质量仍然不变,则原混合物中MgCO3与Cu粉的物质的量之比为
A、21∶44 B、8∶11
C、4∶11 D21∶22
8、A、B两种化合物均由X、Y元素组成,已知A中Y元素的质量分数是0.44,B中Y元素的质量分数为0.345,A的化学式为YX2,则B的化学式为
A、YX B、Y2X2 C、YX3 D、YX4CC
