生产生活中的含氮化合物
图片预览









文档简介
课件31张PPT。氮是生命的基础,人体内输送氧气的血红素和植物体内催化光合作用的叶绿素中都含有氮,氮元素在生命活动中扮演着十分重要的角色。氮是构成蛋白质和核酸不可缺少的元素,是农作物生长所必需的元素。充足的氮肥使植物枝叶茂盛、叶片增大,光合作用增强,从而提高农作物的产量和质量。
1919年,德国化学家哈伯首次用氮气和氢气合成了氨,奠定了大规模工业合成化肥的基础。化学对人类文明的伟大贡献之一便和氮气紧紧地连在了一起。1-4-2生产生活中的含氮化合物氮在自然界中的存在形式 大 气土壤水源生 物游离态的氮分子铵盐、硝酸盐(无机氮)氨基酸、蛋白质(有机氮) 氮元素在自然界中既有游离态、又有化合态。它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。电子式: 原子结构
(1)表示方法: 原子结构示意图:
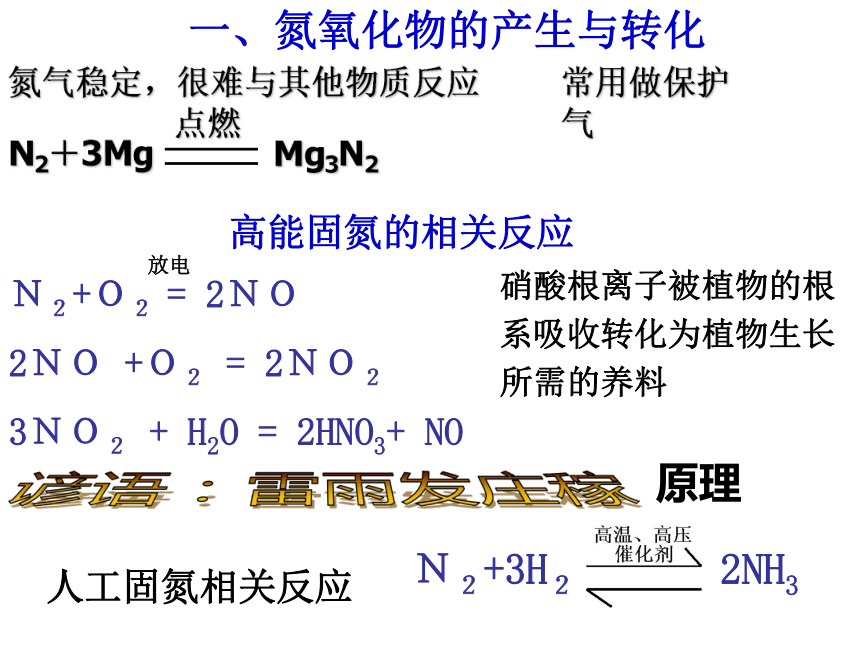
(2)元素周期表中位:(第二周期,ⅤA族)氮的固定和循环人工固氮自然固氮高能固氮生物固氮氮的固定(1)(2)概念:氮由游离态转化为化合态的过程。简称固氮。 高温、高压、催化剂下使氮气与氢气反应生成氨。 在闪电等高能量作用下,N2在空气中发生反应。 有固氮能力的生物将游离态氮固定为氮的化合物。 N2+O2 = 2NO
2NO +O2 = 2NO2
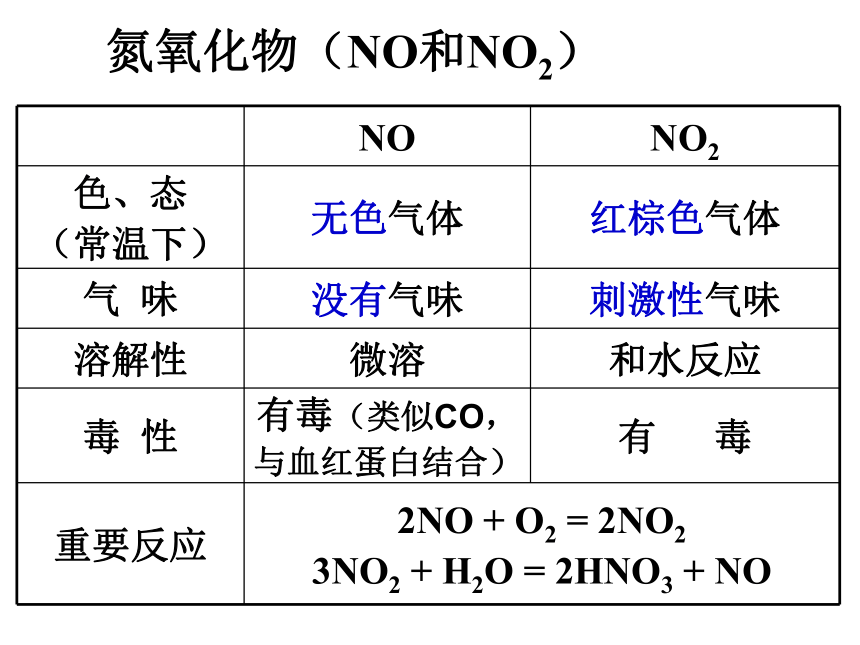
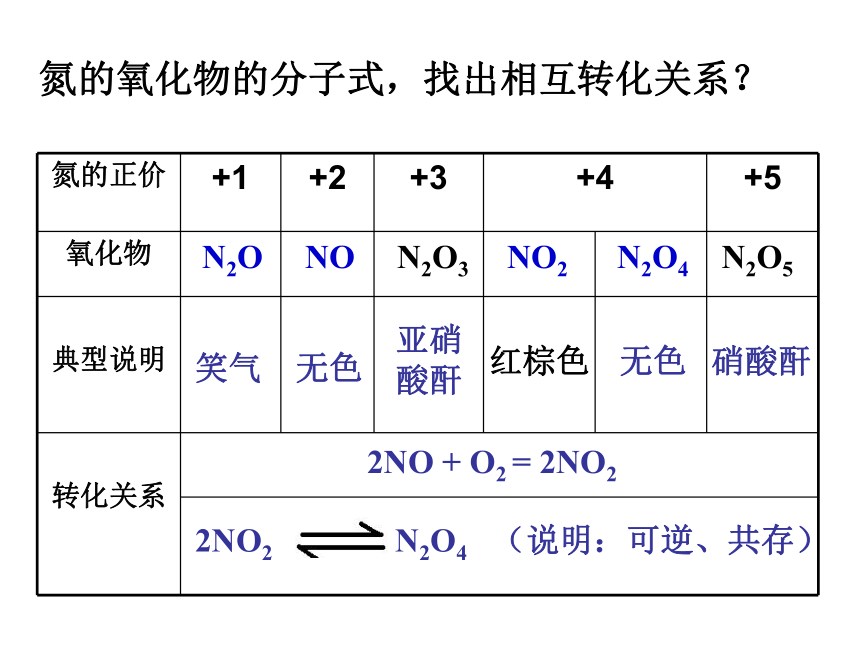
3NO2 + H2O = 2HNO3+ NO人工固氮相关反应N2+3H2 2NH3高能固氮的相关反应 放电一、氮氧化物的产生与转化谚语:雷雨发庄稼原理硝酸根离子被植物的根系吸收转化为植物生长所需的养料氮气稳定,很难与其他物质反应常用做保护气氮氧化物(NO和NO2)氮的氧化物的分子式,找出相互转化关系?N2O NO N2O3 NO2 N2O4 N2O52NO + O2 = 2NO22NO2 N2O4 (说明:可逆、共存)注意:NO的“功”与“过”
“过”:NO有毒,能与人体的血红蛋白结合而使血液失去载氧能力
“功”:极少量的NO会促进血管扩张,防止血栓塞
NO2能自身化合:2NO2 N2O4
NO2具有氧化性,可使淀粉KI试纸变蓝。 实验室收集NO只能用排水集气法,不能用排空气法;而收集NO2只能用向上排空气法,不能用排水法.氮氧化物对环境的污染⑴ 硝酸型酸雨的形成:
虽然硝酸根离子被植物的根系吸收转化为植物生长所需的养料,但雨水中的硝酸也是形成酸雨的主要物质,会对环境造成很大的污染⑵ 光化学烟雾的形成
①汽车尾气排放的NO被氧化为NO2
2NO+O2 = 2NO2
②在日光照射下,NO2和O2经过复杂的反应生成臭氧 NO2 = NO+O O+O2 = O3 2NO+O2 = 2NO2 (氮氧化物是氧气转化为臭氧的催化剂)
③臭氧与空气中的一些碳氢化合物作用,产生一种有毒的烟雾,人们称它为光化学烟雾⑶氮氧化物对臭氧层的破坏
臭氧层主要分布在距地面20-25km的大气层中,臭氧能吸收紫外线,防止地球上的生物受到伤害。而飞机尾气中的氮氧化物(NO和NO2)对臭氧层(含O3和O)会造成破坏,可简单表示为:O3+NO = O2+NO2 O+NO2 = NO+O2
注:氮氧化物是臭氧转化为氧气的催化剂(4)预防和控制氮氧化物对空气污染的办法和措施 A 、使用洁净能源,减少氮氧化物的排放; B 、为汽车安装尾气转化装置; C、 处理工厂废气 (通常用碱液吸收) 其它氮的污染。
A、使水体富营养化。(水华、赤潮)
进一步污水处理,控制和利用多余的氮。
B、精确施肥,提高氮肥利用率。加强人畜禽粪便的回收与管理,提高有机肥的利用率。友情提示:NO、NO2有毒,是大气污染物,可用碱液吸收:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
由上可知:当n(NO2)≥n(NO)时,尾气才能被吸收完全,否则不能被完全吸收1.相同条件下,分别测定下列各气体的相对分子质量,测得值与该气体相对分子质量有差异的是 ( )
A. NO2 B. O2 C. N2 D. CO
2.鉴别NO2和溴蒸气,可选用的试剂是 ( )
A.淀粉碘化钾溶液 B.蒸馏水
C.NaOH溶液 D.AgNO3溶液ABD解题规律与技巧:
NOX与O2、H2O反应的计算技巧2NO+O2 = 2NO2①3NO2+H2O = 2HNO3+NO②①×3+②×2①+②×24NO+3O2+2H2O = 4HNO3 4NO2+O2+2H2O = 4HNO3 复合方程式:2、由NO2和O2的混合气40mL,通过足量的水吸收后剩下5mL气体,则原混合气体中NO2和O2的体积比为( )
A. 1∶3 B. 1∶1 C. 7∶1 D. 7∶3析:题中没有明确剩余5mL是何种气体,故有两种可能: (1)当剩余5mL O2时肯定无NO2,设NO2体积为x,由4NO2+O2+2H2O=4HNO3可得x+x/4+5=40,x=28,即NO2 :28mL, O2: 12mL, V(NO2)∶V(O2)=7∶3.
(2)当剩余5ml为NO时,肯定无O2,设O2为y,由
4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,可得4y+y+15=40,y=5 即 NO2:35ml, O2 :5mL, V(NO2)∶V(O2) = 7∶1,CD氮肥的种类:氨态化肥都来源于NH3硝态化肥:硝酸盐尿素(CO(NH2)2)二、氮肥的生产和使用俗称碳铵1、氨的物理性质(1) 色,有 气味的气体。无刺激性(2)密度比空气 小(3)易液化, 可用作 剂。致冷(4)极易溶于水。常温下,1体积水约能溶解 体积的氨。氨水的密度比水 ,且氨水浓度越大,其密度越 。700小小氨在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大氨气的喷泉实验实验成败的关键是什么?a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+④氨水保存:①分析氨水的成份:③氨水的密度:②氨水的溶质:湿润的红色石蕊试纸氨水是混合物能导电,而液氨是纯净物不导电。 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3氨水具有挥发性,与挥发性酸发生反应,产生白烟 (3)氨跟氧气反应----催化氧化(接触氧化) (4) 氨与其它非金属反应8NH3+3Cl2 == N2+6NH4Cl (氨充足)2NH3+3Cl2 == N2+6HCl (氨不足)俗称硫铵,又称肥田粉 (1)氮肥氨气的用途:(3)化工原料(2)致冷剂无机:生产硝酸、铵盐和纯碱等有机:合成纤维、塑料、染料和尿素等生产硝酸原理:侯德榜制碱法:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓氨气的制法:工业制法:N2 + 3H2 2NH3 (人工固氮)高温高压催化剂实验室制法: 1、药品: 2、原理: 3、装置:铵盐(氯化铵)与消石灰固体混合加热2NH4Cl +Ca(OH)2 CaCl2+2NH3 +2H2O固体 加热 气体,同于实验室用
KClO3和MnO2固体混合加热
制O2装置五、铵盐1、物性:2、化性:⑴不稳定性:⑵与碱溶液的反应:注意:⒈固体反应不写离子方程式。⒉是铵盐的通性,可用于NH4+ 的检验。NH4Cl == NH3 + HClNH4HCO3 == NH3 + H2O + CO2NH4+ + OH - == NH3 + H2O3、用途都是易溶于水的晶体,受热易分解,与强碱反应放出氨气。 3.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5% B、大于12.5%
C、小于12.5% D、无法确定C 4.标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,所得溶液的质量分数为__ ___ ___,物质的量浓度是____ ____ 。34.7%18.6 mol/l硝酸的化学性质一元强酸,易挥发,不稳定(分解),强氧化性1、见光或受热分解硝酸的浓度越大,越容易分解思考:久置硝酸为什么变黄?浓硝酸应如何保存?2、酸的通性(1)与指示剂作用,(2)与活泼金属反应不产生H2。(3)与碱和碱性氧化物反应:比较与CuO、FeO的反应,(4)与盐反应:比较与Na2CO3、Na2SO3 的反应 稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色2HNO3+CuO=Cu(NO3)2+H2O2HNO3 +CaCO3=Ca(NO3)2 +CO2↑ +H2OHNO3+NaOH=NaNO3+H2OFeO+HNO3==Fe(NO3)3+NO↑+H2O3、强氧化性:与还原性物质反应:如金属单质、非金属单质
Fe2+、I-、S2-、SO2等。a、与金属反应不产生氢气,N元素被还原反应规律:分析Cu、Fe分别与浓、稀硝酸反应常温时,Fe、Al遇浓硝酸也被钝化注意:硝酸与大部分的金属能反应3Cu +8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2OCu +4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2OC+4HNO3=2H2O+4NO2 ↑ +CO2 ↑酸的氧化性和氧化性的酸:
所有的酸都有氧化性,因为可以电离出H+, H+它有氧化性,但是H+的氧化性较弱。所谓氧化性酸指的是含氧酸中最高价的中心原子具有氧化性,它的氧化性一般都很强。b、与一些还原性物质的反应3Fe2+ + 4H+ + NO3- == 3Fe3+ + NO↑+ 2H2O3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O王水:浓硝酸和浓盐酸的体积比为 1∶3 的混合物c、与有机物的反应硝化反应:酯化反应:CH3CH2ONO2+H2O38.4 mg 铜跟适量的浓硝酸反应,铜全部作用完后,共收集到气体22.4mL(NO、NO2,标准状况),反应消耗的HNO3的物质的量可能是 ( )
A. 1.0×10-3mol B. 1.6×10-3mol
C. 2.2×10-3mol D. 2.4×10-3mol
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?
1919年,德国化学家哈伯首次用氮气和氢气合成了氨,奠定了大规模工业合成化肥的基础。化学对人类文明的伟大贡献之一便和氮气紧紧地连在了一起。1-4-2生产生活中的含氮化合物氮在自然界中的存在形式 大 气土壤水源生 物游离态的氮分子铵盐、硝酸盐(无机氮)氨基酸、蛋白质(有机氮) 氮元素在自然界中既有游离态、又有化合态。它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。电子式: 原子结构
(1)表示方法: 原子结构示意图:
(2)元素周期表中位:(第二周期,ⅤA族)氮的固定和循环人工固氮自然固氮高能固氮生物固氮氮的固定(1)(2)概念:氮由游离态转化为化合态的过程。简称固氮。 高温、高压、催化剂下使氮气与氢气反应生成氨。 在闪电等高能量作用下,N2在空气中发生反应。 有固氮能力的生物将游离态氮固定为氮的化合物。 N2+O2 = 2NO
2NO +O2 = 2NO2
3NO2 + H2O = 2HNO3+ NO人工固氮相关反应N2+3H2 2NH3高能固氮的相关反应 放电一、氮氧化物的产生与转化谚语:雷雨发庄稼原理硝酸根离子被植物的根系吸收转化为植物生长所需的养料氮气稳定,很难与其他物质反应常用做保护气氮氧化物(NO和NO2)氮的氧化物的分子式,找出相互转化关系?N2O NO N2O3 NO2 N2O4 N2O52NO + O2 = 2NO22NO2 N2O4 (说明:可逆、共存)注意:NO的“功”与“过”
“过”:NO有毒,能与人体的血红蛋白结合而使血液失去载氧能力
“功”:极少量的NO会促进血管扩张,防止血栓塞
NO2能自身化合:2NO2 N2O4
NO2具有氧化性,可使淀粉KI试纸变蓝。 实验室收集NO只能用排水集气法,不能用排空气法;而收集NO2只能用向上排空气法,不能用排水法.氮氧化物对环境的污染⑴ 硝酸型酸雨的形成:
虽然硝酸根离子被植物的根系吸收转化为植物生长所需的养料,但雨水中的硝酸也是形成酸雨的主要物质,会对环境造成很大的污染⑵ 光化学烟雾的形成
①汽车尾气排放的NO被氧化为NO2
2NO+O2 = 2NO2
②在日光照射下,NO2和O2经过复杂的反应生成臭氧 NO2 = NO+O O+O2 = O3 2NO+O2 = 2NO2 (氮氧化物是氧气转化为臭氧的催化剂)
③臭氧与空气中的一些碳氢化合物作用,产生一种有毒的烟雾,人们称它为光化学烟雾⑶氮氧化物对臭氧层的破坏
臭氧层主要分布在距地面20-25km的大气层中,臭氧能吸收紫外线,防止地球上的生物受到伤害。而飞机尾气中的氮氧化物(NO和NO2)对臭氧层(含O3和O)会造成破坏,可简单表示为:O3+NO = O2+NO2 O+NO2 = NO+O2
注:氮氧化物是臭氧转化为氧气的催化剂(4)预防和控制氮氧化物对空气污染的办法和措施 A 、使用洁净能源,减少氮氧化物的排放; B 、为汽车安装尾气转化装置; C、 处理工厂废气 (通常用碱液吸收) 其它氮的污染。
A、使水体富营养化。(水华、赤潮)
进一步污水处理,控制和利用多余的氮。
B、精确施肥,提高氮肥利用率。加强人畜禽粪便的回收与管理,提高有机肥的利用率。友情提示:NO、NO2有毒,是大气污染物,可用碱液吸收:
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
由上可知:当n(NO2)≥n(NO)时,尾气才能被吸收完全,否则不能被完全吸收1.相同条件下,分别测定下列各气体的相对分子质量,测得值与该气体相对分子质量有差异的是 ( )
A. NO2 B. O2 C. N2 D. CO
2.鉴别NO2和溴蒸气,可选用的试剂是 ( )
A.淀粉碘化钾溶液 B.蒸馏水
C.NaOH溶液 D.AgNO3溶液ABD解题规律与技巧:
NOX与O2、H2O反应的计算技巧2NO+O2 = 2NO2①3NO2+H2O = 2HNO3+NO②①×3+②×2①+②×24NO+3O2+2H2O = 4HNO3 4NO2+O2+2H2O = 4HNO3 复合方程式:2、由NO2和O2的混合气40mL,通过足量的水吸收后剩下5mL气体,则原混合气体中NO2和O2的体积比为( )
A. 1∶3 B. 1∶1 C. 7∶1 D. 7∶3析:题中没有明确剩余5mL是何种气体,故有两种可能: (1)当剩余5mL O2时肯定无NO2,设NO2体积为x,由4NO2+O2+2H2O=4HNO3可得x+x/4+5=40,x=28,即NO2 :28mL, O2: 12mL, V(NO2)∶V(O2)=7∶3.
(2)当剩余5ml为NO时,肯定无O2,设O2为y,由
4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,可得4y+y+15=40,y=5 即 NO2:35ml, O2 :5mL, V(NO2)∶V(O2) = 7∶1,CD氮肥的种类:氨态化肥都来源于NH3硝态化肥:硝酸盐尿素(CO(NH2)2)二、氮肥的生产和使用俗称碳铵1、氨的物理性质(1) 色,有 气味的气体。无刺激性(2)密度比空气 小(3)易液化, 可用作 剂。致冷(4)极易溶于水。常温下,1体积水约能溶解 体积的氨。氨水的密度比水 ,且氨水浓度越大,其密度越 。700小小氨在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞。组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象形成喷泉,溶液充满烧瓶结论:氨气的溶解性极大氨气的喷泉实验实验成败的关键是什么?a.烧瓶干燥;
b.装置的气密性好;
c.收集的气体纯度尽可能高。3.化学性质(1)氨跟水的反应 NH3·H2O NH3 NH4+ H2O OH- H+④氨水保存:①分析氨水的成份:③氨水的密度:②氨水的溶质:湿润的红色石蕊试纸氨水是混合物能导电,而液氨是纯净物不导电。 (2)氨跟酸的反应NH3+HCl = NH4Cl2NH3+H2SO4 = (NH4)2SO4NH3+HNO3 = NH4NO3氨水具有挥发性,与挥发性酸发生反应,产生白烟 (3)氨跟氧气反应----催化氧化(接触氧化) (4) 氨与其它非金属反应8NH3+3Cl2 == N2+6NH4Cl (氨充足)2NH3+3Cl2 == N2+6HCl (氨不足)俗称硫铵,又称肥田粉 (1)氮肥氨气的用途:(3)化工原料(2)致冷剂无机:生产硝酸、铵盐和纯碱等有机:合成纤维、塑料、染料和尿素等生产硝酸原理:侯德榜制碱法:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓氨气的制法:工业制法:N2 + 3H2 2NH3 (人工固氮)高温高压催化剂实验室制法: 1、药品: 2、原理: 3、装置:铵盐(氯化铵)与消石灰固体混合加热2NH4Cl +Ca(OH)2 CaCl2+2NH3 +2H2O固体 加热 气体,同于实验室用
KClO3和MnO2固体混合加热
制O2装置五、铵盐1、物性:2、化性:⑴不稳定性:⑵与碱溶液的反应:注意:⒈固体反应不写离子方程式。⒉是铵盐的通性,可用于NH4+ 的检验。NH4Cl == NH3 + HClNH4HCO3 == NH3 + H2O + CO2NH4+ + OH - == NH3 + H2O3、用途都是易溶于水的晶体,受热易分解,与强碱反应放出氨气。 3.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
A、等于12.5% B、大于12.5%
C、小于12.5% D、无法确定C 4.标准状况下,1体积水中溶解700体积的氨气,所得溶液的密度为0.9 g/cm3,所得溶液的质量分数为__ ___ ___,物质的量浓度是____ ____ 。34.7%18.6 mol/l硝酸的化学性质一元强酸,易挥发,不稳定(分解),强氧化性1、见光或受热分解硝酸的浓度越大,越容易分解思考:久置硝酸为什么变黄?浓硝酸应如何保存?2、酸的通性(1)与指示剂作用,(2)与活泼金属反应不产生H2。(3)与碱和碱性氧化物反应:比较与CuO、FeO的反应,(4)与盐反应:比较与Na2CO3、Na2SO3 的反应 稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色2HNO3+CuO=Cu(NO3)2+H2O2HNO3 +CaCO3=Ca(NO3)2 +CO2↑ +H2OHNO3+NaOH=NaNO3+H2OFeO+HNO3==Fe(NO3)3+NO↑+H2O3、强氧化性:与还原性物质反应:如金属单质、非金属单质
Fe2+、I-、S2-、SO2等。a、与金属反应不产生氢气,N元素被还原反应规律:分析Cu、Fe分别与浓、稀硝酸反应常温时,Fe、Al遇浓硝酸也被钝化注意:硝酸与大部分的金属能反应3Cu +8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2OCu +4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2OC+4HNO3=2H2O+4NO2 ↑ +CO2 ↑酸的氧化性和氧化性的酸:
所有的酸都有氧化性,因为可以电离出H+, H+它有氧化性,但是H+的氧化性较弱。所谓氧化性酸指的是含氧酸中最高价的中心原子具有氧化性,它的氧化性一般都很强。b、与一些还原性物质的反应3Fe2+ + 4H+ + NO3- == 3Fe3+ + NO↑+ 2H2O3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O王水:浓硝酸和浓盐酸的体积比为 1∶3 的混合物c、与有机物的反应硝化反应:酯化反应:CH3CH2ONO2+H2O38.4 mg 铜跟适量的浓硝酸反应,铜全部作用完后,共收集到气体22.4mL(NO、NO2,标准状况),反应消耗的HNO3的物质的量可能是 ( )
A. 1.0×10-3mol B. 1.6×10-3mol
C. 2.2×10-3mol D. 2.4×10-3mol
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?
