化学能与电能的转化复习课件
图片预览




文档简介
课件24张PPT。1.原电池是______________________的装置.
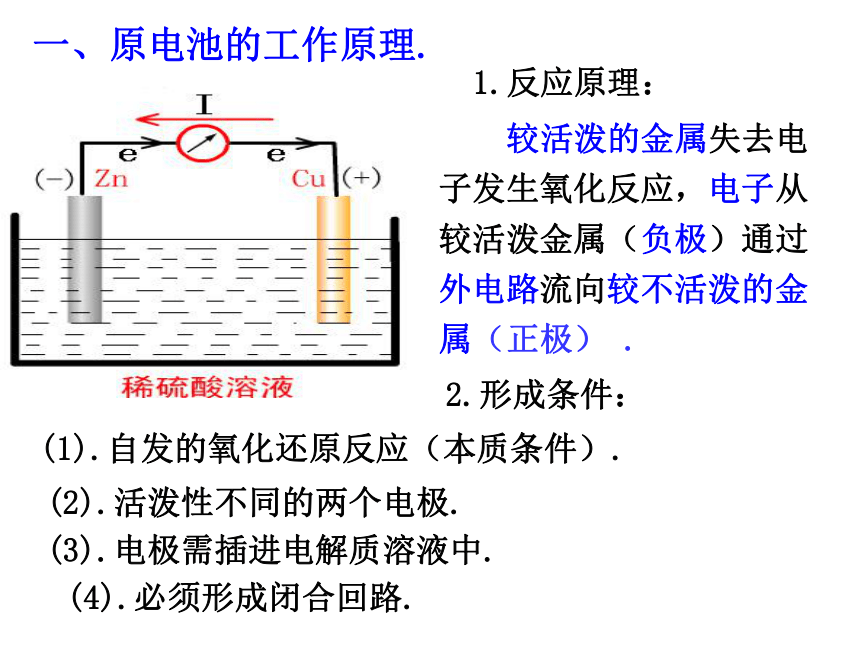
原电池反应的本质是_______________反应.将化学能转化为电能氧化还原2.如右图所示,组成的原电池:
(1).当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)
反应;Cu电极是______极,其电极反应为
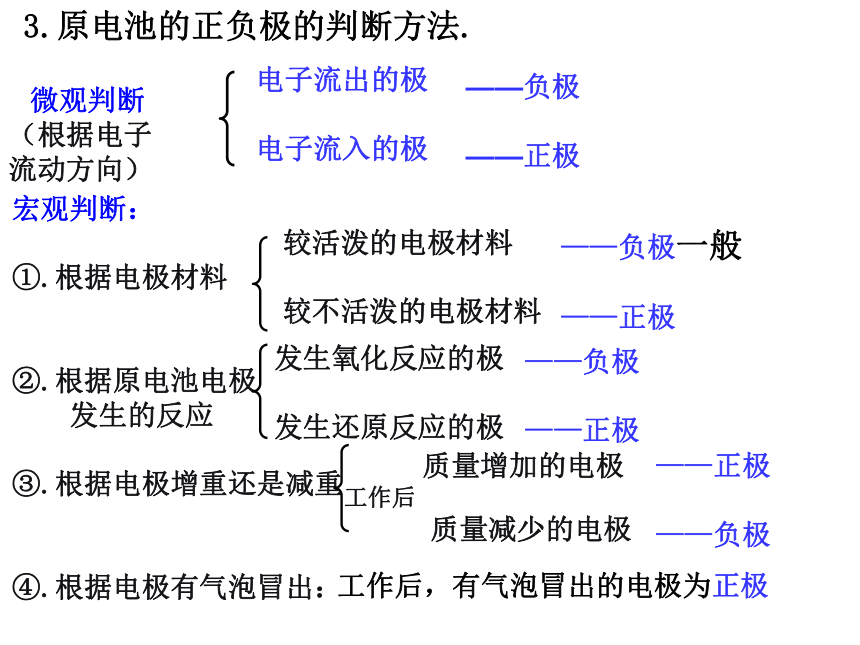
_______________,该反应是_________反应.(2).当电解质溶液为CuSO4溶液时: Zn电极是____极,其电极反应为_______________,该反应是________反应;Cu电极是____极,其电极反应为_______________,该反应_________反应.负Zn -2e - = Zn 2+氧化正2H+ +2e- =H2↑还原负Zn -2e- = Zn2+氧化正Cu2+ + 2e- = Cu还原化学能转化为电能2-2-3化学能与电能的转化一、原电池的工作原理.1.反应原理: 较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极) .2.形成条件:(1).自发的氧化还原反应(本质条件).(2).活泼性不同的两个电极.(3).电极需插进电解质溶液中.(4).必须形成闭合回路.3.原电池的正负极的判断方法.电子流出的极
电子流入的极——负极
——正极较活泼的电极材料
较不活泼的电极材料 质量增加的电极
工作后
质量减少的电极——负极一般
——正极——正极
——负极工作后,有气泡冒出的电极为正极发生氧化反应的极
发生还原反应的极宏观判断:
①.根据电极材料
②.根据原电池电极
发生的反应
③.根据电极增重还是减重
④.根据电极有气泡冒出:——负极
——正极1.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C2.Cu、Fe作两极,浓硝酸作电解质溶液的原电池中:①.Cu作____极, ②.Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是:___________________________负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 ↑+2H2OCu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O将化学能变成电能的装置.分类一次电池又称不可充电电池——如:干电池
二次电池又称充电电池——蓄电池
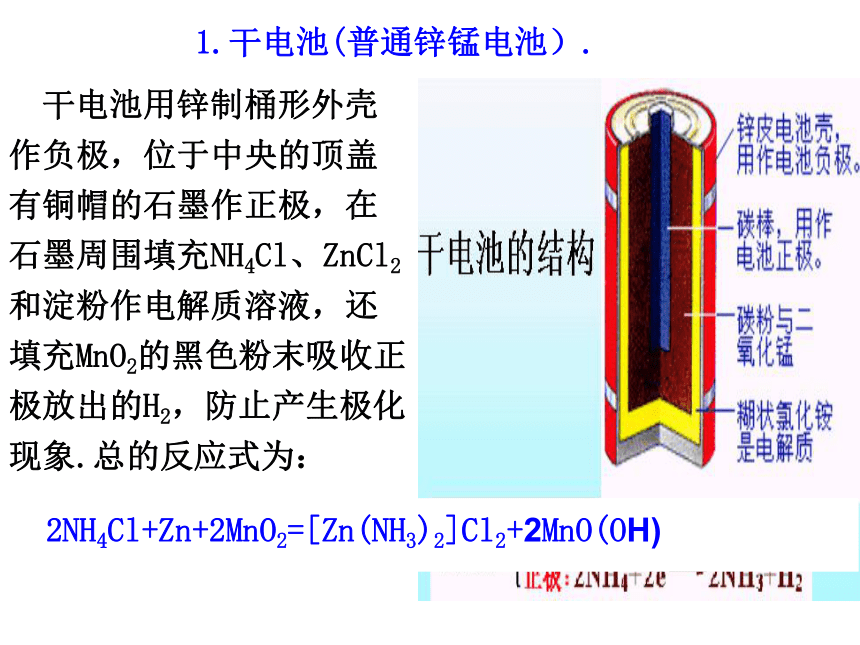
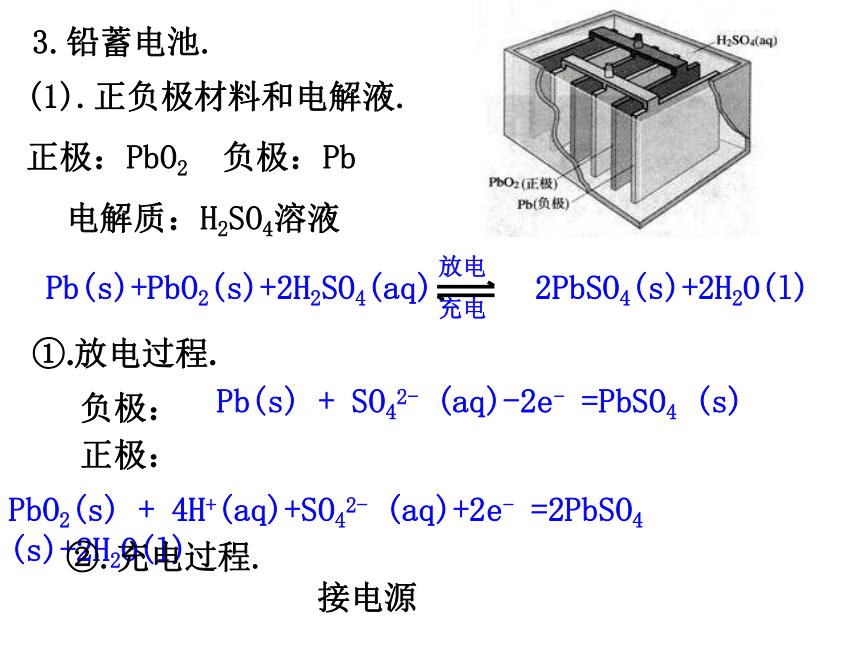
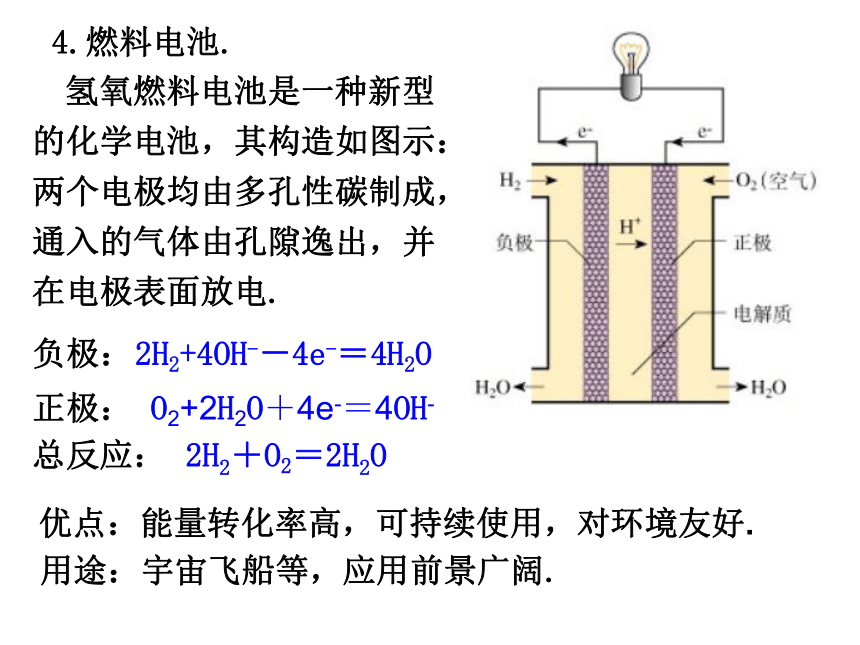
燃料电池优点电池优劣的判断标准:能量转换效率高,供能稳定可靠可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便易维护,可在各种环境下工作①.比能量:[符号(A·h/kg),(A·h/L)]指电池单位质量或单位体积所能输出电能的多少.②.比功率:[符号是W/kg,W/L)]指电池单位质量或单位体积所能输出功率的大小.③.电池的储存时间的长短.二、化学电源.1.干电池(普通锌锰电池). 干电池用锌制桶形外壳作负极,位于中央的顶盖有铜帽的石墨作正极,在石墨周围填充NH4Cl、ZnCl2和淀粉作电解质溶液,还填充MnO2的黑色粉末吸收正极放出的H2,防止产生极化现象.总的反应式为:2NH4Cl+Zn+2MnO2=[Zn(NH3)2]Cl2+2MnO(OH)2.银锌钮扣电池. 钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,电池内Zn的氧化产物为Zn(OH)2.负极:Zn+ 2OH- -2e- =Zn(OH)2正极 :Ag2O+ H2O +2e- =2Ag+ 2OH- 总反应式 :Ag2O+ Zn + H2O =Zn(OH)2+ 2Ag3.铅蓄电池.(1).正负极材料和电解液.正极:PbO2负极:Pb电解质:H2SO4溶液Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)①.放电过程.负极:Pb(s) + SO42- (aq)-2e- =PbSO4 (s)正极:PbO2(s) + 4H+(aq)+SO42- (aq)+2e- =2PbSO4 (s)+2H2O(l)②.充电过程.接电源4.燃料电池. 氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电.负极: 2H2+4OH--4e-=4H2O 正极: O2+2H2O+4e-=4OH-总反应: 2H2+O2=2H2O优点:能量转化率高,可持续使用,对环境友好. 用途:宇宙飞船等,应用前景广阔.原电池电极反应式的书写注意事项(1).电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”).(4).要注意电极反应产物是否与电解质溶液发生反应.(2).将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应.(3).负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在).金属的腐蚀与防护1.金属的腐蚀
(1)概念:金属与周围的空气或液体物质发生 反应而引起损耗的现象。氧化还原(2)分类
一般分为 腐蚀和 腐蚀两种。
(3)化学腐蚀
金属跟接触到的 气体或 液体等直接发生化学反应而引起的腐蚀。化学电化学氧化性氧化性(4)电化学腐蚀
①概念: 的金属跟 接触时,因为发生 反应而引起的腐蚀。
②分类
a.析氢腐蚀
在金属外面的水膜呈 性时发生析氢腐蚀。
以钢铁为例:
负极(Fe):
正极(C):不纯电解质溶液原电池较强酸Fe-2e- Fe2+2H++2e- H2↑b.吸氧腐蚀
在金属外面的水膜 很弱或呈 中性,溶解一定量 时发生吸氧腐蚀。
以钢铁为例:
负极(Fe):
正极(C):
总反应:
氧化过程:
脱水过程:酸性碱性O22Fe-4e- 2Fe2+O2+2H2O+4e- 4OH-2Fe+O2+2H2O 2Fe(OH)24Fe(OH)2+O2+2H2O 4Fe(OH)32Fe(OH)3 Fe2O3·nH2O+(3-n)H2O电能转化为化学能——电解 电解 概念:使电流通过电解质溶液(或熔化的电解质)而在阴、阳两极引起氧化还原反应的过程电解池 装置特点:电能转化为化学能 形成
条件 ①与电源相连的两个电极
②电解质溶液(或熔化的电解质)
③形成闭合回路电解原理电流氧化还原反应正极氧化负极还原负极阴极阳极正极阴极阳极S2-I-Cl-OH-Cu2+Pb2+Fe2+1.电解质溶液的导电过程,就是该溶液的电解过程,是化学变化。
2.电解池的阴阳极取决于外接电源的正负极,与电极材料的金属活动性无关。
3.阳极只要是金属电极(Au、Pt除外)优先失去电子,发生氧化反应,溶液中的阴离子无法放电。电解原理的应用粗铜纯铜Cu-2e- Cu2+Cu2++2e- Cu镀层金属镀件镀层金属离子2Cl--2e- Cl2↑2H++2e- H2↑a. (阴极):被保护的金属设备
(阳极):比被保护的金属活泼的金属
②外加电流的阴极保护法—— 原理
a. :被保护的金属设备
b. :惰性电极正极负极电解阴极阳极2.金属的防护
(1)改变金属的内部结构,使其成为防腐蚀金属,
如制成 等。
(2)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
(3)电化学防护
①牺牲阳极的阴极保护法—— 原理原电池不锈钢(1).比较金属活动性强弱.例1.下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出B.在氧化还原反应中,甲比乙失去的电子多D.同价态的阳离子,甲比乙的氧化性强C4.原电池原理应用.(2).比较反应速率.
例2.下列制氢气的反应速率最快的是C.粗锌和 1mol/L 盐酸A.纯锌和1mol/L 硫酸B.纯锌和18 mol/L 硫酸D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液D 例3.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)(3).比较金属腐蚀的快慢.(4).判断溶液pH值变化.例4.在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4Lx y 0.168L解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑大 0.015molmol0.175mol/L(5).原电池原理的综合应用.例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等.“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量.使用完后,会发现有大量铁锈存在.
.“热敷袋”是利用 放出热量.
2).炭粉的主要作用是 .
3).加入氯化钠的主要作用是 .
4).木屑的作用是__________________________. 铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀
原电池反应的本质是_______________反应.将化学能转化为电能氧化还原2.如右图所示,组成的原电池:
(1).当电解质溶液为稀H2SO4时:
Zn电极是____(填“正”或“负”)极,
其电极反应为_______________,该反应
是______(填“氧化”或“还原”,下同)
反应;Cu电极是______极,其电极反应为
_______________,该反应是_________反应.(2).当电解质溶液为CuSO4溶液时: Zn电极是____极,其电极反应为_______________,该反应是________反应;Cu电极是____极,其电极反应为_______________,该反应_________反应.负Zn -2e - = Zn 2+氧化正2H+ +2e- =H2↑还原负Zn -2e- = Zn2+氧化正Cu2+ + 2e- = Cu还原化学能转化为电能2-2-3化学能与电能的转化一、原电池的工作原理.1.反应原理: 较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极) .2.形成条件:(1).自发的氧化还原反应(本质条件).(2).活泼性不同的两个电极.(3).电极需插进电解质溶液中.(4).必须形成闭合回路.3.原电池的正负极的判断方法.电子流出的极
电子流入的极——负极
——正极较活泼的电极材料
较不活泼的电极材料 质量增加的电极
工作后
质量减少的电极——负极一般
——正极——正极
——负极工作后,有气泡冒出的电极为正极发生氧化反应的极
发生还原反应的极宏观判断:
①.根据电极材料
②.根据原电池电极
发生的反应
③.根据电极增重还是减重
④.根据电极有气泡冒出:——负极
——正极1.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C2.Cu、Fe作两极,浓硝酸作电解质溶液的原电池中:①.Cu作____极, ②.Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是:___________________________负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 ↑+2H2OCu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O将化学能变成电能的装置.分类一次电池又称不可充电电池——如:干电池
二次电池又称充电电池——蓄电池
燃料电池优点电池优劣的判断标准:能量转换效率高,供能稳定可靠可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便易维护,可在各种环境下工作①.比能量:[符号(A·h/kg),(A·h/L)]指电池单位质量或单位体积所能输出电能的多少.②.比功率:[符号是W/kg,W/L)]指电池单位质量或单位体积所能输出功率的大小.③.电池的储存时间的长短.二、化学电源.1.干电池(普通锌锰电池). 干电池用锌制桶形外壳作负极,位于中央的顶盖有铜帽的石墨作正极,在石墨周围填充NH4Cl、ZnCl2和淀粉作电解质溶液,还填充MnO2的黑色粉末吸收正极放出的H2,防止产生极化现象.总的反应式为:2NH4Cl+Zn+2MnO2=[Zn(NH3)2]Cl2+2MnO(OH)2.银锌钮扣电池. 钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,电池内Zn的氧化产物为Zn(OH)2.负极:Zn+ 2OH- -2e- =Zn(OH)2正极 :Ag2O+ H2O +2e- =2Ag+ 2OH- 总反应式 :Ag2O+ Zn + H2O =Zn(OH)2+ 2Ag3.铅蓄电池.(1).正负极材料和电解液.正极:PbO2负极:Pb电解质:H2SO4溶液Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)①.放电过程.负极:Pb(s) + SO42- (aq)-2e- =PbSO4 (s)正极:PbO2(s) + 4H+(aq)+SO42- (aq)+2e- =2PbSO4 (s)+2H2O(l)②.充电过程.接电源4.燃料电池. 氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电.负极: 2H2+4OH--4e-=4H2O 正极: O2+2H2O+4e-=4OH-总反应: 2H2+O2=2H2O优点:能量转化率高,可持续使用,对环境友好. 用途:宇宙飞船等,应用前景广阔.原电池电极反应式的书写注意事项(1).电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”).(4).要注意电极反应产物是否与电解质溶液发生反应.(2).将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应.(3).负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在).金属的腐蚀与防护1.金属的腐蚀
(1)概念:金属与周围的空气或液体物质发生 反应而引起损耗的现象。氧化还原(2)分类
一般分为 腐蚀和 腐蚀两种。
(3)化学腐蚀
金属跟接触到的 气体或 液体等直接发生化学反应而引起的腐蚀。化学电化学氧化性氧化性(4)电化学腐蚀
①概念: 的金属跟 接触时,因为发生 反应而引起的腐蚀。
②分类
a.析氢腐蚀
在金属外面的水膜呈 性时发生析氢腐蚀。
以钢铁为例:
负极(Fe):
正极(C):不纯电解质溶液原电池较强酸Fe-2e- Fe2+2H++2e- H2↑b.吸氧腐蚀
在金属外面的水膜 很弱或呈 中性,溶解一定量 时发生吸氧腐蚀。
以钢铁为例:
负极(Fe):
正极(C):
总反应:
氧化过程:
脱水过程:酸性碱性O22Fe-4e- 2Fe2+O2+2H2O+4e- 4OH-2Fe+O2+2H2O 2Fe(OH)24Fe(OH)2+O2+2H2O 4Fe(OH)32Fe(OH)3 Fe2O3·nH2O+(3-n)H2O电能转化为化学能——电解 电解 概念:使电流通过电解质溶液(或熔化的电解质)而在阴、阳两极引起氧化还原反应的过程电解池 装置特点:电能转化为化学能 形成
条件 ①与电源相连的两个电极
②电解质溶液(或熔化的电解质)
③形成闭合回路电解原理电流氧化还原反应正极氧化负极还原负极阴极阳极正极阴极阳极S2-I-Cl-OH-Cu2+Pb2+Fe2+1.电解质溶液的导电过程,就是该溶液的电解过程,是化学变化。
2.电解池的阴阳极取决于外接电源的正负极,与电极材料的金属活动性无关。
3.阳极只要是金属电极(Au、Pt除外)优先失去电子,发生氧化反应,溶液中的阴离子无法放电。电解原理的应用粗铜纯铜Cu-2e- Cu2+Cu2++2e- Cu镀层金属镀件镀层金属离子2Cl--2e- Cl2↑2H++2e- H2↑a. (阴极):被保护的金属设备
(阳极):比被保护的金属活泼的金属
②外加电流的阴极保护法—— 原理
a. :被保护的金属设备
b. :惰性电极正极负极电解阴极阳极2.金属的防护
(1)改变金属的内部结构,使其成为防腐蚀金属,
如制成 等。
(2)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
(3)电化学防护
①牺牲阳极的阴极保护法—— 原理原电池不锈钢(1).比较金属活动性强弱.例1.下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出B.在氧化还原反应中,甲比乙失去的电子多D.同价态的阳离子,甲比乙的氧化性强C4.原电池原理应用.(2).比较反应速率.
例2.下列制氢气的反应速率最快的是C.粗锌和 1mol/L 盐酸A.纯锌和1mol/L 硫酸B.纯锌和18 mol/L 硫酸D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液D 例3.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)(3).比较金属腐蚀的快慢.(4).判断溶液pH值变化.例4.在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH值变_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4Lx y 0.168L解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑大 0.015molmol0.175mol/L(5).原电池原理的综合应用.例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等.“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量.使用完后,会发现有大量铁锈存在.
.“热敷袋”是利用 放出热量.
2).炭粉的主要作用是 .
3).加入氯化钠的主要作用是 .
4).木屑的作用是__________________________. 铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀
