反应速率与反应限度复习课件
图片预览






文档简介
课件19张PPT。 化学反应速率 vA=ΔCA/Δt
单位:mol·(L·min)-1或mol·(L·s)-1或mol·(L·h)-1 选用不同物质表示速率,数值可能不同,所以应注明表示的物质。不同的时间间隔内不一定相等 。计算:v(反应物)= = ,
v(生成物) = = 化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。 化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。一、化学反应速率的表示2-2-1化学反应速率与反应限度
对于纯固体或纯液体参加的化学反应,因其密度不变,在反应中浓度也不改变,故不用纯固体、纯液体表示反应速率。
化学反应速率的研究对象可以是可逆反应,也可以是进行完全的反应。
用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来表示,才能用数字的大小来比较快慢。化学反应速率是平均速率,均取正值 。【例题】在2L的密闭容器中,加入1mol N2和3mol H2,发生 N2 + 3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。 N2 + 3H2 =? 2 NH3起始浓度(mol/L) 0.5 1.5 02s末浓度(mol/L) 0.21.20.4v(N2)= (0.5-0.4)/2=0.05mol/ (L·s) v(H2)= (1.5-1.2)/2=0.15 mol/ (L·s) v(NH3)= (0.2-0)/2=0.1mol/ (L·s) 选用不同物质表示的速率比等于该反应方程式的化学计量数之比。 vA=ΔCA/Δt 例2、对于可逆反应N2+3H2 2NH3下列各项所表示的反应速率最快的是
A.V(N2)=0.01mol/(L·S) B.V(H2)=0.2mol/(L·S)
C.V(H2)=0.6mol/(L·min) D.V(NH3)=1.2mol/(L·min)B例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L , c(Z)=0.4mol/L,则该反应的反应方程式可表示为:3X2 + Y2 === 2X3Y3X2 + Y2 === 2Z练习1:下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/(L·S)”所表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越来越明显C习题2:将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应 :
2A(g)+B(g) 2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
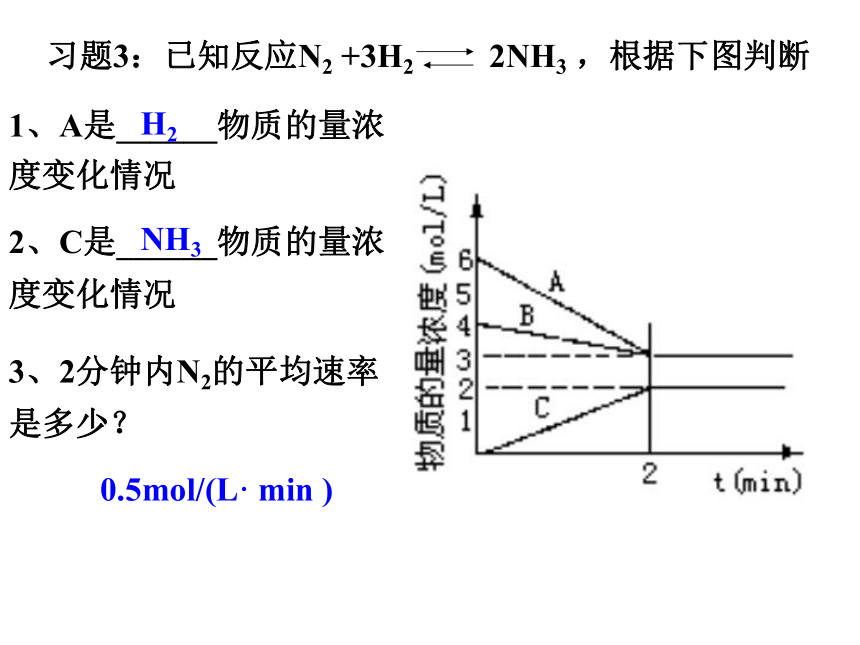
其中正确的是 ( ) A.①③ B.①④ C.②③ D.③④B习题3:已知反应N2 +3H2 2NH3 ,根据下图判断1、A是______物质的量浓度变化情况2、C是______物质的量浓度变化情况3、2分钟内N2的平均速率是多少?H2NH30.5mol/(L· min )二、外界条件对反应速率的影响内因:反应物的结构、性质----主要外因:浓度、温度、压强、催化剂3、浓度对反应速率的影响(压强)其他条件不变,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率1、温度对化学反应速率的影响 当其他条件不变的的情况时,升高温度可以增大反应速率。2、催化剂对化学反应速率的影响催化剂能够改变化学反应速率 压强、光、超声波、放射线、电磁波、反应物颗粒大小、溶剂等对反应速率也有影响。 2.影响化学反应速率的外界条件
(1)浓度:对气体参加的反应或在 中进行的 产生影响,在其他条件不变时,增大反应物的浓度,化学反应速率 ,与反应物的总量 。
(2)压强:对有 参加的化学反应而言,在温度一定时,对一定量气体,增大压强就会使 缩小,使气体 增大,化学反应速率 。若减小压强,气体体积扩大,气体反应物浓度就减小,化学反应速率也减小。
(3)温度:温度升高,化学反应速率 ,一般地说,温度每升高10℃,反应速率增大到原来的 倍。升高温度,无论是吸热反应还是放热反应,速率 。
(4)催化剂:催化剂 化学反应速率,但不能使本来不会发生的反应变为可能。催化剂 反应过程,只是反应前后质量与组成 。溶液反应增大无关气体气体体积浓度增大增大2~4都增大改变(增大或减弱)参与不变练习:在下列事实中,什么因素影响了化学反应速率:
(1)同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生的气体有快有慢
(2)夏天的食品易霉变,而冬天不易发生该现象
(3)葡萄糖在空气中燃烧时需要较高的温度,可是在人体里,在正常体温(37℃)时,就可以被氧化
(4)黄铁矿煅烧时要粉碎成矿粒
(5)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时发生爆炸
(6)KI晶体和HgCl2晶体混合无明显现象,若投入水中,则很快生产红色的HgI2物质的性质温度催化剂固体表面积光照物质的状态3.对于化学反应:H2(g)+I2(g) 2HI(g)。在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)?
(A)缩小体积使压强增大 。
(B)体积不变充入H2使压强增大 。
(C)体积不变充入氩气使压强增大 。
(D)压强不变充入氩气使体积增大 。
(E)增大体积使压强减小 。加快加快不变减慢减慢化学反应的限度1.可逆反应:在 条件下,既能向 方向进行又能向 方向进行的反应。
2.化学平衡状态
在一定条件下,将0.02 mol CO和0.02 mol H2O(g)通入2 L密闭容器中,进行反应:
CO+H2O(g) CO2+H2
(1)反应刚开始时,反应物浓度 ,正反应速率 ;生成物浓度为 ,逆反应速率为 。
(2)反应进行中,反应物浓度逐渐 ,正反应速率逐渐 ,生成物浓度逐渐 ,逆反应速率逐渐 。相同正反应逆反应最大最大00减小减小增大增大特点:可逆反应不可能完全进行到底。(3)达到平衡时,正反应速率与逆反应速率 ,此时反应物浓度 ,生成物浓度也 。
(4)若达平衡时,水蒸气的体积分数与H2的体积分数相等,则平衡时一氧化碳的转化率为 。
用可逆反应中正反应速率和逆反应速率的变化表示上述过程,如图所示:相等不再发生变化不再发生变化50%CO+H2O(g) CO2+H2化学平衡(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态(2)特征:a.逆:可逆反应b.等:V正=V逆c.动: V正=V逆≠0,即是一个动态平衡d.定:平衡混合物中各组分的百分含量一定e.变:条件改变,平衡改变,直到建立新的平衡(3)判断依据 a. V正=V逆
b.反应混合物中各组分的浓度保持不变A、C生成的速率与分解的速率相等B、A、B、C的浓度不在发生变化C、单位时间内,生成nmolA,同时生成3nmolBD、A、B、C的分子数之比为1:3:2A、B例1:在一定温度下,可逆反应A+3B 2C达到平衡状态的标志是( )例2 : 某温度时,将1molNO2分解:2NO2==2NO+O2,并达到平衡,此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 == 2NO + O2始 1mol 0 0变 x x 0.5x1.在密闭容器中充入PCl5,使其发生化学反应
PCl5 PCl3+Cl2,反应一段时间后又向其中加入37Cl2,在重新达到化学平衡状态时,37Cl原子存在于( )
A.PCl5 B.PCl3 C.Cl2 D.三种物质中都有
2.在密闭容器中,进行如下反应:A+3B 2C如开始时只投入2molC,达到反应限度后下列说法正确的是( )
A.容器中含有1molA和3molB
B.如继续通入A能使反应限度改变
C.反应限度不能再改变
D.加入催化剂后反应速率改变,因此反应限度也随之改变DB3.增大压强,对已达到平衡的反应:
3X(g)+Y(g) 2Z(g)+2Q(g)产生的影响是 ( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都没有变化,平衡不移动
D.正、逆反应速率都增大,但平衡不发生移动
D38.4 mg 铜跟适量的浓硝酸反应,铜全部作用完后,共收集到气体22.4mL(NO、NO2,标准状况),反应消耗的HNO3的物质的量可能是 ( )
A. 1.0×10-3mol B. 1.6×10-3mol
C. 2.2×10-3mol D. 2.4×10-3mol
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?(5).原电池原理的综合应用.例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等.“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量.使用完后,会发现有大量铁锈存在.
.“热敷袋”是利用 放出热量.
2).炭粉的主要作用是 .
3).加入氯化钠的主要作用是 .
4).木屑的作用是__________________________. 铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀
单位:mol·(L·min)-1或mol·(L·s)-1或mol·(L·h)-1 选用不同物质表示速率,数值可能不同,所以应注明表示的物质。不同的时间间隔内不一定相等 。计算:v(反应物)= = ,
v(生成物) = = 化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。 化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。一、化学反应速率的表示2-2-1化学反应速率与反应限度
对于纯固体或纯液体参加的化学反应,因其密度不变,在反应中浓度也不改变,故不用纯固体、纯液体表示反应速率。
化学反应速率的研究对象可以是可逆反应,也可以是进行完全的反应。
用化学反应速率来比较不同反应进行得快慢或同一反应在不同条件下反应的快慢时,应选择同一物质来表示,才能用数字的大小来比较快慢。化学反应速率是平均速率,均取正值 。【例题】在2L的密闭容器中,加入1mol N2和3mol H2,发生 N2 + 3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。 N2 + 3H2 =? 2 NH3起始浓度(mol/L) 0.5 1.5 02s末浓度(mol/L) 0.21.20.4v(N2)= (0.5-0.4)/2=0.05mol/ (L·s) v(H2)= (1.5-1.2)/2=0.15 mol/ (L·s) v(NH3)= (0.2-0)/2=0.1mol/ (L·s) 选用不同物质表示的速率比等于该反应方程式的化学计量数之比。 vA=ΔCA/Δt 例2、对于可逆反应N2+3H2 2NH3下列各项所表示的反应速率最快的是
A.V(N2)=0.01mol/(L·S) B.V(H2)=0.2mol/(L·S)
C.V(H2)=0.6mol/(L·min) D.V(NH3)=1.2mol/(L·min)B例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L , c(Z)=0.4mol/L,则该反应的反应方程式可表示为:3X2 + Y2 === 2X3Y3X2 + Y2 === 2Z练习1:下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为“0.8mol/(L·S)”所表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越来越明显C习题2:将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应 :
2A(g)+B(g) 2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是 ( ) A.①③ B.①④ C.②③ D.③④B习题3:已知反应N2 +3H2 2NH3 ,根据下图判断1、A是______物质的量浓度变化情况2、C是______物质的量浓度变化情况3、2分钟内N2的平均速率是多少?H2NH30.5mol/(L· min )二、外界条件对反应速率的影响内因:反应物的结构、性质----主要外因:浓度、温度、压强、催化剂3、浓度对反应速率的影响(压强)其他条件不变,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率1、温度对化学反应速率的影响 当其他条件不变的的情况时,升高温度可以增大反应速率。2、催化剂对化学反应速率的影响催化剂能够改变化学反应速率 压强、光、超声波、放射线、电磁波、反应物颗粒大小、溶剂等对反应速率也有影响。 2.影响化学反应速率的外界条件
(1)浓度:对气体参加的反应或在 中进行的 产生影响,在其他条件不变时,增大反应物的浓度,化学反应速率 ,与反应物的总量 。
(2)压强:对有 参加的化学反应而言,在温度一定时,对一定量气体,增大压强就会使 缩小,使气体 增大,化学反应速率 。若减小压强,气体体积扩大,气体反应物浓度就减小,化学反应速率也减小。
(3)温度:温度升高,化学反应速率 ,一般地说,温度每升高10℃,反应速率增大到原来的 倍。升高温度,无论是吸热反应还是放热反应,速率 。
(4)催化剂:催化剂 化学反应速率,但不能使本来不会发生的反应变为可能。催化剂 反应过程,只是反应前后质量与组成 。溶液反应增大无关气体气体体积浓度增大增大2~4都增大改变(增大或减弱)参与不变练习:在下列事实中,什么因素影响了化学反应速率:
(1)同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生的气体有快有慢
(2)夏天的食品易霉变,而冬天不易发生该现象
(3)葡萄糖在空气中燃烧时需要较高的温度,可是在人体里,在正常体温(37℃)时,就可以被氧化
(4)黄铁矿煅烧时要粉碎成矿粒
(5)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时发生爆炸
(6)KI晶体和HgCl2晶体混合无明显现象,若投入水中,则很快生产红色的HgI2物质的性质温度催化剂固体表面积光照物质的状态3.对于化学反应:H2(g)+I2(g) 2HI(g)。在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)?
(A)缩小体积使压强增大 。
(B)体积不变充入H2使压强增大 。
(C)体积不变充入氩气使压强增大 。
(D)压强不变充入氩气使体积增大 。
(E)增大体积使压强减小 。加快加快不变减慢减慢化学反应的限度1.可逆反应:在 条件下,既能向 方向进行又能向 方向进行的反应。
2.化学平衡状态
在一定条件下,将0.02 mol CO和0.02 mol H2O(g)通入2 L密闭容器中,进行反应:
CO+H2O(g) CO2+H2
(1)反应刚开始时,反应物浓度 ,正反应速率 ;生成物浓度为 ,逆反应速率为 。
(2)反应进行中,反应物浓度逐渐 ,正反应速率逐渐 ,生成物浓度逐渐 ,逆反应速率逐渐 。相同正反应逆反应最大最大00减小减小增大增大特点:可逆反应不可能完全进行到底。(3)达到平衡时,正反应速率与逆反应速率 ,此时反应物浓度 ,生成物浓度也 。
(4)若达平衡时,水蒸气的体积分数与H2的体积分数相等,则平衡时一氧化碳的转化率为 。
用可逆反应中正反应速率和逆反应速率的变化表示上述过程,如图所示:相等不再发生变化不再发生变化50%CO+H2O(g) CO2+H2化学平衡(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态(2)特征:a.逆:可逆反应b.等:V正=V逆c.动: V正=V逆≠0,即是一个动态平衡d.定:平衡混合物中各组分的百分含量一定e.变:条件改变,平衡改变,直到建立新的平衡(3)判断依据 a. V正=V逆
b.反应混合物中各组分的浓度保持不变A、C生成的速率与分解的速率相等B、A、B、C的浓度不在发生变化C、单位时间内,生成nmolA,同时生成3nmolBD、A、B、C的分子数之比为1:3:2A、B例1:在一定温度下,可逆反应A+3B 2C达到平衡状态的标志是( )例2 : 某温度时,将1molNO2分解:2NO2==2NO+O2,并达到平衡,此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 == 2NO + O2始 1mol 0 0变 x x 0.5x1.在密闭容器中充入PCl5,使其发生化学反应
PCl5 PCl3+Cl2,反应一段时间后又向其中加入37Cl2,在重新达到化学平衡状态时,37Cl原子存在于( )
A.PCl5 B.PCl3 C.Cl2 D.三种物质中都有
2.在密闭容器中,进行如下反应:A+3B 2C如开始时只投入2molC,达到反应限度后下列说法正确的是( )
A.容器中含有1molA和3molB
B.如继续通入A能使反应限度改变
C.反应限度不能再改变
D.加入催化剂后反应速率改变,因此反应限度也随之改变DB3.增大压强,对已达到平衡的反应:
3X(g)+Y(g) 2Z(g)+2Q(g)产生的影响是 ( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都没有变化,平衡不移动
D.正、逆反应速率都增大,但平衡不发生移动
D38.4 mg 铜跟适量的浓硝酸反应,铜全部作用完后,共收集到气体22.4mL(NO、NO2,标准状况),反应消耗的HNO3的物质的量可能是 ( )
A. 1.0×10-3mol B. 1.6×10-3mol
C. 2.2×10-3mol D. 2.4×10-3mol
14g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,求合金中铜的质量分数?(5).原电池原理的综合应用.例6:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等.“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量.使用完后,会发现有大量铁锈存在.
.“热敷袋”是利用 放出热量.
2).炭粉的主要作用是 .
3).加入氯化钠的主要作用是 .
4).木屑的作用是__________________________. 铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀
