电解与电镀
图片预览






文档简介
课件17张PPT。电解与电镀知识点一:电解的原理概念
电流通过电解质溶液在阴、阳两级引起氧化还原反应的过程。
电解池的构造
直流电源、两电极、电解质溶液或熔融电解质
电极反应
电极上进行的半反应。阳极:氧化反应
阴极:还原反应离子自由移动阳离子(Cu2+,H+)向阴极移动
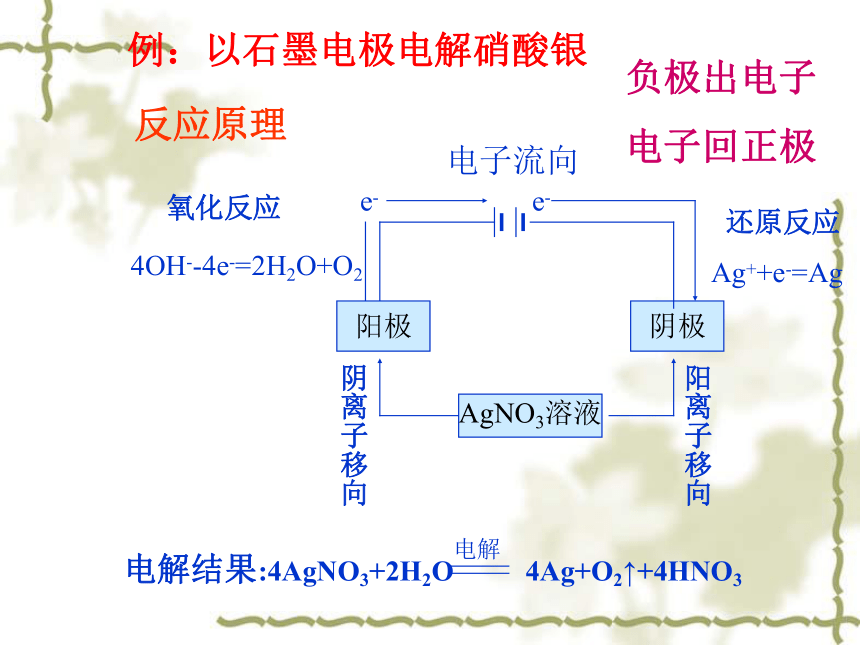
阴离子(Cl-,OH-)向阳极移动离子定向移动电解中以电解CuCl2为例:知识点一:电解的原理电池电解原理( 阳氧阴还 )(2Cl=Cl2)电极反应阴离子失去电子而阳离子得到电子的过程叫放电。阴极:Cu2++2e=Cu(还原)放电:知识点一:电解的原理反应原理例:以石墨电极电解硝酸银负极出电子
电子回正极(1)阴极 : 氧化性越强,越易放电 (溶液中阳离子得电子) ----与电极材料无关. 离子的放电顺序Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+> Zn2+> Al3+>Mg2+>Na+>Ca+>K+活性电极>S 2->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-(2)阳极: 还原性越强,越易放 (阳极本身或溶液中阴离子失电子) ----与电极材料有关.若阳极为活性电性,则阳极失电子溶解.若阳极为惰性电极,则溶液中阴离子失电子.注意: 离子放电顺序与电极材料﹑离子本身的氧化性﹑还原性及离子浓度等因素有关.例:电镀时: Zn2+> H+(1)电解含氧酸、强碱溶液及活泼金属的含氧酸盐,实质上是电解水。(2)电解不活泼金属的含氧酸盐,阳极产生氧气,阴极析出不活泼金属。(3)电解活泼金属无氧酸盐,阴极产生氢气,阳极析出非金属。(4)电解熔融物﹑不活泼金属无氧酸盐﹑无氧酸,实际上是电解电解质本身。电解规律例1:用惰性电极电解下例溶液后,再加入一定量 的另一
种物质(方括号内),溶液能与原溶液完全一样的是
A﹑CuCl2〔CuSO4〕 B﹑NaOH〔NaOH〕
C﹑NaCl〔HCl〕 D﹑CuSO4〔Cu(OH)2〕例2:某溶液中含有等物质的量的硝酸铜和氯化镁,
对该溶液进行电解,分阶段写出电解方程式和电
极方程式。课本实验讲解知识点二:电解的应用氯碱工业工业上用电解饱和食盐水的方法来制取NaOH﹑Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.1﹑反应原理:阳极: 2Cl-- 2e- = Cl2↑阴极: 2H+ + 2e- = H2↑总反应: 2NaCl+2H2O===2NaOH+H2↑+Cl2↑
通电氯碱厂电解饱和食盐水制取
NaOH的工艺流程图: ???????????????????????????????????????????????????????
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学
方程式:____。与电源负极相连的电极附近,溶液pH值___
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序
为_______(选填a,b,c).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c .先加钡试剂,后加NaOH,再加Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__、
冷却________(填写操作名称)除去NaCl。
(4)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。知识点二:电解的应用电解精炼铜阳极: 粗铜(含少量Zn﹑Fe﹑Ni﹑Ag﹑Au等)阴极: 纯铜电解液: CuSO4溶液(加入一定量的硫酸)阳极: Cu - 2e- = Cu2+Zn - 2e- = Zn2+Fe - 2e- = Fe2+Ni - 2e- = Ni2+(Au﹑Ag沉积下来,形成阳极泥)阴极:Cu2+ + 2e- = CuCuSO4溶液浓度基本保持不变-------因阳极上铜溶解的速率与阴极上铜沉积的速率相同.电镀电镀: 利用电解原理在某些金属表面镀上一层其他金属或合金的过程.阳极: 镀层金属阴极: 待镀金属电解液: 含镀层金属离子的电解质溶液知识点二:电解的应用课本实验讲解电解计算依据:所有电极上转移电子的物质的量相等
①电极产物变化量
②溶液中离子浓度的改变量
③多池串联时各电极上产物的量
④阿佛加德罗常数的求算
Q=It=e·NA·n(e-)例题1在下列两个电解池
中,a﹑b两极都是
石墨电极。将电源
接通,通电16分5秒,电流强度为5安培,Pt电极质量增加5.40g。试回答下列问题(已知一个电子的电量为1.6×10-19库仑)
(1)在a、b极上析出质量各为多少g?
(2)Ag电极溶解多少g?根据该池给出的实验数据,计算阿伏加德罗常数是多少? 例2、用惰性电极电解VL某二价金属的硫酸盐溶液一段时间后,阴极有Wg金属析出,溶液的pH从6.5变为2.0(体积变化可以忽略不计)。析出金属的相对原子质量为( ) A. B. C. D. B 5、由于Fe(OH)2极易被氧化.所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图4—18所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。(1)a电极材料应为__,电极反应式为_____。
(2)电解液C可以是______(填编号)。 A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为______,在加入苯之前对C应做何简单处理?______。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)______。
A.改用稀硫酸作电解液 B.适当增大电源电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若C为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源来电解,除了电极上看到气泡外,混合物中另一明显现象为________。铁Fe - 2e- = Fe2+BCBC白色沉淀变逐渐红褐色隔绝空气,防止空气中的氧气氧化氢氧化亚铁加热煮沸
电流通过电解质溶液在阴、阳两级引起氧化还原反应的过程。
电解池的构造
直流电源、两电极、电解质溶液或熔融电解质
电极反应
电极上进行的半反应。阳极:氧化反应
阴极:还原反应离子自由移动阳离子(Cu2+,H+)向阴极移动
阴离子(Cl-,OH-)向阳极移动离子定向移动电解中以电解CuCl2为例:知识点一:电解的原理电池电解原理( 阳氧阴还 )(2Cl=Cl2)电极反应阴离子失去电子而阳离子得到电子的过程叫放电。阴极:Cu2++2e=Cu(还原)放电:知识点一:电解的原理反应原理例:以石墨电极电解硝酸银负极出电子
电子回正极(1)阴极 : 氧化性越强,越易放电 (溶液中阳离子得电子) ----与电极材料无关. 离子的放电顺序Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+> Zn2+> Al3+>Mg2+>Na+>Ca+>K+活性电极>S 2->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-(2)阳极: 还原性越强,越易放 (阳极本身或溶液中阴离子失电子) ----与电极材料有关.若阳极为活性电性,则阳极失电子溶解.若阳极为惰性电极,则溶液中阴离子失电子.注意: 离子放电顺序与电极材料﹑离子本身的氧化性﹑还原性及离子浓度等因素有关.例:电镀时: Zn2+> H+(1)电解含氧酸、强碱溶液及活泼金属的含氧酸盐,实质上是电解水。(2)电解不活泼金属的含氧酸盐,阳极产生氧气,阴极析出不活泼金属。(3)电解活泼金属无氧酸盐,阴极产生氢气,阳极析出非金属。(4)电解熔融物﹑不活泼金属无氧酸盐﹑无氧酸,实际上是电解电解质本身。电解规律例1:用惰性电极电解下例溶液后,再加入一定量 的另一
种物质(方括号内),溶液能与原溶液完全一样的是
A﹑CuCl2〔CuSO4〕 B﹑NaOH〔NaOH〕
C﹑NaCl〔HCl〕 D﹑CuSO4〔Cu(OH)2〕例2:某溶液中含有等物质的量的硝酸铜和氯化镁,
对该溶液进行电解,分阶段写出电解方程式和电
极方程式。课本实验讲解知识点二:电解的应用氯碱工业工业上用电解饱和食盐水的方法来制取NaOH﹑Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.1﹑反应原理:阳极: 2Cl-- 2e- = Cl2↑阴极: 2H+ + 2e- = H2↑总反应: 2NaCl+2H2O===2NaOH+H2↑+Cl2↑
通电氯碱厂电解饱和食盐水制取
NaOH的工艺流程图: ???????????????????????????????????????????????????????
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学
方程式:____。与电源负极相连的电极附近,溶液pH值___
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序
为_______(选填a,b,c).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c .先加钡试剂,后加NaOH,再加Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__、
冷却________(填写操作名称)除去NaCl。
(4)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。知识点二:电解的应用电解精炼铜阳极: 粗铜(含少量Zn﹑Fe﹑Ni﹑Ag﹑Au等)阴极: 纯铜电解液: CuSO4溶液(加入一定量的硫酸)阳极: Cu - 2e- = Cu2+Zn - 2e- = Zn2+Fe - 2e- = Fe2+Ni - 2e- = Ni2+(Au﹑Ag沉积下来,形成阳极泥)阴极:Cu2+ + 2e- = CuCuSO4溶液浓度基本保持不变-------因阳极上铜溶解的速率与阴极上铜沉积的速率相同.电镀电镀: 利用电解原理在某些金属表面镀上一层其他金属或合金的过程.阳极: 镀层金属阴极: 待镀金属电解液: 含镀层金属离子的电解质溶液知识点二:电解的应用课本实验讲解电解计算依据:所有电极上转移电子的物质的量相等
①电极产物变化量
②溶液中离子浓度的改变量
③多池串联时各电极上产物的量
④阿佛加德罗常数的求算
Q=It=e·NA·n(e-)例题1在下列两个电解池
中,a﹑b两极都是
石墨电极。将电源
接通,通电16分5秒,电流强度为5安培,Pt电极质量增加5.40g。试回答下列问题(已知一个电子的电量为1.6×10-19库仑)
(1)在a、b极上析出质量各为多少g?
(2)Ag电极溶解多少g?根据该池给出的实验数据,计算阿伏加德罗常数是多少? 例2、用惰性电极电解VL某二价金属的硫酸盐溶液一段时间后,阴极有Wg金属析出,溶液的pH从6.5变为2.0(体积变化可以忽略不计)。析出金属的相对原子质量为( ) A. B. C. D. B 5、由于Fe(OH)2极易被氧化.所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图4—18所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。(1)a电极材料应为__,电极反应式为_____。
(2)电解液C可以是______(填编号)。 A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为______,在加入苯之前对C应做何简单处理?______。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)______。
A.改用稀硫酸作电解液 B.适当增大电源电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若C为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源来电解,除了电极上看到气泡外,混合物中另一明显现象为________。铁Fe - 2e- = Fe2+BCBC白色沉淀变逐渐红褐色隔绝空气,防止空气中的氧气氧化氢氧化亚铁加热煮沸
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
