等效平衡例析
图片预览



文档简介
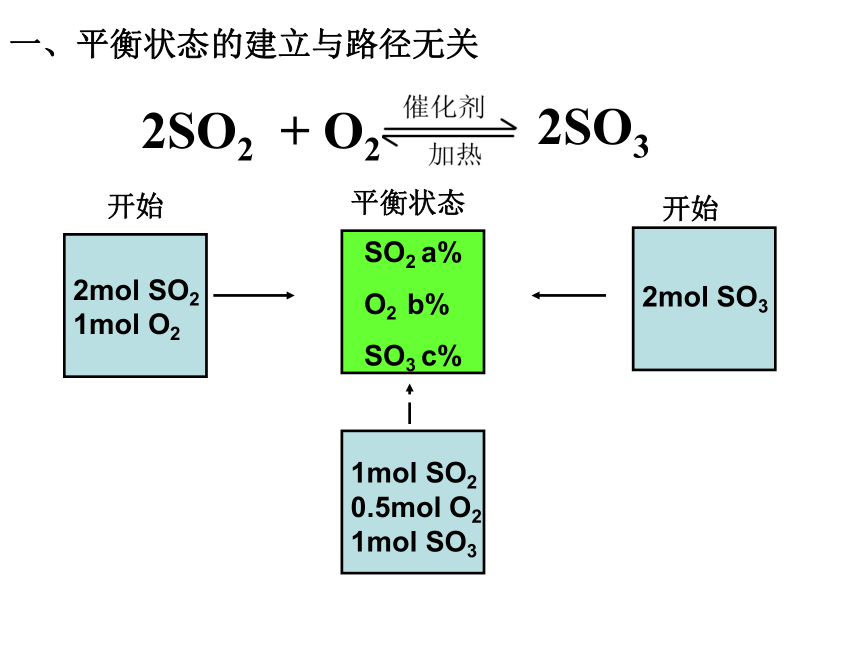
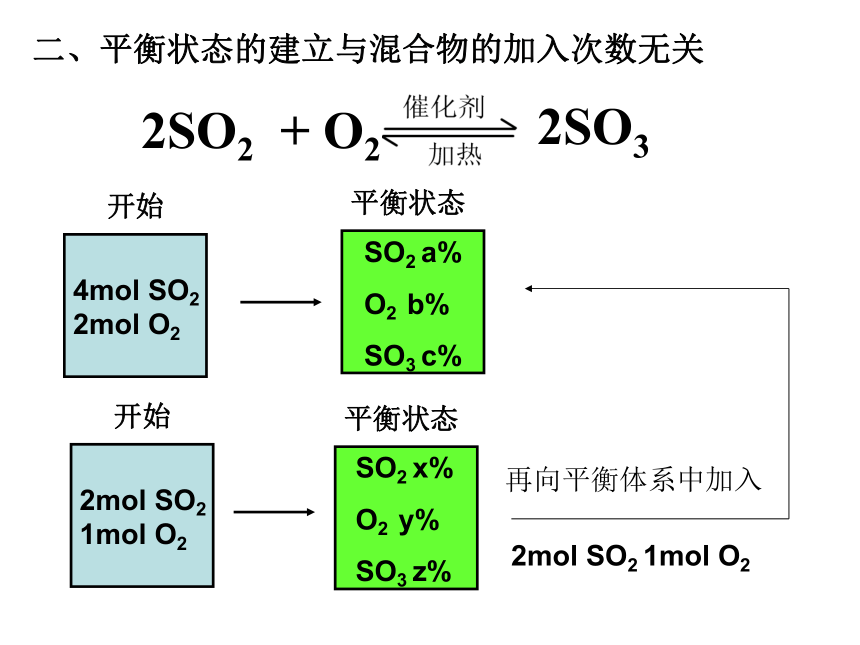
课件30张PPT。一、平衡状态的建立与路径无关二、平衡状态的建立与混合物的加入次数无关再向平衡体系中加入2mol SO2 1mol O2
SO2 x%
O2 y%
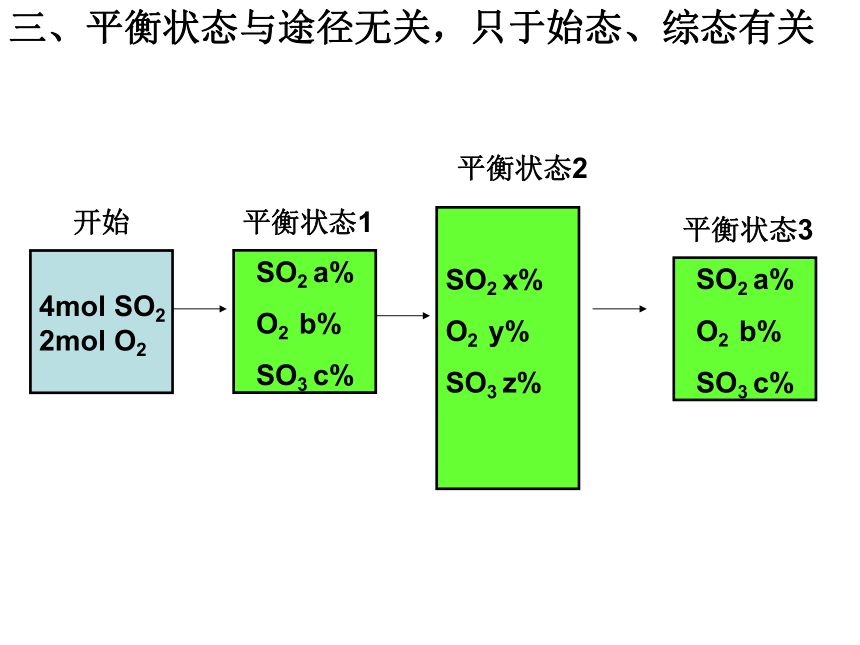
SO3 z%三、平衡状态与途径无关,只于始态、综态有关SO2 x%
O2 y%
SO3 z%
平衡状态2SO2 a%
O2 b%
SO3 c%平衡状态1SO2 a%
O2 b%
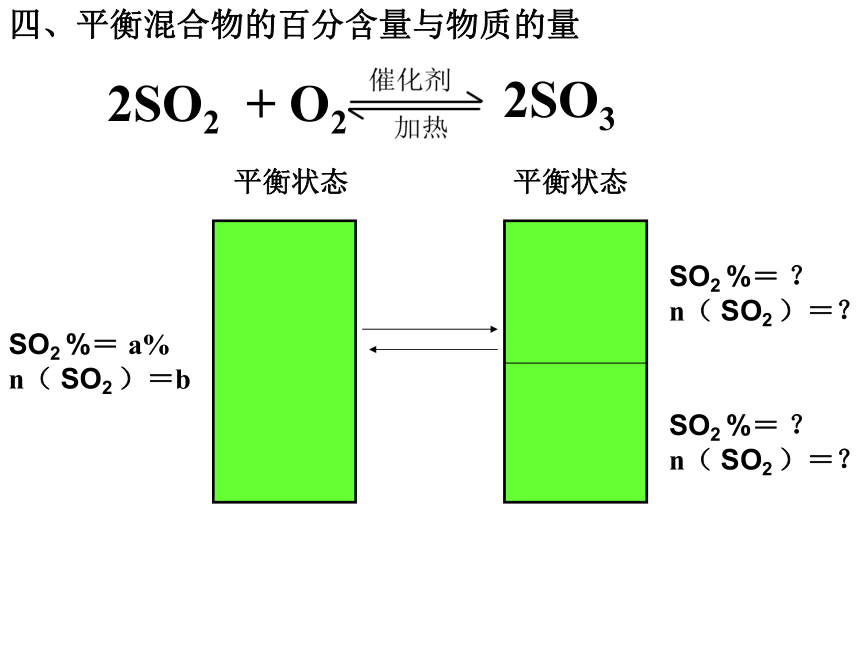
SO3 c%平衡状态3四、平衡混合物的百分含量与物质的量SO2 %= a%
n( SO2 )=bSO2 %= ?
n( SO2 )=?SO2 %= ?
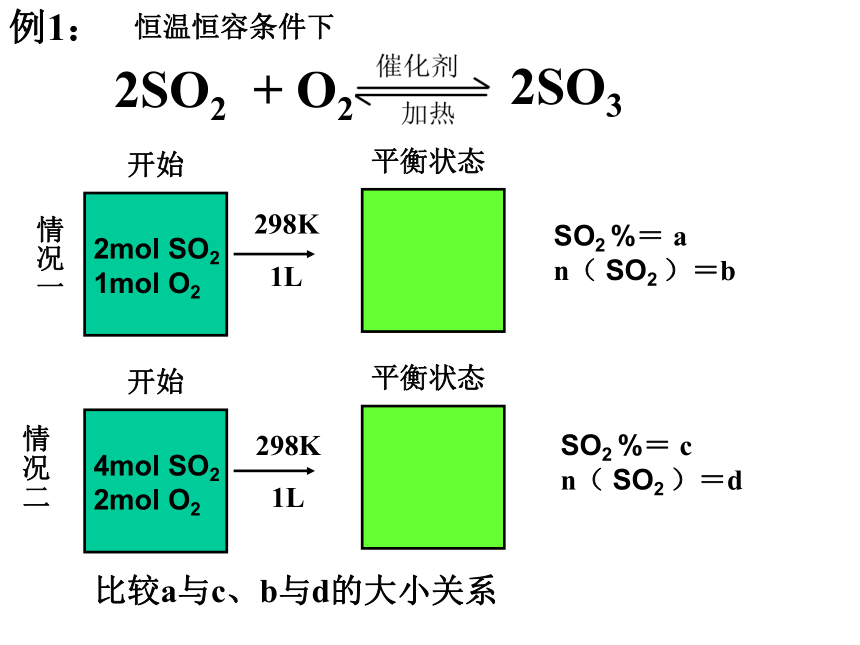
n( SO2 )=?解题模型建立例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L例2:2mol SO2 1mol O2开始平衡状态平衡状态情况一情况二恒温恒压条件下SO2 %= a
n( SO2 )=bSO2 %= c
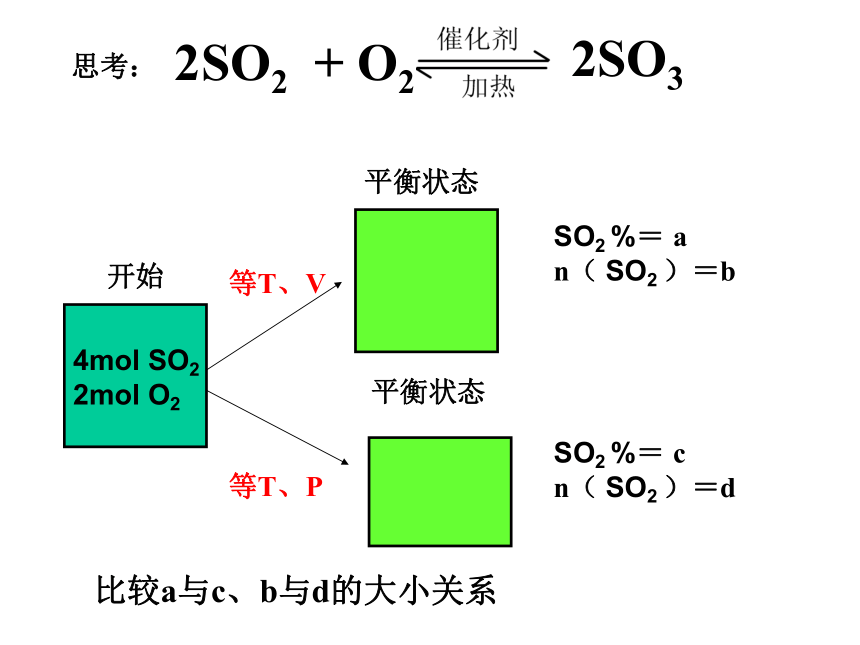
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K2L思考:等T、V等T、PSO2 %= a
n( SO2 )=bSO2 %= c
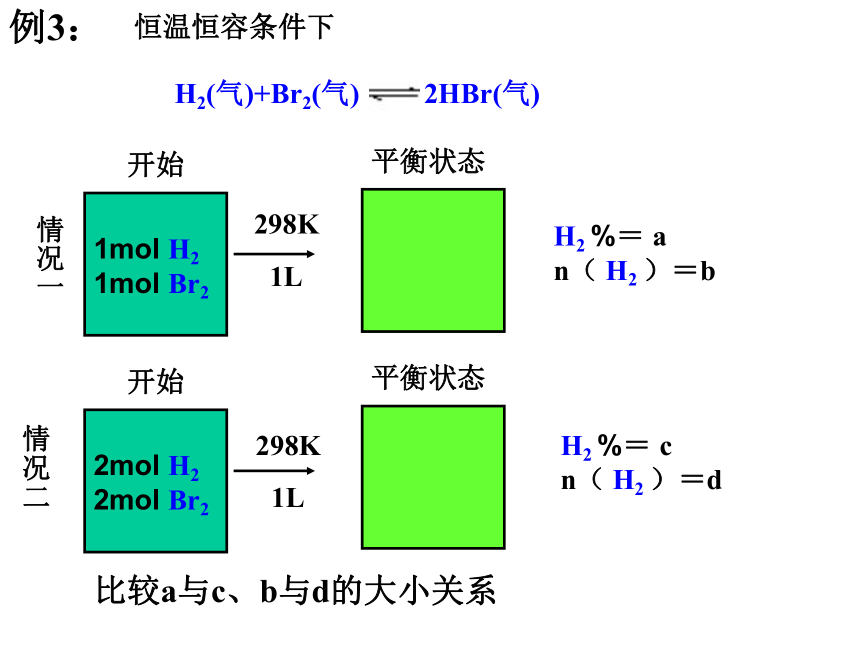
n( SO2 )=d比较a与c、b与d的大小关系例3:情况一情况二恒温恒容条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K1LH2(气)+Br2(气) 2HBr(气)例4:1mol H2 1mol Br2开始平衡状态平衡状态情况一情况二恒温恒压条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K2LH2(气)+Br2(气) 2HBr(气)思考:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
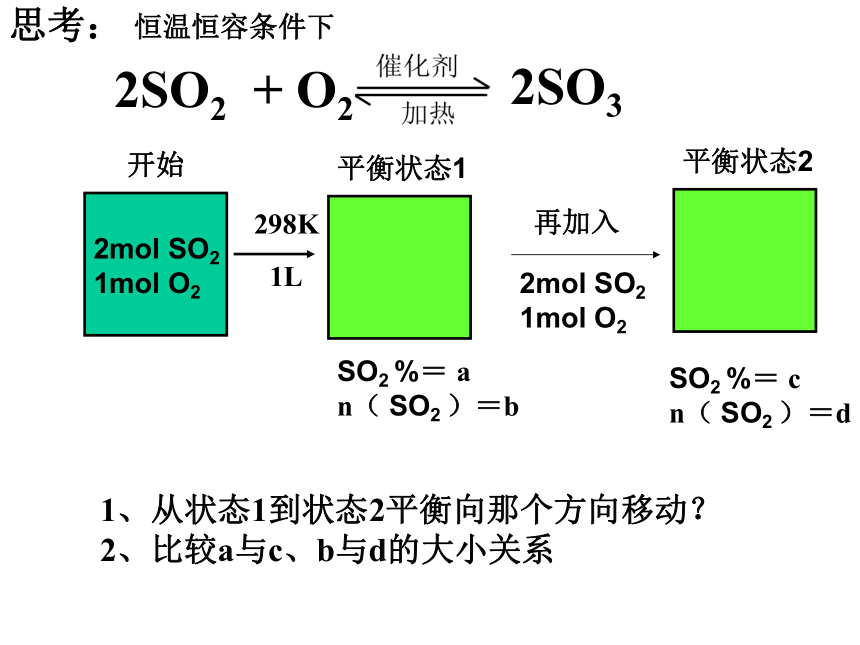
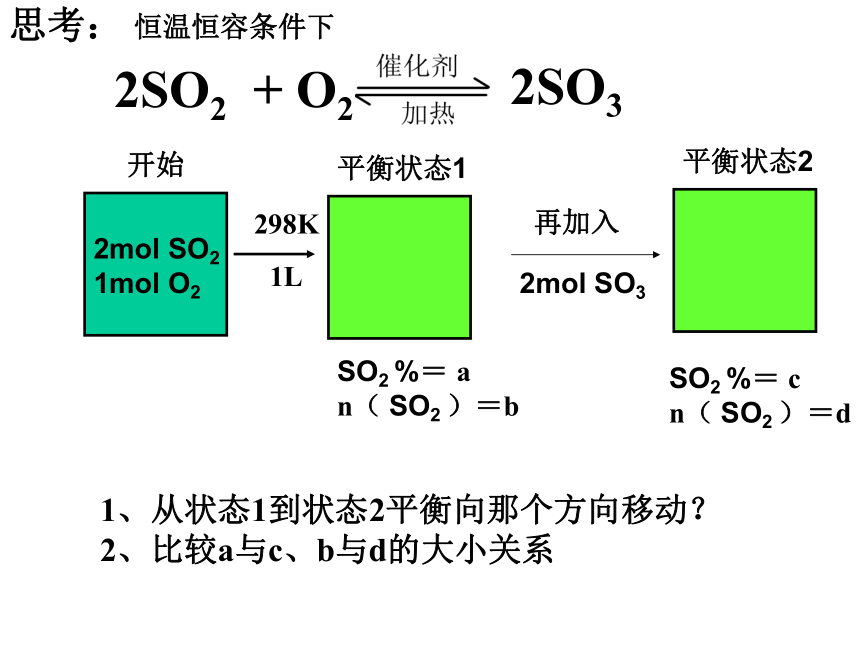
n( SO2 )=bSO2 %= c
n( SO2 )=d1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系298K1L再加入2mol SO2
1mol O2思考:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系298K1L再加入2mol SO3 思考1:压强对平衡影响的实质是什么?思考2:相对于浓度对平衡的影响这种浓度的变化有什么特点?结论:
增大压强,相当于同时等倍增大了反应物和生成物的浓度,平衡向气体物质的量减少的方向移动;
减小压强,相当于同时等倍见效了反应物和生成物的浓度,平衡向气体物质的量增大的方向移动;推广:在容积一定的容器中,按比例改变物质的量,相当于改变压强例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d298K1L再加入2mol SO2
1mol O21、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例1:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d298K1L再加入2mol SO3 1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例1:例2:情况一情况二恒温恒容条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K1LH2(气)+Br2(气) 2HBr(气)平衡状态1平衡状态2恒温恒容条件下298K1L再加入1mol H2
1mol Br2
1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例2:H2(气)+Br2(气) 2HBr(气)H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d等温等容A、x+y≠ p+q
B、x+y = p+q 按比例改变A、B或C、D的量,在判断平衡时某物质百分含量时相当于改变压强对平衡的影响。
练习1、已知700K时,N2+3H2 2NH3 +Q 现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2。则Q、Q1、Q2的大小关系是( )
A、 Q = Q1 = 1/2 Q2 B、 Q>Q1 >2Q2
C、 Q> 2Q2 > Q1 D、 Q = Q1 = Q2B3、在一固定容积的密闭容器中充入2molX和1molY,发生反应:2X(气)+Y(气) aW(气),达到平衡后,W的体积分数为Φ 。若维持容器体积和温度不变,按0.6molX、0.3molY和1.4molW为起始物质,达到平衡后,W的体积分数仍为Φ ,则a值为( )
A、1 B、 4 C、 2 D、 3BD例2:2mol SO2 1mol O2开始平衡状态平衡状态情况一情况二恒温恒压条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K2L例4:1mol H2 1mol Br2开始平衡状态平衡状态情况一情况二恒温恒压条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K2LH2(气)+Br2(气) 2HBr(气)等温等压A、x+y≠ p+qB、x+y = p+q 按比例改变A、B或C、D的量,因为压强不变,所以容器体积等比例变化,各物质的浓度并没有改变,在判断某物质百分含量时相当于平衡没有移动,但平衡时各物质的量等比例变化。
练习4、I.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x=
mol,y= mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。练习6、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气) 2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:2a00.52(n-2m)(n-m)a练习7、在一个盛有催化剂溶剂可变的密闭容器中,保持一定温度和压强进行以下反应N2+3H2 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表的“已知”项)。在相同温度、压强下,保持平衡时各
组分的体积分数不变。对下列编号(1)-(3)的状态,
填学表中的空白。 1.5a00.52(q-4m)(q-3m)a练习2、选取两个密闭容器A、B,向A、B中都加入1gSO2和O2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)反应开始之前A与B同温、同压、同容,反应开始之后,A保持恒温、恒容,B保持恒温、恒压,并都达到化学平衡状态。下列说法中正确的是 ( )
A.平衡时SO2的转化率A >B
B.平衡时的化学反应速率A < B
C.平衡时混合气体的平均摩尔质量A >B
D.可逆反应从开始到平衡,放出的热量A < BBD某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z-----------。
[2]若X=0.75,则Y---------,Z---------------。
[3]X、Y、Z应满足的一般条件是----------------。2mol2.25mol0.5mol>0=2.25mol≥0Y=3X,Z>=0X+Z/2=1 , Y+3Z/2=3练习5
SO2 x%
O2 y%
SO3 z%三、平衡状态与途径无关,只于始态、综态有关SO2 x%
O2 y%
SO3 z%
平衡状态2SO2 a%
O2 b%
SO3 c%平衡状态1SO2 a%
O2 b%
SO3 c%平衡状态3四、平衡混合物的百分含量与物质的量SO2 %= a%
n( SO2 )=bSO2 %= ?
n( SO2 )=?SO2 %= ?
n( SO2 )=?解题模型建立例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L例2:2mol SO2 1mol O2开始平衡状态平衡状态情况一情况二恒温恒压条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K2L思考:等T、V等T、PSO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系例3:情况一情况二恒温恒容条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K1LH2(气)+Br2(气) 2HBr(气)例4:1mol H2 1mol Br2开始平衡状态平衡状态情况一情况二恒温恒压条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K2LH2(气)+Br2(气) 2HBr(气)思考:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系298K1L再加入2mol SO2
1mol O2思考:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系298K1L再加入2mol SO3 思考1:压强对平衡影响的实质是什么?思考2:相对于浓度对平衡的影响这种浓度的变化有什么特点?结论:
增大压强,相当于同时等倍增大了反应物和生成物的浓度,平衡向气体物质的量减少的方向移动;
减小压强,相当于同时等倍见效了反应物和生成物的浓度,平衡向气体物质的量增大的方向移动;推广:在容积一定的容器中,按比例改变物质的量,相当于改变压强例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L例1:情况一情况二恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K1L平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d298K1L再加入2mol SO2
1mol O21、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例1:平衡状态1平衡状态2恒温恒容条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d298K1L再加入2mol SO3 1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例1:例2:情况一情况二恒温恒容条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K1LH2(气)+Br2(气) 2HBr(气)平衡状态1平衡状态2恒温恒容条件下298K1L再加入1mol H2
1mol Br2
1、从状态1到状态2平衡向那个方向移动?
2、比较a与c、b与d的大小关系例2:H2(气)+Br2(气) 2HBr(气)H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d等温等容A、x+y≠ p+q
B、x+y = p+q 按比例改变A、B或C、D的量,在判断平衡时某物质百分含量时相当于改变压强对平衡的影响。
练习1、已知700K时,N2+3H2 2NH3 +Q 现有甲、乙两个容积相等的密闭容器。保持700K条件下,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1;向密闭容器乙中通入0.5molN2和1.5molH2,达平衡时放出热量 Q2。则Q、Q1、Q2的大小关系是( )
A、 Q = Q1 = 1/2 Q2 B、 Q>Q1 >2Q2
C、 Q> 2Q2 > Q1 D、 Q = Q1 = Q2B3、在一固定容积的密闭容器中充入2molX和1molY,发生反应:2X(气)+Y(气) aW(气),达到平衡后,W的体积分数为Φ 。若维持容器体积和温度不变,按0.6molX、0.3molY和1.4molW为起始物质,达到平衡后,W的体积分数仍为Φ ,则a值为( )
A、1 B、 4 C、 2 D、 3BD例2:2mol SO2 1mol O2开始平衡状态平衡状态情况一情况二恒温恒压条件下SO2 %= a
n( SO2 )=bSO2 %= c
n( SO2 )=d比较a与c、b与d的大小关系298K1L298K2L例4:1mol H2 1mol Br2开始平衡状态平衡状态情况一情况二恒温恒压条件下H2 %= a
n( H2 )=bH2 %= c
n( H2 )=d比较a与c、b与d的大小关系298K1L298K2LH2(气)+Br2(气) 2HBr(气)等温等压A、x+y≠ p+qB、x+y = p+q 按比例改变A、B或C、D的量,因为压强不变,所以容器体积等比例变化,各物质的浓度并没有改变,在判断某物质百分含量时相当于平衡没有移动,但平衡时各物质的量等比例变化。
练习4、I.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x=
mol,y= mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。练习6、在一个固定体积的密闭容器中,保持一定温度,进行以下反应,H2(气)+Br2(气) 2HBr(气),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的百分含量不变,对下列编号(1)-(3)的状态,填写表中空白:2a00.52(n-2m)(n-m)a练习7、在一个盛有催化剂溶剂可变的密闭容器中,保持一定温度和压强进行以下反应N2+3H2 2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3(见下表的“已知”项)。在相同温度、压强下,保持平衡时各
组分的体积分数不变。对下列编号(1)-(3)的状态,
填学表中的空白。 1.5a00.52(q-4m)(q-3m)a练习2、选取两个密闭容器A、B,向A、B中都加入1gSO2和O2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)反应开始之前A与B同温、同压、同容,反应开始之后,A保持恒温、恒容,B保持恒温、恒压,并都达到化学平衡状态。下列说法中正确的是 ( )
A.平衡时SO2的转化率A >B
B.平衡时的化学反应速率A < B
C.平衡时混合气体的平均摩尔质量A >B
D.可逆反应从开始到平衡,放出的热量A < BBD某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z-----------。
[2]若X=0.75,则Y---------,Z---------------。
[3]X、Y、Z应满足的一般条件是----------------。2mol2.25mol0.5mol>0=2.25mol≥0Y=3X,Z>=0X+Z/2=1 , Y+3Z/2=3练习5
