第一节 化学反应与能量变化
文档属性
| 名称 | 第一节 化学反应与能量变化 |  | |
| 格式 | rar | ||
| 文件大小 | 183.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-22 09:08:00 | ||
图片预览




文档简介
课件10张PPT。第一节 化学反应与能量的变化 化学反应过程中 的能量,叫反应热,它等于反应前后体系的 。用符号 表示。其单位常用 。许多化学反应的反应热可以直接测量。
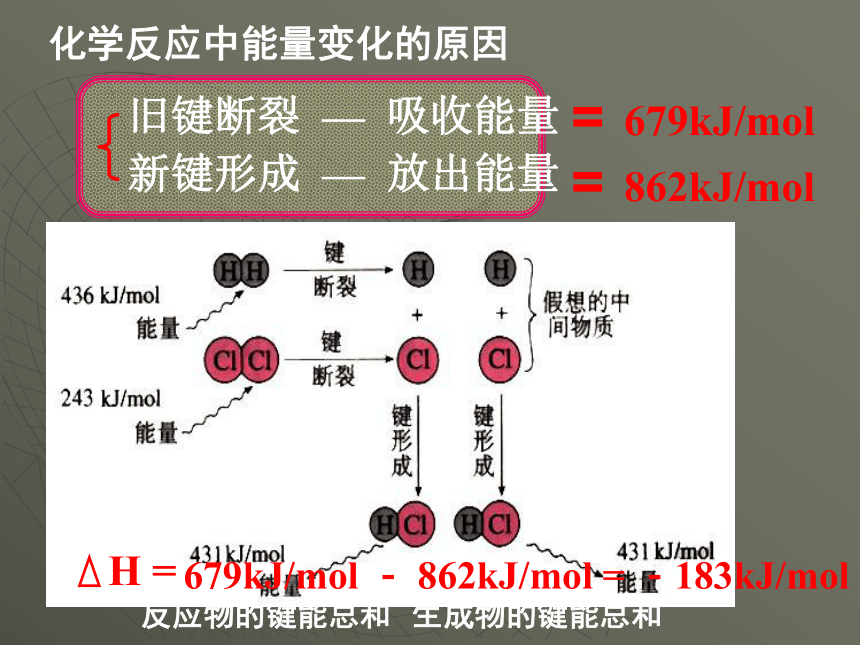
反应热又叫焓变。焓变 反应热释放或吸收能量变化HKJ/mol放热反应与吸热反应放热反应吸热反应H0H0化学反应中能量变化的原因 化学反应的本质是旧键断裂,新建生成。任何化学反应都有反应热,这是由于在化学反应过程中,当反应热分子间的化学键断裂时,需要克服原子间的作用力,这需要洗手能量;当原子重新结合称生成物分子时,即化学键生成时,又要释放能量。化学反应中能量变化的原因旧键断裂 — 吸收能量新键形成 — 放出能量==679kJ/mol862kJ/mol679kJ/mol - 862kJ/mol = -183kJ/mol反应物的键能总和生成物的键能总和常见放热反应活泼金属与水或酸的反应
酸碱中和反应
燃烧反应
多数化合反应常见吸热反应多数分解反应
氯化铵和8水氢氧化钡的反应
水煤气的制作
二氧化碳和碳化合生成一氧化碳焓变与键能的关系(微观)ΔH = 反应物的键能总和生成物的键能总和–例 1:1mol C与 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。+131.5例 2:拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 -92 kJ/mol-30.67 kJ/mol相当于 1/3 mol N2焓变与物质能量的关系(宏观)ΔH = E 生成物E 反应物–希望下课后看书做练习册。
再见!
反应热又叫焓变。焓变 反应热释放或吸收能量变化HKJ/mol放热反应与吸热反应放热反应吸热反应H0H0化学反应中能量变化的原因 化学反应的本质是旧键断裂,新建生成。任何化学反应都有反应热,这是由于在化学反应过程中,当反应热分子间的化学键断裂时,需要克服原子间的作用力,这需要洗手能量;当原子重新结合称生成物分子时,即化学键生成时,又要释放能量。化学反应中能量变化的原因旧键断裂 — 吸收能量新键形成 — 放出能量==679kJ/mol862kJ/mol679kJ/mol - 862kJ/mol = -183kJ/mol反应物的键能总和生成物的键能总和常见放热反应活泼金属与水或酸的反应
酸碱中和反应
燃烧反应
多数化合反应常见吸热反应多数分解反应
氯化铵和8水氢氧化钡的反应
水煤气的制作
二氧化碳和碳化合生成一氧化碳焓变与键能的关系(微观)ΔH = 反应物的键能总和生成物的键能总和–例 1:1mol C与 1mol H2O(g) 反应生成 lmol CO(g) 和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H = kJ/mol。+131.5例 2:拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,
则1mol N2生成NH3的反应热为 ,
则1mol H2生成NH3的反应热为 。 -92 kJ/mol-30.67 kJ/mol相当于 1/3 mol N2焓变与物质能量的关系(宏观)ΔH = E 生成物E 反应物–希望下课后看书做练习册。
再见!
