化学必修1专题二复习
图片预览




文档简介
课件12张PPT。专题 2
复习化学① [必修]从海水中获得的化学物质 单元一: 氯、溴、碘及其化合物 单元二: 钠、镁及其化合物 单元一: 氯、溴、碘及其化合物 应知1:工业采用_____________的方法制取氯气.
实验室采用________和_______加热反应的方法
制取氯气.应会: 会写制取氯气的化学方程式
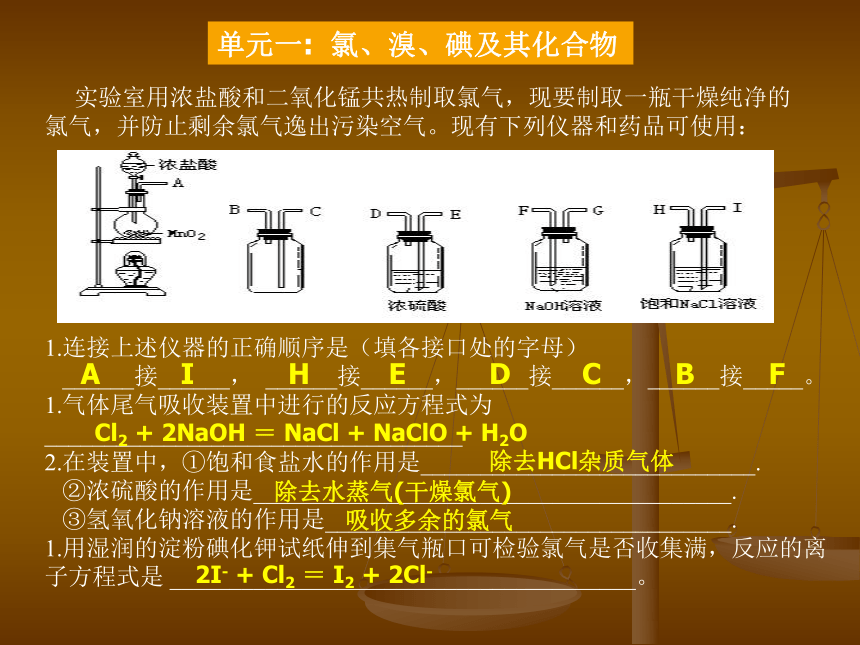
会写吸收氯气的化学方程式 电解饱和食盐水 二氧化锰 浓盐酸 练习1: 写出工业上电解饱和食盐水制取氯气的化学方程式: 写出实验室制取氯气的化学方程式: 写出实验室用NaOH溶液吸收多余的氯气的方程式: Cl2 + 2NaOH = NaCl + NaClO + H2O 实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可使用: 连接上述仪器的正确顺序是(填各接口处的字母)
______接______, ______接______,______接______,______接_____。
气体尾气吸收装置中进行的反应方程式为___________________________________
在装置中,①饱和食盐水的作用是____________________________.
②浓硫酸的作用是________________________________________.
③氢氧化钠溶液的作用是__________________________________.
用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式是 _______________________________________。单元一: 氯、溴、碘及其化合物 A I H E D C B F Cl2 + 2NaOH = NaCl + NaClO + H2O 除去HCl杂质气体 除去水蒸气(干燥氯气) 吸收多余的氯气 2I- + Cl2 = I2 + 2Cl- 单元一: 氯、溴、碘及其化合物 应知2: 氢气、铁丝在氯气中燃烧的现象
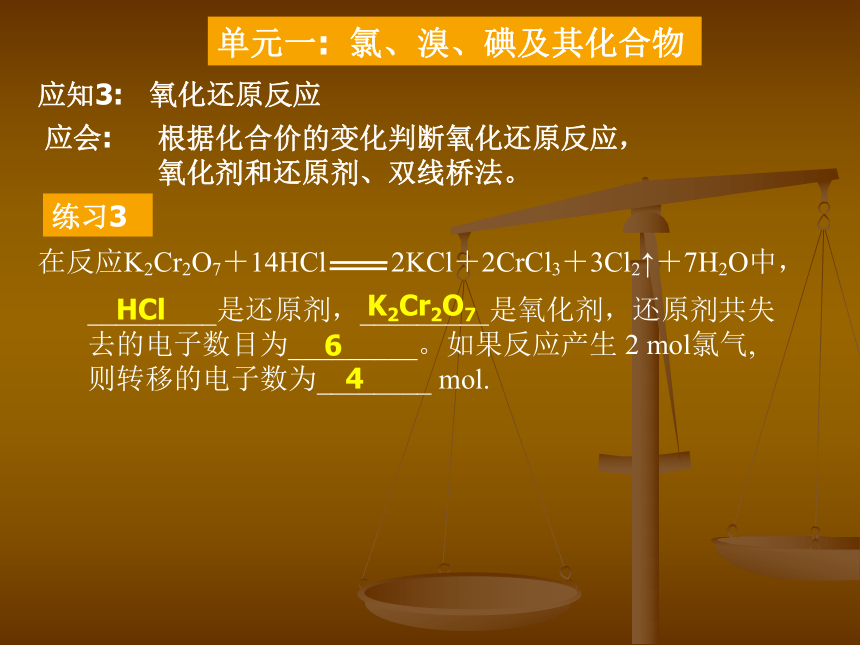
氯气可以制取漂白粉应会: 会写氯气参加的反应的化学方程式 练习2: 写出铁在氯气中反应的化学方程式: 写出铁和盐酸反应的化学方程式: Fe + 2HCl =FeCl2 + H2↑写出氯气制取漂白粉的方程式: 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 写出漂白粉在空气中表现漂白性或失效的方程式: Ca(ClO)2 + H2O + CO2 = CaCO3 + 2HClO 单元一: 氯、溴、碘及其化合物 应知3: 氧化还原反应 应会: 根据化合价的变化判断氧化还原反应,
氧化剂和还原剂、双线桥法。练习3 HCl K2Cr2O7 6 4 单元一: 氯、溴、碘及其化合物 应知 应会 1. 氯气的制取方法 会写制取氯气的反应方程式 氢气、铁丝在氯气中
燃烧的现象
氯气可以制取漂白粉会写氯气参加的反应的
化学方程式3. 氧化还原反应 根据化合价的变化判断
氧化还原反应,
氧化剂和还原剂、双线桥法。返回主页 单元二: 钠、镁及其化合物 应知1: 钠和镁的工业制法 (活泼金属用非水电解法) 应会: 制取钠和镁的化学方程式 练习1: MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2 单元二: 钠、镁及其化合物 应知2: 钠、镁及其化合物的性质 应会:钠和镁的单质参加反应的化学方程式
碳酸钠和碳酸氢钠参加反应的方程式练习2:
⑵写出①②③④的化学方程式。
① ____________________________________
② ____________________________________
③ ____________________________________
④ ____________________________________ NaNaOHNa2CO3NaCl2Na + 2H2O = 2NaOH + H2↑2NaOH + CO2 = Na2CO3 + H2ONa2CO3 + 2HCl = 2NaCl + H2O + CO2↑单元二: 钠、镁及其化合物 应知3: 溶液中发生的反应一般是离子反应. 应会: 会写离子反应方程式. (要点: 什么物质不能拆?)写出下列反应的离子方程式:
石灰石溶于稀硝酸__________________________
电解氯化钠的水溶液 ________________________
氧化铜溶于氢溴酸 _________________________
氯气通入水中 _________________________
氯气通入氢氧化钠溶液中______________________ 练习3:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑2Cl- + 2H2O=2OH- + H2↑+ Cl2↑CuO + 2H+ = Cu2+ + H2OCl2 + H2O = H+ + Cl- + HClO Cl2 + 2OH- = Cl- +ClO- + H2O不可以改为离子的物质: ①难溶物(如BaSO4); ②难电离物(弱 酸、弱 碱等弱电解质, H2O); ③气体(CO2、SO2); ④单质(Fe、H2); ⑤氧化物(Na2O、CuO 等)单元二: 钠、镁及其化合物 应知 应会 1: 钠和镁的工业制法制取钠和镁的化学方程式2: 钠、镁及其化合物的性质 钠和镁的单质参加反应的
化学方程式
碳酸钠和碳酸氢钠参加反应的
方程式3: 溶液中发生的反应
一般是离子反应.会写离子反应方程式. 返回主页作业: 完成课后练习讲义
复习化学① [必修]从海水中获得的化学物质 单元一: 氯、溴、碘及其化合物 单元二: 钠、镁及其化合物 单元一: 氯、溴、碘及其化合物 应知1:工业采用_____________的方法制取氯气.
实验室采用________和_______加热反应的方法
制取氯气.应会: 会写制取氯气的化学方程式
会写吸收氯气的化学方程式 电解饱和食盐水 二氧化锰 浓盐酸 练习1: 写出工业上电解饱和食盐水制取氯气的化学方程式: 写出实验室制取氯气的化学方程式: 写出实验室用NaOH溶液吸收多余的氯气的方程式: Cl2 + 2NaOH = NaCl + NaClO + H2O 实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可使用: 连接上述仪器的正确顺序是(填各接口处的字母)
______接______, ______接______,______接______,______接_____。
气体尾气吸收装置中进行的反应方程式为___________________________________
在装置中,①饱和食盐水的作用是____________________________.
②浓硫酸的作用是________________________________________.
③氢氧化钠溶液的作用是__________________________________.
用湿润的淀粉碘化钾试纸伸到集气瓶口可检验氯气是否收集满,反应的离子方程式是 _______________________________________。单元一: 氯、溴、碘及其化合物 A I H E D C B F Cl2 + 2NaOH = NaCl + NaClO + H2O 除去HCl杂质气体 除去水蒸气(干燥氯气) 吸收多余的氯气 2I- + Cl2 = I2 + 2Cl- 单元一: 氯、溴、碘及其化合物 应知2: 氢气、铁丝在氯气中燃烧的现象
氯气可以制取漂白粉应会: 会写氯气参加的反应的化学方程式 练习2: 写出铁在氯气中反应的化学方程式: 写出铁和盐酸反应的化学方程式: Fe + 2HCl =FeCl2 + H2↑写出氯气制取漂白粉的方程式: 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 写出漂白粉在空气中表现漂白性或失效的方程式: Ca(ClO)2 + H2O + CO2 = CaCO3 + 2HClO 单元一: 氯、溴、碘及其化合物 应知3: 氧化还原反应 应会: 根据化合价的变化判断氧化还原反应,
氧化剂和还原剂、双线桥法。练习3 HCl K2Cr2O7 6 4 单元一: 氯、溴、碘及其化合物 应知 应会 1. 氯气的制取方法 会写制取氯气的反应方程式 氢气、铁丝在氯气中
燃烧的现象
氯气可以制取漂白粉会写氯气参加的反应的
化学方程式3. 氧化还原反应 根据化合价的变化判断
氧化还原反应,
氧化剂和还原剂、双线桥法。返回主页 单元二: 钠、镁及其化合物 应知1: 钠和镁的工业制法 (活泼金属用非水电解法) 应会: 制取钠和镁的化学方程式 练习1: MgCl2 + Ca(OH)2 = Mg(OH)2↓+ CaCl2 单元二: 钠、镁及其化合物 应知2: 钠、镁及其化合物的性质 应会:钠和镁的单质参加反应的化学方程式
碳酸钠和碳酸氢钠参加反应的方程式练习2:
⑵写出①②③④的化学方程式。
① ____________________________________
② ____________________________________
③ ____________________________________
④ ____________________________________ NaNaOHNa2CO3NaCl2Na + 2H2O = 2NaOH + H2↑2NaOH + CO2 = Na2CO3 + H2ONa2CO3 + 2HCl = 2NaCl + H2O + CO2↑单元二: 钠、镁及其化合物 应知3: 溶液中发生的反应一般是离子反应. 应会: 会写离子反应方程式. (要点: 什么物质不能拆?)写出下列反应的离子方程式:
石灰石溶于稀硝酸__________________________
电解氯化钠的水溶液 ________________________
氧化铜溶于氢溴酸 _________________________
氯气通入水中 _________________________
氯气通入氢氧化钠溶液中______________________ 练习3:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑2Cl- + 2H2O=2OH- + H2↑+ Cl2↑CuO + 2H+ = Cu2+ + H2OCl2 + H2O = H+ + Cl- + HClO Cl2 + 2OH- = Cl- +ClO- + H2O不可以改为离子的物质: ①难溶物(如BaSO4); ②难电离物(弱 酸、弱 碱等弱电解质, H2O); ③气体(CO2、SO2); ④单质(Fe、H2); ⑤氧化物(Na2O、CuO 等)单元二: 钠、镁及其化合物 应知 应会 1: 钠和镁的工业制法制取钠和镁的化学方程式2: 钠、镁及其化合物的性质 钠和镁的单质参加反应的
化学方程式
碳酸钠和碳酸氢钠参加反应的
方程式3: 溶液中发生的反应
一般是离子反应.会写离子反应方程式. 返回主页作业: 完成课后练习讲义
