第二节 几种重要的金属化合物.
文档属性
| 名称 | 第二节 几种重要的金属化合物. |

|
|
| 格式 | rar | ||
| 文件大小 | 212.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-01-30 00:00:00 | ||
图片预览








文档简介
课件27张PPT。第二节
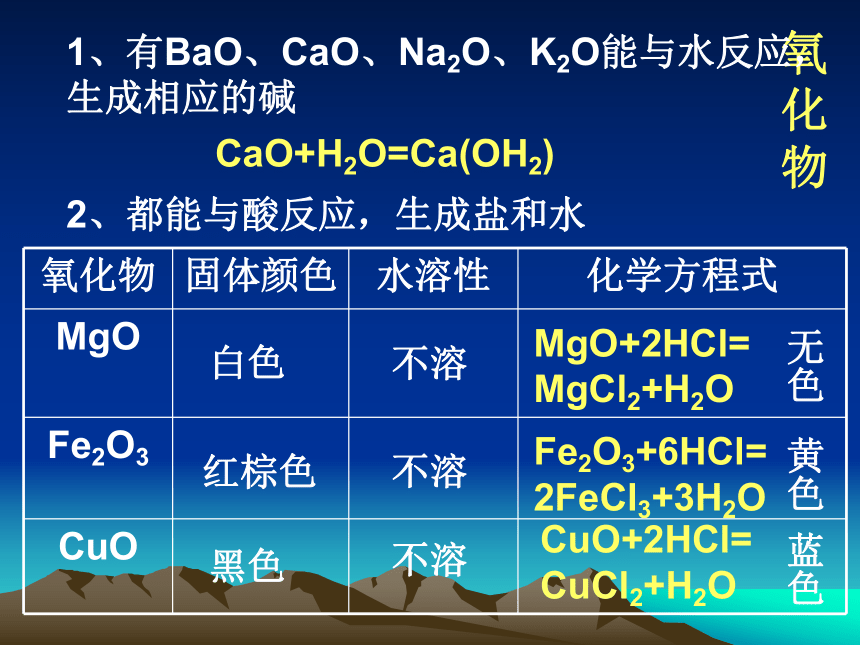
几种重要的金属化合物氧化物1、有BaO、CaO、Na2O、K2O能与水反应,生成相应的碱CaO+H2O=Ca(OH2)2、都能与酸反应,生成盐和水白色不溶红棕色不溶黑色不溶MgO+2HCl=MgCl2+H2OFe2O3+6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O无色黄色蓝色3、Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+H2O偏铝酸钠两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物几种氧化物的重要用途4、几种氧化物的重要用途Fe2O3红色油漆和涂料Al2O3耐火材料CuO制造铜盐的原料Cu2O红色颜料练:下列有关氧化物的叙述中,正确的是( )
A、酸性氧化物都可以与强碱溶液反应
B、与水反应生成酸的氧化物都是酸性氧化物
C、金属氧化物都是碱性氧化物或两性氧化物
D、不能与酸反应的氧化物一定能与碱反应A4、氢氧化铝Al(OH)3实验室制法:铝盐溶液与氨水反应来制取Al2(SO4)3+6NH3.H2O=2Al(OH)3?+3(NH4)2SO4白色胶状沉淀,几乎不溶于水,但能凝聚水中悬浮物,并能吸附色素Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O化学性质:两性氢氧化物物理性质:加热时,氢氧化铝分解为氧化铝和水结论:所有难溶性碱如Fe(OH)3、Cu(OH)2等都可以在加热的条件下,分解为氧化物和水氢氧化铝的用途:医用胃酸中和剂Al(OH)3+3HCl==AlCl3+3H2O练习:有NaCl、FeCl3、FeCl2、 MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A、盐酸 B、烧碱溶液 C、氨水 D、KSCN溶液B铝盐和强碱溶液的反应计算反应关系
(1)Al3++3OH-=Al(OH)3? (2)Al(OH)3+OH-=AlO2-+2H2O(3)Al3++4OH-=AlO2-+2H2O当n(Al3+)/n(OH-)≥1/3时,m[Al(OH)3]=78g/mol.n(OH-)/3当n(Al3+)/n(OH-)≤1/4时,m[Al(OH)3]=0当1/4预习下一个内容:有关铁的氢氧化物与三价铁的氧化性的知识及Na2CO3与NaHCO3(结合第二教材智能点3、4)1、铁的氢氧化物Fe2++2OH-=Fe(OH)2?Fe3++3OH-=Fe(OH)3?白色絮状沉淀红褐色沉淀在空气中迅速被O2氧化4Fe(OH)2+O2+2H2O=4Fe(OH)3Fe(OH)2+2H+=Fe2++2H2OFe(OH)3+3H+=Fe3++3H2O三价铁的氧化性(1)Fe3+的检验溶液变红色溶液无明显变化Fe3+与SCN-反应生成红色物质Fe2+与SCN-无反应此性质可用来检验溶液中Fe3+的存在(2)Fe2+离子的氧化性红色?浅绿色红色Fe3+有氧化性2Fe3++Fe=3Fe2+Fe2+有还原性2Fe2++Cl2=2Fe3++2Cl-(3)Fe2+及Fe3+的相互转化和检验Fe2+Fe3+氯水、硝酸等强氧化剂Fe、Cu等还原剂A练习与作业完成第二教材相关知识点
预习下一个内容:有关碳酸钠和碳酸氢钠的知识碳酸钠和碳酸氢钠白色粉末,加水结块变成晶体;放热细小白色粉末,加水部分溶解,感受不到热量变化振荡时间长可溶解固体量减小溶液变红(较深)溶液变微红色溶液Na2CO3的碱性比NaHCO3的强纯碱、苏打小苏打白色粉末白色晶体稳定CO32-+2H+=H2O+CO2?HCO3-+H+=CO2?+H2OCa2++CO32-=CaCO3?Ca2++OH-(足量)+HCO3-=CaCO3?+H2OCa2++2OH-(不足)+2HCO3-=CaCO3?+CO32-+2H2O练习:有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有4位同学为鉴别它们采用了以下不同方法,其中可行的是( )A、分别配成溶液,再加入澄清石灰水
B、加别配成溶液,再加入NaOH溶液
C、分别加热,再检验是否有使石灰水变浑浊的气体产生
D、分别配成溶液,再进行焰色反应C铝盐和铁盐的净水作用
定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊颜色的反应。 注意: A.不是所有金属元素都有焰色反应
B.焰色反应是金属元素的性质
C.焰色反应是物理变化焰 色 反 应1、烧2、蘸3、烧4、洗实验仪器:铂丝(无锈铁丝)、酒精灯
药品:稀盐酸、待测溶液把铂丝放在酒精灯上灼烧(直到与原来的火焰颜色相同为止)用铂丝蘸取待测溶液放在酒精灯上灼烧用稀盐酸洗净铂丝步骤讨论观察钾的焰色反应时,为什么要透过蓝色的钴玻璃? 答: 可以滤去黄色的光,避免碳酸钾 等中所含的杂质钠所造成的干扰。讨论 一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗? 答:不能,能得出其中含有钠离子,但不能得出是钠盐,有可能是氢氧化钠。
2、 焰色反应是指( )
A.物质的化学变化???????
B.可燃物在燃烧时,其火焰的颜色
C.所有元素被灼烧时,火焰呈现的颜色 D.部分金属或它们的化合物在灼烧时火焰呈现的特殊颜色D作业与预习完成课本与第二教材的相关练习
预习第三节的内容,举出一些你所熟悉的金属的应用的例子.
*****复习本章的知识点
几种重要的金属化合物氧化物1、有BaO、CaO、Na2O、K2O能与水反应,生成相应的碱CaO+H2O=Ca(OH2)2、都能与酸反应,生成盐和水白色不溶红棕色不溶黑色不溶MgO+2HCl=MgCl2+H2OFe2O3+6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O无色黄色蓝色3、Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+H2O偏铝酸钠两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物几种氧化物的重要用途4、几种氧化物的重要用途Fe2O3红色油漆和涂料Al2O3耐火材料CuO制造铜盐的原料Cu2O红色颜料练:下列有关氧化物的叙述中,正确的是( )
A、酸性氧化物都可以与强碱溶液反应
B、与水反应生成酸的氧化物都是酸性氧化物
C、金属氧化物都是碱性氧化物或两性氧化物
D、不能与酸反应的氧化物一定能与碱反应A4、氢氧化铝Al(OH)3实验室制法:铝盐溶液与氨水反应来制取Al2(SO4)3+6NH3.H2O=2Al(OH)3?+3(NH4)2SO4白色胶状沉淀,几乎不溶于水,但能凝聚水中悬浮物,并能吸附色素Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O化学性质:两性氢氧化物物理性质:加热时,氢氧化铝分解为氧化铝和水结论:所有难溶性碱如Fe(OH)3、Cu(OH)2等都可以在加热的条件下,分解为氧化物和水氢氧化铝的用途:医用胃酸中和剂Al(OH)3+3HCl==AlCl3+3H2O练习:有NaCl、FeCl3、FeCl2、 MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A、盐酸 B、烧碱溶液 C、氨水 D、KSCN溶液B铝盐和强碱溶液的反应计算反应关系
(1)Al3++3OH-=Al(OH)3? (2)Al(OH)3+OH-=AlO2-+2H2O(3)Al3++4OH-=AlO2-+2H2O当n(Al3+)/n(OH-)≥1/3时,m[Al(OH)3]=78g/mol.n(OH-)/3当n(Al3+)/n(OH-)≤1/4时,m[Al(OH)3]=0当1/4
预习下一个内容:有关碳酸钠和碳酸氢钠的知识碳酸钠和碳酸氢钠白色粉末,加水结块变成晶体;放热细小白色粉末,加水部分溶解,感受不到热量变化振荡时间长可溶解固体量减小溶液变红(较深)溶液变微红色溶液Na2CO3的碱性比NaHCO3的强纯碱、苏打小苏打白色粉末白色晶体稳定CO32-+2H+=H2O+CO2?HCO3-+H+=CO2?+H2OCa2++CO32-=CaCO3?Ca2++OH-(足量)+HCO3-=CaCO3?+H2OCa2++2OH-(不足)+2HCO3-=CaCO3?+CO32-+2H2O练习:有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有4位同学为鉴别它们采用了以下不同方法,其中可行的是( )A、分别配成溶液,再加入澄清石灰水
B、加别配成溶液,再加入NaOH溶液
C、分别加热,再检验是否有使石灰水变浑浊的气体产生
D、分别配成溶液,再进行焰色反应C铝盐和铁盐的净水作用
定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊颜色的反应。 注意: A.不是所有金属元素都有焰色反应
B.焰色反应是金属元素的性质
C.焰色反应是物理变化焰 色 反 应1、烧2、蘸3、烧4、洗实验仪器:铂丝(无锈铁丝)、酒精灯
药品:稀盐酸、待测溶液把铂丝放在酒精灯上灼烧(直到与原来的火焰颜色相同为止)用铂丝蘸取待测溶液放在酒精灯上灼烧用稀盐酸洗净铂丝步骤讨论观察钾的焰色反应时,为什么要透过蓝色的钴玻璃? 答: 可以滤去黄色的光,避免碳酸钾 等中所含的杂质钠所造成的干扰。讨论 一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗? 答:不能,能得出其中含有钠离子,但不能得出是钠盐,有可能是氢氧化钠。
2、 焰色反应是指( )
A.物质的化学变化???????
B.可燃物在燃烧时,其火焰的颜色
C.所有元素被灼烧时,火焰呈现的颜色 D.部分金属或它们的化合物在灼烧时火焰呈现的特殊颜色D作业与预习完成课本与第二教材的相关练习
预习第三节的内容,举出一些你所熟悉的金属的应用的例子.
*****复习本章的知识点
