金属的化学性质
图片预览



文档简介
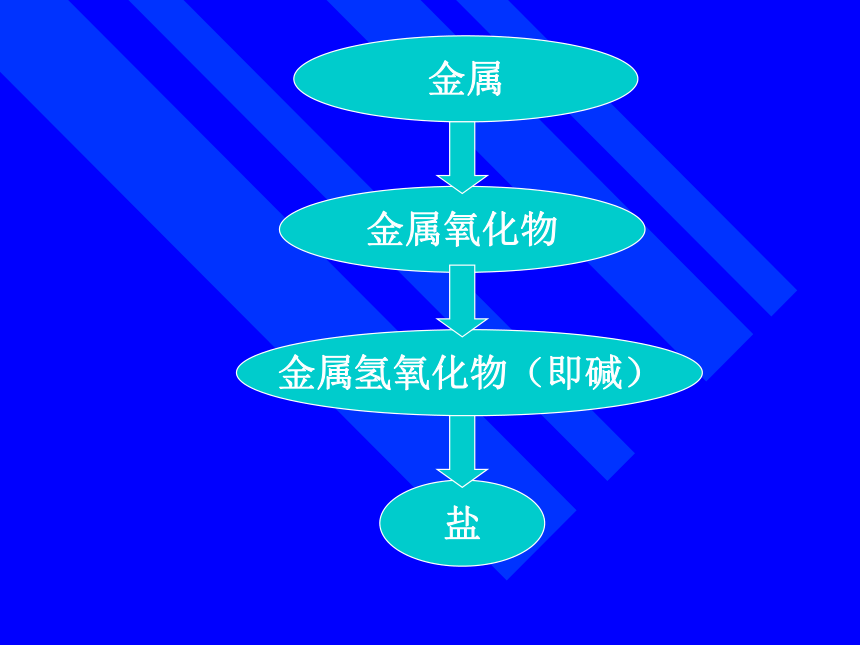
课件10张PPT。金属金属氧化物金属氢氧化物(即碱)盐第一节
金属的化学性质绝大多数金属元素是以化合态存在的,很少以游离态存在。为什么呢? 观察P38的图片,你能说说金属能发生哪些反应吗?化学反应:
1)金属与氧气反应;
2)金属与酸反应;
3)金属与盐溶液反应4)金属与水反应;
5)某些金属与碱反应;实验3-1 :(分组)取一小块金属钠,用滤纸擦干表面的煤油后,用刀切去一端的外皮(把一块钠分成两份,一份为原来体积的1/3,另一份为2/3),观察钠的表面光泽和颜色。注意:新切开的钠的表面在空气中是否会发生变化?一.金属与氧气反应注意:取用一小块钠后剩余的钠必须放回原瓶!!!
滤纸吸干煤油—镊子夹取--小刀在玻璃片或表面皿上切割。金属钠的切割方法:物理性质:取出的金属表面有一灰黄色层,钠具有银白色金属光泽,质软。
实验现象:切开后的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。(久置后表面还会形成溶液,最后变成白色粉末。为什么?)
结论:钠的氧化速度远比镁铝要快,金属性要强。4Na+O2=2Na2O实验3-2 现象:钠先熔化后燃烧,燃烧时火焰呈黄色,最后留下的固体呈淡黄色。
结论:钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同。
2Na+O2===Na2O2 △思考:过氧化钠会有什么性质呢?
回忆:H2O2的性质过氧化钠的性质演示实验:“滴水生火”、“吹气生火”
思考与交流:
1、为何棉花能燃烧起来?
2、钠起火能否用CO2灭火器灭火?
2Na2O2+2H2O=4NaOH+O2 ↑
2Na2O2+2CO2=2Na2CO3+O2
练习:运用氧化还原反应的知识分析以上两个反应。(放热、生成O2)演示实验1:P40 科学探究1 现象:铝箔熔化并失去光泽,熔化的铝并不滴落,好像有一层膜兜着。
原因:Al2O3的熔点(2050℃)远高于铝的熔点,包在铝的外面,所以熔化的液态铝不会低落。演示实验2:P40 科学探究2 现象:熔化的铝仍不滴落。
原因:铝很活泼,在空气中很快又生成一层新的氧化膜。演示实验3:用滤纸包住铝粉,引燃后放入纯氧气中。现象:铝剧烈燃烧,发出耀眼的白光。小结金属与氧气反应:在空气中的氧化速度侧面的说明了金属活泼性的顺序。学习了钠和铝分别跟氧气反应。
1)金属与氧气反应;
2)金属与酸反应;
3)金属与盐溶液反应4)金属与水反应;
5)某些金属与碱反应;实验3-1 :(分组)取一小块金属钠,用滤纸擦干表面的煤油后,用刀切去一端的外皮(把一块钠分成两份,一份为原来体积的1/3,另一份为2/3),观察钠的表面光泽和颜色。注意:新切开的钠的表面在空气中是否会发生变化?一.金属与氧气反应注意:取用一小块钠后剩余的钠必须放回原瓶!!!
滤纸吸干煤油—镊子夹取--小刀在玻璃片或表面皿上切割。金属钠的切割方法:物理性质:取出的金属表面有一灰黄色层,钠具有银白色金属光泽,质软。
实验现象:切开后的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。(久置后表面还会形成溶液,最后变成白色粉末。为什么?)
结论:钠的氧化速度远比镁铝要快,金属性要强。4Na+O2=2Na2O实验3-2 现象:钠先熔化后燃烧,燃烧时火焰呈黄色,最后留下的固体呈淡黄色。
结论:钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同。
2Na+O2===Na2O2 △思考:过氧化钠会有什么性质呢?
回忆:H2O2的性质过氧化钠的性质演示实验:“滴水生火”、“吹气生火”
思考与交流:
1、为何棉花能燃烧起来?
2、钠起火能否用CO2灭火器灭火?
2Na2O2+2H2O=4NaOH+O2 ↑
2Na2O2+2CO2=2Na2CO3+O2
练习:运用氧化还原反应的知识分析以上两个反应。(放热、生成O2)演示实验1:P40 科学探究1 现象:铝箔熔化并失去光泽,熔化的铝并不滴落,好像有一层膜兜着。
原因:Al2O3的熔点(2050℃)远高于铝的熔点,包在铝的外面,所以熔化的液态铝不会低落。演示实验2:P40 科学探究2 现象:熔化的铝仍不滴落。
原因:铝很活泼,在空气中很快又生成一层新的氧化膜。演示实验3:用滤纸包住铝粉,引燃后放入纯氧气中。现象:铝剧烈燃烧,发出耀眼的白光。小结金属与氧气反应:在空气中的氧化速度侧面的说明了金属活泼性的顺序。学习了钠和铝分别跟氧气反应。
