钠.
图片预览





文档简介
课件19张PPT。2019/2/271第三章 金属及其化合物2019/2/272一、钠的物理性质[1] 银白色有金属光泽的固体;
[2] 质软;
[3] 是热、电的良导体。[4] 熔、沸点低;
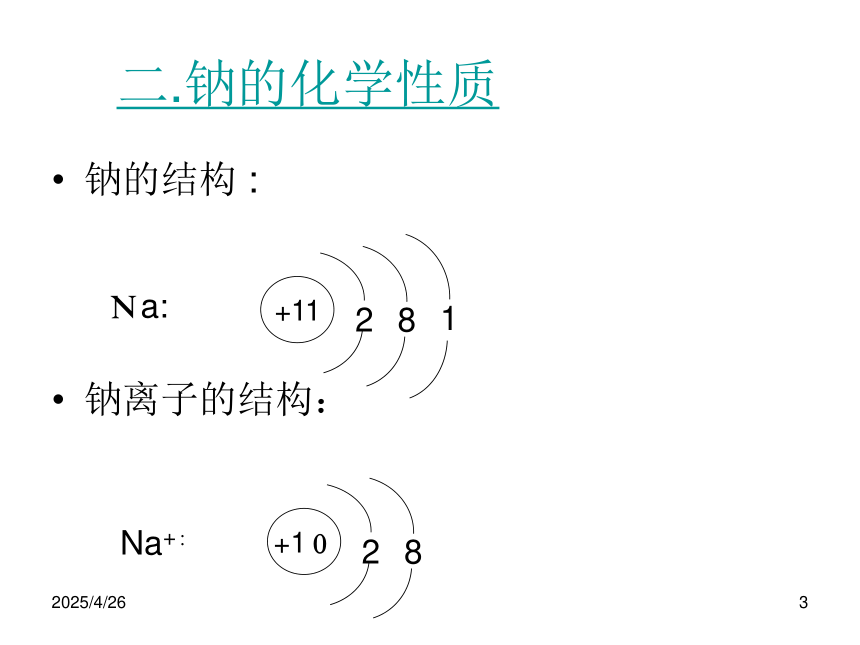
[5] 密度比水小;第一节 金属的性质2019/2/273二.钠的化学性质钠的结构 :
钠离子的结构: Na:Na+:2019/2/274㈠ 钠的还原性:
由钠的结构图可知,钠容易失去一个电子,表现为强的还原性.钠的化学性质很活泼.钠在金属活动顺序表里的位置:由1.2可推测钠的性质很活泼,能与大量非金属和酸
反应,而且能与水反应2. 1.还原性==失电子能力 2019/2/275㈡ 钠的化学性质:
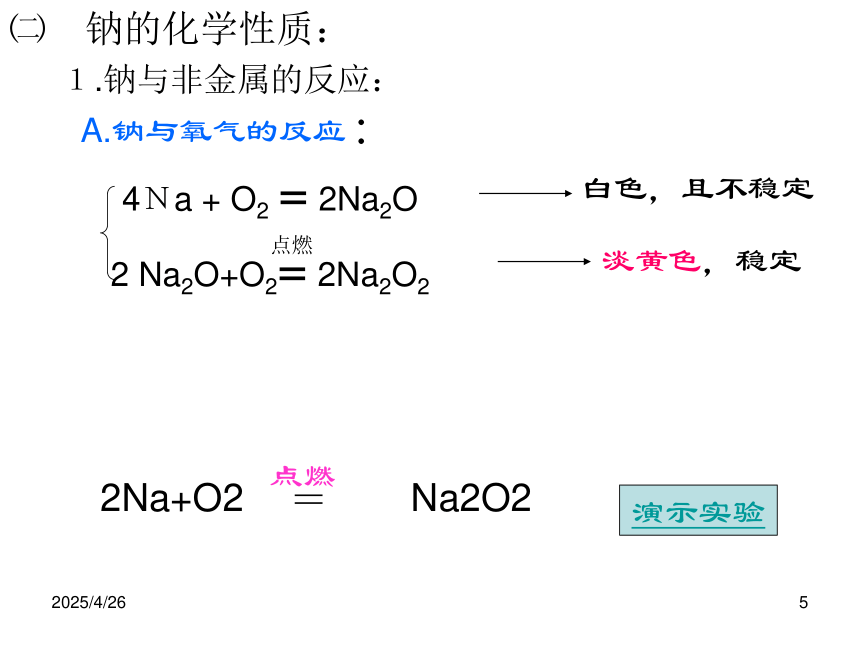
1.钠与非金属的反应:
4Na + O2 = 2Na2O
2 Na2O+O2= 2Na2O2
点燃演示实验白色,且不稳定淡黄色,稳定A.钠与氧气的反应:点燃2Na+O2 Na2O2
=2019/2/276B.钠和其他非金属的反应:2Na + Cl2=2 NaCl2Na + S = Na2S2.Na 和水的反应:请看实验从下列的提示观察实验现象,并分析原因.1.钠在水面OR水底
2.钠的运动
3.有响声吗
4.钠块的变化
5.溶液的颜色变化点燃2019/2/277浮游响熔红分析:推知生成的碱只能是NaOH,由此知道钠变成
了钠离子,化合价变化了,得到这个反应是氧
化还原反应,钠的化合价升高,是还原剂,那
么氧化剂就是水,生成的气体是水发生还原反
应的产物,所以就可知道生成的气体就是H2
钠浮的水面钠在水上游动发出嘶嘶响声钠熔成光亮小球溶液变红钠的密度比水小产生了气体产生了气体放热,且钠的熔点低生成了碱
2019/2/278钠与水的反应方程式:2Na + 2H2O 2NaOH + H2失2e-得2e-还原剂氧化剂0+1+10此反应是置换反应,H2O是弱酸,钠的性质很活泼
能置换出水中的H+.2019/2/2793、钠与酸反应 (先与酸反应)2Na+2HCl=2NaCl+H2↑实质: 2Na+2H+=2Na++H2↑思考:钠与盐酸的反应,钠过量发生什么反应.
2019/2/2710答案:钠先和酸反应,过量的钠
还和水反应.Na + 2HCl = NaCl + H22Na + 2H2O =2 NaOH + H22019/2/27114 与盐反应 实验:剧烈反应,生成气体,产生蓝色沉淀剧烈反应,生成气体,产生红褐色沉淀剧烈反应,生成气体讨论:上述现象说明什么问题?2019/2/2712钠和盐溶液反应,实际上钠先和水反应,生成的氢氧化钠再与某些盐反应。如钠与CuSO4溶液反应:2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑2019/2/2713通过对钠的化学性质的学习,我们知道钠很容易与空气中的氧气和水反应,而且钠的密度又很低,因此,在实验室中,通常将钠保存在煤油或石蜡油中。钠的密度比它们要大,因此可隔绝钠与氧气和水的接触.小结:2019/2/2714三、钠元素的存在自然界中的钠元素均以化合态存在四、钠的用途钠过氧化钠原子反应堆的导热剂高压钠灯制备钛、锆、铌、钽等金属2019/2/2715冶炼金属如钛、锆、铌、钽等;2019/2/2716发黄光,透雾能力强2019/2/2717小结:钠的化学性质钠的物理性质钠的存在和用途研究具体物质的方法:
结构 性质用途制备2019/2/2718课堂练习1、下列各组微粒中,具有相同电子数的一组是( )
A、Na和Na+ B、Na+和H2O
C、 Na和NH4+ D、Na+和HClB2、钠与水反应,其现象与钠的下列性质无关的是( )
A、钠的熔点低 B、钠的硬度小
C、钠的密度小 D、钠有强还原性B 3、将一小块钠放入下列溶液中,既能产生气体又会出现沉淀的是( )
A、稀硫酸 B、NaOH稀溶液
C、CuSO4溶液 D、HCl 溶液C2019/2/2719再见
[2] 质软;
[3] 是热、电的良导体。[4] 熔、沸点低;
[5] 密度比水小;第一节 金属的性质2019/2/273二.钠的化学性质钠的结构 :
钠离子的结构: Na:Na+:2019/2/274㈠ 钠的还原性:
由钠的结构图可知,钠容易失去一个电子,表现为强的还原性.钠的化学性质很活泼.钠在金属活动顺序表里的位置:由1.2可推测钠的性质很活泼,能与大量非金属和酸
反应,而且能与水反应2. 1.还原性==失电子能力 2019/2/275㈡ 钠的化学性质:
1.钠与非金属的反应:
4Na + O2 = 2Na2O
2 Na2O+O2= 2Na2O2
点燃演示实验白色,且不稳定淡黄色,稳定A.钠与氧气的反应:点燃2Na+O2 Na2O2
=2019/2/276B.钠和其他非金属的反应:2Na + Cl2=2 NaCl2Na + S = Na2S2.Na 和水的反应:请看实验从下列的提示观察实验现象,并分析原因.1.钠在水面OR水底
2.钠的运动
3.有响声吗
4.钠块的变化
5.溶液的颜色变化点燃2019/2/277浮游响熔红分析:推知生成的碱只能是NaOH,由此知道钠变成
了钠离子,化合价变化了,得到这个反应是氧
化还原反应,钠的化合价升高,是还原剂,那
么氧化剂就是水,生成的气体是水发生还原反
应的产物,所以就可知道生成的气体就是H2
钠浮的水面钠在水上游动发出嘶嘶响声钠熔成光亮小球溶液变红钠的密度比水小产生了气体产生了气体放热,且钠的熔点低生成了碱
2019/2/278钠与水的反应方程式:2Na + 2H2O 2NaOH + H2失2e-得2e-还原剂氧化剂0+1+10此反应是置换反应,H2O是弱酸,钠的性质很活泼
能置换出水中的H+.2019/2/2793、钠与酸反应 (先与酸反应)2Na+2HCl=2NaCl+H2↑实质: 2Na+2H+=2Na++H2↑思考:钠与盐酸的反应,钠过量发生什么反应.
2019/2/2710答案:钠先和酸反应,过量的钠
还和水反应.Na + 2HCl = NaCl + H22Na + 2H2O =2 NaOH + H22019/2/27114 与盐反应 实验:剧烈反应,生成气体,产生蓝色沉淀剧烈反应,生成气体,产生红褐色沉淀剧烈反应,生成气体讨论:上述现象说明什么问题?2019/2/2712钠和盐溶液反应,实际上钠先和水反应,生成的氢氧化钠再与某些盐反应。如钠与CuSO4溶液反应:2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑2019/2/2713通过对钠的化学性质的学习,我们知道钠很容易与空气中的氧气和水反应,而且钠的密度又很低,因此,在实验室中,通常将钠保存在煤油或石蜡油中。钠的密度比它们要大,因此可隔绝钠与氧气和水的接触.小结:2019/2/2714三、钠元素的存在自然界中的钠元素均以化合态存在四、钠的用途钠过氧化钠原子反应堆的导热剂高压钠灯制备钛、锆、铌、钽等金属2019/2/2715冶炼金属如钛、锆、铌、钽等;2019/2/2716发黄光,透雾能力强2019/2/2717小结:钠的化学性质钠的物理性质钠的存在和用途研究具体物质的方法:
结构 性质用途制备2019/2/2718课堂练习1、下列各组微粒中,具有相同电子数的一组是( )
A、Na和Na+ B、Na+和H2O
C、 Na和NH4+ D、Na+和HClB2、钠与水反应,其现象与钠的下列性质无关的是( )
A、钠的熔点低 B、钠的硬度小
C、钠的密度小 D、钠有强还原性B 3、将一小块钠放入下列溶液中,既能产生气体又会出现沉淀的是( )
A、稀硫酸 B、NaOH稀溶液
C、CuSO4溶液 D、HCl 溶液C2019/2/2719再见
