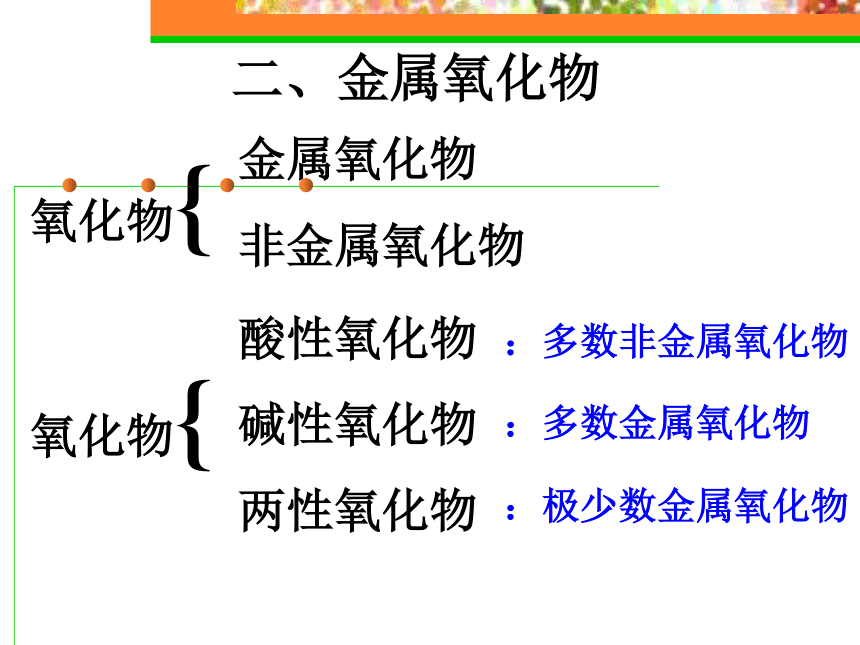
金属氧化物
图片预览








文档简介
课件24张PPT。二、金属氧化物:多数非金属氧化物:多数金属氧化物:极少数金属氧化物思考与交流:
1、金属氧化物能与哪些物质反应?1)某些与水反应 2)与酸反应 3)某些与碱反应2、哪些能与水反应呢?1、金属氧化物与水反应微溶性或可溶性的碱对应的金属氧化物能与水反应
Na2O+ H2O==2NaOH
CaO+ H2O==Ca(OH)2 2、与酸反应思考与交流
桌面上放有三瓶没有标签的金属氧化物粉末,分别是MgO、Fe2O3、CuO,你能否把他们鉴别出来?你能想到几种方法? 你是运用了他们的什么性质呢?
MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O CuO+2HCl=CuCl2+H2O 白色固体溶解,形成无色溶液红棕色固体溶解,形成黄色溶液黑色固体溶解,形成蓝绿色溶液3、与碱反应思考与交流
回忆铝片加入稀盐酸和氢氧化钠溶液中的现象:刚开始是否有气泡产生?为什么?
因为铝的表面有一层致密的氧化膜,一开始是氧化膜与盐酸或氢氧化钠溶液反应,说明铝具有两性。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+H2O三、氢氧化物思考与交流
铝是一种两性金属,氧化铝是一种两性氧化物,氢氧化铝会不会也具有两性?大家的桌面上没有氢氧化铝,现在桌面上提供了浓氨水、氢氧化钠溶液、硫酸铝溶液,你能否利用你的药品制备氢氧化铝,并验证它是不是两性氢氧化物?1、氢氧化铝白色胶状沉淀不断增多,而后沉淀溶解并最后消失。 白色胶状沉淀逐渐增多,氨水过量不溶解。1、 Al2(SO4)3 +6NaOH=2Al(OH)3↓+3Na2SO4
2、Al(OH)3+NaOH=NaAlO2+2H2OAl2(SO4)3 +6NH3·H2O=2Al(OH)3↓+3(NH4) 2SO4Al2(SO4)3与NaOH、NH3·H2O均可反应生成Al(OH)3↓,Al(OH)3溶于强碱而不溶于弱碱。
Al2(SO4)3 Al(OH)3 澄清 ?
写出以上变化过程的离子方程式:
逐滴滴NaOH逐滴滴NaOH逐滴滴稀盐酸 Al3++3OH-=Al(OH)3 ↓
Al(OH)3+OH-=AlO2-+2H2O
AlO2-+H++H2O=Al(OH)3 ↓
Al(OH)3 +3H+= Al3++3H2O学 生 实 验:1)实验室制取氢氧化铝的最佳途径:
Al2(SO4)3 +6NH3.H2O =2Al(OH)3↓ + 3(NH4)2SO4
离子方程式:
Al3++3NH3.H2O=Al(OH)3 ↓ +3NH4+ 2)物理性质:白色胶状沉淀,不溶于水
3)化学性质:
A.与酸反应B.与强碱反应C.受热分解
4)用途:治疗胃酸过多;净水剂
补充:P51明矾的电离及净水作用原理
Al3++3H2O=Al(OH)3+3H+ (胶体)2、氢氧化铁和氢氧化亚铁实验:现有氢氧化钠、氯化铁、氯化亚铁三种溶液,请你利用这些试剂先制备出氢氧化铁,再制备出氢氧化亚铁。观察、记录现象,并推导二者性质。 分别向氯化亚铁和氯化铁溶液加氢氧化钠溶液:
FeCl2溶液:先生成白色沉淀,然后很快变灰绿,最后变成红褐色。
FeCl3:生成红褐色沉淀。白色固体 红褐色固体 不溶 不溶 FeCl2+2NaOH=Fe(OH)2↓+2NaClFeCl3+3NaOH=Fe(OH)3↓+3NaCl4Fe(OH)2+O2+2H2O=4Fe(OH)3苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?3、 Fe3+ 和Fe2+ 的转化O2 Fe2+ Fe3+ 如何判断FeCl2溶液中是否有部分Fe2+被氧化成Fe3+?实验:在2支试管里分别加入2mL FeCl2溶液和2mL FeCl3溶液,各加入1~2滴KSCN溶液。观察现象并记录,填写表格。无明显变化黄色溶液变成血红色(可用来检验Fe3+的存在)如何防止FeCl2溶液的Fe2+被氧化成Fe3+? 实验:在盛有2mL FeCl3溶液的2支试管中,加入1小匙铁粉,振荡试管;充分反应后,滴入1~2滴KSCN溶液,向其中一支滴入1滴管滴氯水,另一支滴入1滴双氧水。溶液由黄色变成浅绿色溶液由浅绿色变为红色溶液由浅绿色变为红色Fe3+具有氧化性
2Fe3++Fe=3Fe2+ Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl- Fe2+ Fe3+ 还原剂:金属单质,如铁、铜、S2-、I-等
氧化剂:Cl2、H2O2、 O2 、 HNO3、
浓H2SO4 、 KMnO4 、 KClO3氧化剂还原剂1、 Fe2+和Fe3+的相互转化2、 铁盐(含Fe3+)的净水作用P52思考题1、请你设计能制得纯净氢氧化亚铁的实验方案,并在实验室里动手完成实验。
2、电子工业上刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”浸泡铜制电路板,请你思考这是利用了什么化学原理,并请你写出反应方程式。 节日里燃放的烟花为什么如此绚丽多彩、五光十色?你知道其中的奥妙吗? 四、焰色反应焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
【实验3-9】P53
注意:镍铬丝先用盐酸清洗,然后放在酒精灯上灼烧,再沾取固体药品灼烧。
,【演示实验】用酒精润湿适量棉花放在石棉网上,洒上CuSO4粉末、Ba(NO3)2粉末和Li2SO4粉末,然后点燃棉花。 1、某些金属或其化合物的焰色2、注意:
1)无论是金属的单质还是化合物,其焰色都相同;
2)金属的化合物无论是溶液中还是固体,其焰色相同。五、物质的量在化学方程式计算中的应用例1:把6.5gZn放入足量盐酸中,锌完全反应,计算:
1)6.5g锌的物质的量
2)参加反应的HCl的物质的量
3)生成H2的体积(标准状况)注意:
(1)计算时要写单位,要求规范。
(2)写物理量时“左右要对应,上下要相同”例2:把5.4g铝放入足量的氢氧化钠溶液中完全反应,计算生成的氢气的体积(标准状况)。
例3:一块表面已被部分氧化成氧化钠的钠块质量为1.08g,投入到100g水中,完全反应后收集到0.02gH2,求:
1)未被氧化的钠的质量;
2)被氧化的金属钠的质量是多少?
1、金属氧化物能与哪些物质反应?1)某些与水反应 2)与酸反应 3)某些与碱反应2、哪些能与水反应呢?1、金属氧化物与水反应微溶性或可溶性的碱对应的金属氧化物能与水反应
Na2O+ H2O==2NaOH
CaO+ H2O==Ca(OH)2 2、与酸反应思考与交流
桌面上放有三瓶没有标签的金属氧化物粉末,分别是MgO、Fe2O3、CuO,你能否把他们鉴别出来?你能想到几种方法? 你是运用了他们的什么性质呢?
MgO+2HCl=MgCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O CuO+2HCl=CuCl2+H2O 白色固体溶解,形成无色溶液红棕色固体溶解,形成黄色溶液黑色固体溶解,形成蓝绿色溶液3、与碱反应思考与交流
回忆铝片加入稀盐酸和氢氧化钠溶液中的现象:刚开始是否有气泡产生?为什么?
因为铝的表面有一层致密的氧化膜,一开始是氧化膜与盐酸或氢氧化钠溶液反应,说明铝具有两性。
两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+H2O三、氢氧化物思考与交流
铝是一种两性金属,氧化铝是一种两性氧化物,氢氧化铝会不会也具有两性?大家的桌面上没有氢氧化铝,现在桌面上提供了浓氨水、氢氧化钠溶液、硫酸铝溶液,你能否利用你的药品制备氢氧化铝,并验证它是不是两性氢氧化物?1、氢氧化铝白色胶状沉淀不断增多,而后沉淀溶解并最后消失。 白色胶状沉淀逐渐增多,氨水过量不溶解。1、 Al2(SO4)3 +6NaOH=2Al(OH)3↓+3Na2SO4
2、Al(OH)3+NaOH=NaAlO2+2H2OAl2(SO4)3 +6NH3·H2O=2Al(OH)3↓+3(NH4) 2SO4Al2(SO4)3与NaOH、NH3·H2O均可反应生成Al(OH)3↓,Al(OH)3溶于强碱而不溶于弱碱。
Al2(SO4)3 Al(OH)3 澄清 ?
写出以上变化过程的离子方程式:
逐滴滴NaOH逐滴滴NaOH逐滴滴稀盐酸 Al3++3OH-=Al(OH)3 ↓
Al(OH)3+OH-=AlO2-+2H2O
AlO2-+H++H2O=Al(OH)3 ↓
Al(OH)3 +3H+= Al3++3H2O学 生 实 验:1)实验室制取氢氧化铝的最佳途径:
Al2(SO4)3 +6NH3.H2O =2Al(OH)3↓ + 3(NH4)2SO4
离子方程式:
Al3++3NH3.H2O=Al(OH)3 ↓ +3NH4+ 2)物理性质:白色胶状沉淀,不溶于水
3)化学性质:
A.与酸反应B.与强碱反应C.受热分解
4)用途:治疗胃酸过多;净水剂
补充:P51明矾的电离及净水作用原理
Al3++3H2O=Al(OH)3+3H+ (胶体)2、氢氧化铁和氢氧化亚铁实验:现有氢氧化钠、氯化铁、氯化亚铁三种溶液,请你利用这些试剂先制备出氢氧化铁,再制备出氢氧化亚铁。观察、记录现象,并推导二者性质。 分别向氯化亚铁和氯化铁溶液加氢氧化钠溶液:
FeCl2溶液:先生成白色沉淀,然后很快变灰绿,最后变成红褐色。
FeCl3:生成红褐色沉淀。白色固体 红褐色固体 不溶 不溶 FeCl2+2NaOH=Fe(OH)2↓+2NaClFeCl3+3NaOH=Fe(OH)3↓+3NaCl4Fe(OH)2+O2+2H2O=4Fe(OH)3苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?3、 Fe3+ 和Fe2+ 的转化O2 Fe2+ Fe3+ 如何判断FeCl2溶液中是否有部分Fe2+被氧化成Fe3+?实验:在2支试管里分别加入2mL FeCl2溶液和2mL FeCl3溶液,各加入1~2滴KSCN溶液。观察现象并记录,填写表格。无明显变化黄色溶液变成血红色(可用来检验Fe3+的存在)如何防止FeCl2溶液的Fe2+被氧化成Fe3+? 实验:在盛有2mL FeCl3溶液的2支试管中,加入1小匙铁粉,振荡试管;充分反应后,滴入1~2滴KSCN溶液,向其中一支滴入1滴管滴氯水,另一支滴入1滴双氧水。溶液由黄色变成浅绿色溶液由浅绿色变为红色溶液由浅绿色变为红色Fe3+具有氧化性
2Fe3++Fe=3Fe2+ Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl- Fe2+ Fe3+ 还原剂:金属单质,如铁、铜、S2-、I-等
氧化剂:Cl2、H2O2、 O2 、 HNO3、
浓H2SO4 、 KMnO4 、 KClO3氧化剂还原剂1、 Fe2+和Fe3+的相互转化2、 铁盐(含Fe3+)的净水作用P52思考题1、请你设计能制得纯净氢氧化亚铁的实验方案,并在实验室里动手完成实验。
2、电子工业上刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”浸泡铜制电路板,请你思考这是利用了什么化学原理,并请你写出反应方程式。 节日里燃放的烟花为什么如此绚丽多彩、五光十色?你知道其中的奥妙吗? 四、焰色反应焰色反应:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
【实验3-9】P53
注意:镍铬丝先用盐酸清洗,然后放在酒精灯上灼烧,再沾取固体药品灼烧。
,【演示实验】用酒精润湿适量棉花放在石棉网上,洒上CuSO4粉末、Ba(NO3)2粉末和Li2SO4粉末,然后点燃棉花。 1、某些金属或其化合物的焰色2、注意:
1)无论是金属的单质还是化合物,其焰色都相同;
2)金属的化合物无论是溶液中还是固体,其焰色相同。五、物质的量在化学方程式计算中的应用例1:把6.5gZn放入足量盐酸中,锌完全反应,计算:
1)6.5g锌的物质的量
2)参加反应的HCl的物质的量
3)生成H2的体积(标准状况)注意:
(1)计算时要写单位,要求规范。
(2)写物理量时“左右要对应,上下要相同”例2:把5.4g铝放入足量的氢氧化钠溶液中完全反应,计算生成的氢气的体积(标准状况)。
例3:一块表面已被部分氧化成氧化钠的钠块质量为1.08g,投入到100g水中,完全反应后收集到0.02gH2,求:
1)未被氧化的钠的质量;
2)被氧化的金属钠的质量是多少?
