离子反应(浙江省绍兴市)
图片预览






文档简介
课件17张PPT。2.2.3 离子反应复习提问:1. 什么叫做电解质?非电解质?2.下列物质属于电解质的是_______,属于非电解质的是 ______________。
①盐酸 ②氢氧化钠 ③水 ④氨气 ⑤硫酸钾⑥氧化钠⑦氯化银 ⑧铝 ⑨氢气 ⑩醋酸铵 3. 作为电解质,在一定条件下导电能力是否相同呢?一、强电解质和弱电解质NaCl = Na+ + Cl- H2SO4 = 2H+ + SO42-
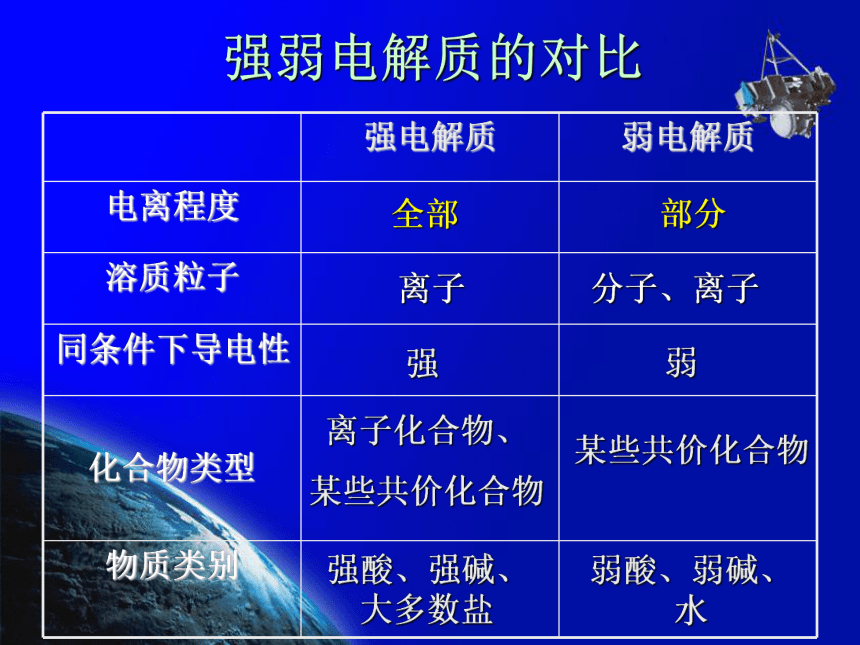
NaOH = Na+ + OH-1.强电解质:在水溶液中完全电离成离子的电解质2.弱电解质:在水溶液中部分电离成离子的电解质强弱电解质的对比全部 部分离子 分子、离子强 弱离子化合物、
某些共价化合物某些共价化合物强酸、强碱、大多数盐弱酸、弱碱、水二、离子方程式1.离子反应:有离子参加的化学反应2.离子方程式:用实际参加反应的离子的符
号来表示离子反应的式子3.步骤:①写 ②改 ③删 ④查注意:
“改”:易溶且易电离物改写成离子形式,难溶、难电离、气体、单质、氧化物仍写成化学式2.把下列化学方程式改成离子方程式:①.2FeCl2+Cl2==2FeCl32Fe2++Cl2==2Fe3++2Cl-②.Br2+SO2+2H2O==2HBr+H2SO4Br2+SO2+2H2O==4H++2Br-+SO42-③.KClO3+6HCl==3Cl2↑+KCl+3H2OClO3-+5Cl-+6H+==3Cl2↑+3H2O1.课本P54页,“问题解决”解决离子方程式不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。①.盐酸与氢氧化钠溶液中和②.硫酸中加入氢氧化钾溶液③.澄清石灰水中滴入硝酸④.氢氧化铜溶于盐酸H+ + OH- == H2OCu(OH)2 + 2H+ == Cu2+ + 2H2O三、书写离子方程式应注意的问题 1.凡非溶液中进行的反应一般
不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
2NH4Cl(固) + Ca(OH)2(固)==
CaCl2 + 2NH3↑+ 2H2O△ 2.单质、氧化物在离子方程式中一律
写化学式;弱酸(HF、H2S、HClO、
H2SO3等)、弱碱(NH3·H2O)等难电
离物质写化学式;难溶于水的物质
(如CaCO3、BaSO3、FeS、BaSO4、
Fe(OH)3等)写化学式。3.多元弱酸的酸式盐的酸根离子
在离子方程式中不能拆开写。例:① NaHCO3与盐酸反应:HCO3- + H+ == H2O + CO2↑② KHSO4与BaCl2反应:SO42- + Ba2+ == BaSO4↓4.对于微溶物的处理:①在生成物中有微溶物,微溶物用化
学式。②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。③当反应物里有微溶物处于浊液或固
态,应写化学式。5.操作顺序或反应物相对量不同
时离子方程式不同。例:①少量烧碱滴入Ca(HCO3)2溶液Ca2++HCO3-+OH-==CaCO3↓+H2O②足量烧碱滴入Ca(HCO3)2溶液Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O思考:NaHCO3溶液与Ca(OH)2溶液混合?
KHSO4溶液与Ba(OH)2溶液混合? 1、①NaHCO3少量时:Ca2++HCO3-+OH- ==CaCO3↓+H2O② NaHCO3过量时:Ca2++2HCO3-+2OH- ==CaCO3↓+CO32-+2H2O2、①KHSO4少量时:Ba2++SO42-+H++OH-==BaSO4 ↓ +H2O②KHSO4过量时:Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O四、离子共存问题:1.离子不能在溶液中大量共存的情况:①生成难溶物或微溶物:如:Ba2+与CO32-、Ag+与Br -、
Ca2+与SO42- 等②.生成气体或挥发性物质:如:NH4+与OH-、H+与CO32-、HCO3-、
S2-、 HS-、SO32-、HSO3-等③.生成难电离物质:如:H+与Ac-、CO32-、S2-、SO32-
等生成弱酸;
OH-与NH4+生成的弱碱;
H+与OH-生成水④.发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、
MnO4-等)与还原性离子(如S2-、I-、
Fe2+、SO32-等)不能大量共存。2、附加隐含条件的应用规律:①溶液无色透明时,则溶液中
一定没有色离子。常见的有色离子:
Cu2+、Fe3+、Fe2+、MnO4-等②强碱性溶液中肯定不存在与
OH-反应的离子。③强酸性溶液中肯定不存在与
H+反应的离子。
①盐酸 ②氢氧化钠 ③水 ④氨气 ⑤硫酸钾⑥氧化钠⑦氯化银 ⑧铝 ⑨氢气 ⑩醋酸铵 3. 作为电解质,在一定条件下导电能力是否相同呢?一、强电解质和弱电解质NaCl = Na+ + Cl- H2SO4 = 2H+ + SO42-
NaOH = Na+ + OH-1.强电解质:在水溶液中完全电离成离子的电解质2.弱电解质:在水溶液中部分电离成离子的电解质强弱电解质的对比全部 部分离子 分子、离子强 弱离子化合物、
某些共价化合物某些共价化合物强酸、强碱、大多数盐弱酸、弱碱、水二、离子方程式1.离子反应:有离子参加的化学反应2.离子方程式:用实际参加反应的离子的符
号来表示离子反应的式子3.步骤:①写 ②改 ③删 ④查注意:
“改”:易溶且易电离物改写成离子形式,难溶、难电离、气体、单质、氧化物仍写成化学式2.把下列化学方程式改成离子方程式:①.2FeCl2+Cl2==2FeCl32Fe2++Cl2==2Fe3++2Cl-②.Br2+SO2+2H2O==2HBr+H2SO4Br2+SO2+2H2O==4H++2Br-+SO42-③.KClO3+6HCl==3Cl2↑+KCl+3H2OClO3-+5Cl-+6H+==3Cl2↑+3H2O1.课本P54页,“问题解决”解决离子方程式不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。①.盐酸与氢氧化钠溶液中和②.硫酸中加入氢氧化钾溶液③.澄清石灰水中滴入硝酸④.氢氧化铜溶于盐酸H+ + OH- == H2OCu(OH)2 + 2H+ == Cu2+ + 2H2O三、书写离子方程式应注意的问题 1.凡非溶液中进行的反应一般
不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
2NH4Cl(固) + Ca(OH)2(固)==
CaCl2 + 2NH3↑+ 2H2O△ 2.单质、氧化物在离子方程式中一律
写化学式;弱酸(HF、H2S、HClO、
H2SO3等)、弱碱(NH3·H2O)等难电
离物质写化学式;难溶于水的物质
(如CaCO3、BaSO3、FeS、BaSO4、
Fe(OH)3等)写化学式。3.多元弱酸的酸式盐的酸根离子
在离子方程式中不能拆开写。例:① NaHCO3与盐酸反应:HCO3- + H+ == H2O + CO2↑② KHSO4与BaCl2反应:SO42- + Ba2+ == BaSO4↓4.对于微溶物的处理:①在生成物中有微溶物,微溶物用化
学式。②当反应物里有微溶物处于溶液状态
(稀溶液),应写成离子形式。③当反应物里有微溶物处于浊液或固
态,应写化学式。5.操作顺序或反应物相对量不同
时离子方程式不同。例:①少量烧碱滴入Ca(HCO3)2溶液Ca2++HCO3-+OH-==CaCO3↓+H2O②足量烧碱滴入Ca(HCO3)2溶液Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O思考:NaHCO3溶液与Ca(OH)2溶液混合?
KHSO4溶液与Ba(OH)2溶液混合? 1、①NaHCO3少量时:Ca2++HCO3-+OH- ==CaCO3↓+H2O② NaHCO3过量时:Ca2++2HCO3-+2OH- ==CaCO3↓+CO32-+2H2O2、①KHSO4少量时:Ba2++SO42-+H++OH-==BaSO4 ↓ +H2O②KHSO4过量时:Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O四、离子共存问题:1.离子不能在溶液中大量共存的情况:①生成难溶物或微溶物:如:Ba2+与CO32-、Ag+与Br -、
Ca2+与SO42- 等②.生成气体或挥发性物质:如:NH4+与OH-、H+与CO32-、HCO3-、
S2-、 HS-、SO32-、HSO3-等③.生成难电离物质:如:H+与Ac-、CO32-、S2-、SO32-
等生成弱酸;
OH-与NH4+生成的弱碱;
H+与OH-生成水④.发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、
MnO4-等)与还原性离子(如S2-、I-、
Fe2+、SO32-等)不能大量共存。2、附加隐含条件的应用规律:①溶液无色透明时,则溶液中
一定没有色离子。常见的有色离子:
Cu2+、Fe3+、Fe2+、MnO4-等②强碱性溶液中肯定不存在与
OH-反应的离子。③强酸性溶液中肯定不存在与
H+反应的离子。
