钠镁及其化合物复习课 课件(浙江省绍兴市)
文档属性
| 名称 | 钠镁及其化合物复习课 课件(浙江省绍兴市) | 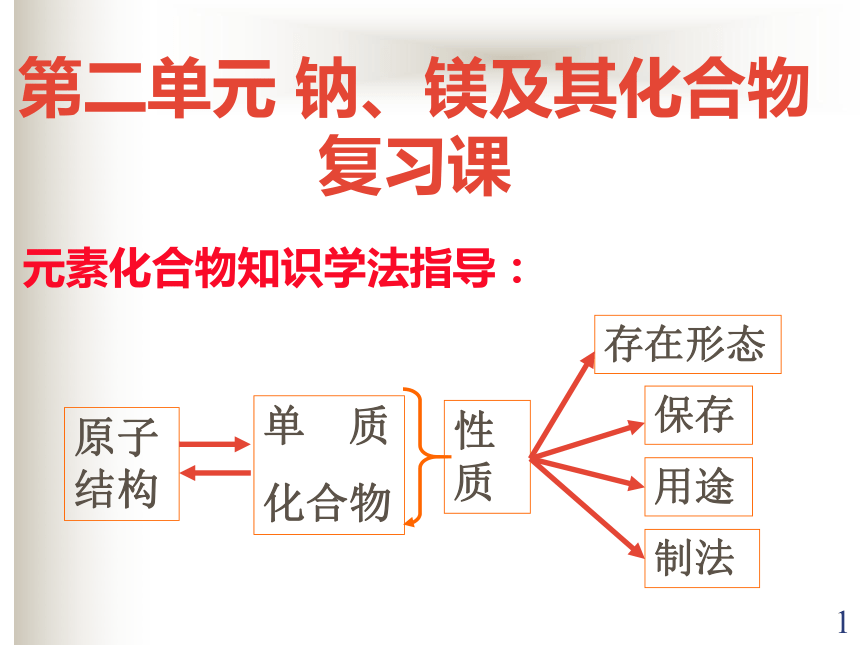 | |
| 格式 | rar | ||
| 文件大小 | 98.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-02-09 09:03:00 | ||
图片预览







文档简介
课件16张PPT。1元素化合物知识学法指导:第二单元 钠、镁及其化合物 复习课2Na钠、镁原子结构比较Mg相同点:都容易失去最外层电子变成稳定的金属阳离子;都具有很强的还原性,属于活泼金属。不同点:钠比镁更容易失去最外层电子,比镁更活泼。3钠、镁物理性质比较(1)相似性(2)差异性都是银白色的轻金属,质地较软,
熔点较小,有良好的导电导热性。镁的硬度比钠大,熔点沸点比钠高。密度钠小于水而镁的密度大于水。4钠、镁化学性质比较1. 与非金属反应Mg3N2+6H2O=3Mg(OH)2↓ +2NH3 ↑ 思考:通过钠、镁和非金属反应条件的不同可得出什么结论?4Na + O2 = 2Na2O53. 与酸反应Mg+2H+=Mg2++H2↑ 很剧烈,甚至爆炸较剧烈2. 与水反应2Na + 2H2O = 2NaOH + H2↑ 反应很剧烈,有轻微的爆鸣声反应缓慢反应的实质是金属和水电离出来的氢离子反应思考:通过钠、镁与水和酸反应的对比说明了什么?4. 特殊性质6思考:1.根据Na与水反应的现象,推测金属Na的性质特点。 2.写出Na与CuSO4(aq)、FeCl3 (aq)反应的离子方程式,并说明反应实质。3.推测:把一小块Na投入饱和的澄清石灰水中的现象。4. 将镁放到空气中燃烧,能得到哪些产物?什么物质的量最多?7钠、镁的存在和用途钠在自然界里没有游离态,只能以化合态(主要以NaCl形式)存在镁主要以化合态的形式存在于地壳和海水(MgCl2)中1、存在2、用途①制合金(与铜、铝、锡、锰、钛等)
②制耐火材料(MgO)熔点高
③植物叶绿素组成成分钠的用途镁的用途8钠、镁的制取1、钠的制备
工业上通常采用电解熔融的NaCl的方法。★均采用电解法★2、镁的工业常见制法9过氧化物碱性氧化物-1-2淡黄色固体白色固体2Na2O2 + 2H2O = 4NaOH + O2↑Na2O + H2O= 2NaOH2Na2O2 + 2CO2 = 2Na2CO3 + O2Na2O + CO2= Na2CO3强漂白性无漂白剂、供氧剂制Na2O2等钠的氧化物10碳酸钠与碳酸氢钠的比较白色粉末 细小白色晶体 纯碱、苏打 小苏打 106 84Na2CO3 NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
制玻璃、肥皂等 发酵粉、胃药等 两者溶液均呈碱性11鉴
别
方
法3.加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。加热固体,产生能使澄清石灰水变浑浊的无色气体的是碳酸氢钠。4. 溶解,加入CaCl2溶液,产生白 色沉淀的是碳酸钠。思考:怎样鉴别碳酸钠和碳酸氢钠?2 .溶解度大小比较法。12思考:在实验室中,只用试管和滴管,不用其他化学试剂,能否鉴别下列二种无色溶液:Na2CO3和HCl?说明原理。Na2CO3 NaHCO3 化学性质 Na2CO3 开始滴加无气泡, HCl一开始滴加,立即产生气泡。继续滴加有气泡。13盐酸和碳酸钠的反应分两步进行:HCl + Na2CO3 = NaCl + NaHCO3HCl + NaHCO3 = NaCl +H2O +CO2Na2CO3 NaHCO3 化学性质 14 侯氏制碱法:基本反应是往被氨饱和了的食盐水中通入过量的CO2,有NaHCO3晶体析出。总:NH3+H2O+CO2+NaCl==NH4Cl+NaHCO3↓(晶体)2NaHCO3 ==Na2CO3 + H2O + CO2 ↑△操作上能否先通CO2,后通NH3?NH3+H2O+CO2==NH4HCO3NH4HCO3+NaCl ==NH4Cl+NaHCO3↓(晶体) 思考:(1)在制小苏打的第一步操作中,是在饱和食盐水中先通入氨,后通入二氧化碳,两种气体通入顺序不能颠倒的原因是?(2)上述反应为什么能生成NaHCO3?15[练习] 如何除去下列物质中的杂质?Na2CO3 (NaOH)
NaHCO3 (Na2CO3)
NaOH (Na2CO3 (NaHCO3)
Na2CO3)16钠及其化合物的相互关系图:
熔点较小,有良好的导电导热性。镁的硬度比钠大,熔点沸点比钠高。密度钠小于水而镁的密度大于水。4钠、镁化学性质比较1. 与非金属反应Mg3N2+6H2O=3Mg(OH)2↓ +2NH3 ↑ 思考:通过钠、镁和非金属反应条件的不同可得出什么结论?4Na + O2 = 2Na2O53. 与酸反应Mg+2H+=Mg2++H2↑ 很剧烈,甚至爆炸较剧烈2. 与水反应2Na + 2H2O = 2NaOH + H2↑ 反应很剧烈,有轻微的爆鸣声反应缓慢反应的实质是金属和水电离出来的氢离子反应思考:通过钠、镁与水和酸反应的对比说明了什么?4. 特殊性质6思考:1.根据Na与水反应的现象,推测金属Na的性质特点。 2.写出Na与CuSO4(aq)、FeCl3 (aq)反应的离子方程式,并说明反应实质。3.推测:把一小块Na投入饱和的澄清石灰水中的现象。4. 将镁放到空气中燃烧,能得到哪些产物?什么物质的量最多?7钠、镁的存在和用途钠在自然界里没有游离态,只能以化合态(主要以NaCl形式)存在镁主要以化合态的形式存在于地壳和海水(MgCl2)中1、存在2、用途①制合金(与铜、铝、锡、锰、钛等)
②制耐火材料(MgO)熔点高
③植物叶绿素组成成分钠的用途镁的用途8钠、镁的制取1、钠的制备
工业上通常采用电解熔融的NaCl的方法。★均采用电解法★2、镁的工业常见制法9过氧化物碱性氧化物-1-2淡黄色固体白色固体2Na2O2 + 2H2O = 4NaOH + O2↑Na2O + H2O= 2NaOH2Na2O2 + 2CO2 = 2Na2CO3 + O2Na2O + CO2= Na2CO3强漂白性无漂白剂、供氧剂制Na2O2等钠的氧化物10碳酸钠与碳酸氢钠的比较白色粉末 细小白色晶体 纯碱、苏打 小苏打 106 84Na2CO3 NaHCO3 Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
制玻璃、肥皂等 发酵粉、胃药等 两者溶液均呈碱性11鉴
别
方
法3.加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。加热固体,产生能使澄清石灰水变浑浊的无色气体的是碳酸氢钠。4. 溶解,加入CaCl2溶液,产生白 色沉淀的是碳酸钠。思考:怎样鉴别碳酸钠和碳酸氢钠?2 .溶解度大小比较法。12思考:在实验室中,只用试管和滴管,不用其他化学试剂,能否鉴别下列二种无色溶液:Na2CO3和HCl?说明原理。Na2CO3 NaHCO3 化学性质 Na2CO3 开始滴加无气泡, HCl一开始滴加,立即产生气泡。继续滴加有气泡。13盐酸和碳酸钠的反应分两步进行:HCl + Na2CO3 = NaCl + NaHCO3HCl + NaHCO3 = NaCl +H2O +CO2Na2CO3 NaHCO3 化学性质 14 侯氏制碱法:基本反应是往被氨饱和了的食盐水中通入过量的CO2,有NaHCO3晶体析出。总:NH3+H2O+CO2+NaCl==NH4Cl+NaHCO3↓(晶体)2NaHCO3 ==Na2CO3 + H2O + CO2 ↑△操作上能否先通CO2,后通NH3?NH3+H2O+CO2==NH4HCO3NH4HCO3+NaCl ==NH4Cl+NaHCO3↓(晶体) 思考:(1)在制小苏打的第一步操作中,是在饱和食盐水中先通入氨,后通入二氧化碳,两种气体通入顺序不能颠倒的原因是?(2)上述反应为什么能生成NaHCO3?15[练习] 如何除去下列物质中的杂质?Na2CO3 (NaOH)
NaHCO3 (Na2CO3)
NaOH (Na2CO3 (NaHCO3)
Na2CO3)16钠及其化合物的相互关系图:
