陕西省2009年高中学业水平考试模拟试题(二)
文档属性
| 名称 | 陕西省2009年高中学业水平考试模拟试题(二) |

|
|
| 格式 | zip | ||
| 文件大小 | 65.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-02-10 00:00:00 | ||
图片预览




文档简介
陕西省2009年高中学业水平考试模拟试题
化 学(二)
考生注意:
1.本试卷分第一部分(选择题)和第二部分(非选择题)两部分。满分100分,考试时间90分钟。
2.请将第一部分的答案填写在第二部分相应的答题栏内,交卷时只交第二部分。
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 Al—27
S—32 Cl—35.5 Fe—56 Cu—64
第一部分(选择题 共50分)
一、选择题(本题包括10小题,每小题2分,计20分。每小题只有一个正确答案,多选、不选或错选均不给分)
1. 焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
2. 化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
3. 2008年年初我国南方部分省市遭遇了罕见的冰雪灾害,为确保交通安全,融雪剂成为清除道路积雪的有力武器。过去使用的融雪剂以氯化钠等无机盐为主要成分,如向100g冰或雪中加入33g氯化钠可以使冰点降低到-21.2℃,但它对路面和桥梁中钢筋的腐蚀作用相当强,对植物也会产生相当大的危害。现在所用的环保型融雪剂则大量使用有机盐和缓蚀剂,有的还添加了尿素,但它的融雪原理与以前相同。则下列说法不正确的是
A.环保型融雪剂的融雪原理为盐溶于水后,使冰点降低
B.使用环保型融雪剂可以减缓对路面和桥梁中钢筋的腐蚀
C.使用环保型融雪剂可以减少对植物的危害
D.使用环保型融雪剂主要是给植物补充养分
4. 下列变化中加入氧化剂才能发生的是
A.2Cl—→Cl2 B.Fe3+→Fe2+ C.Cu2+→Cu D.MnO4—→MnO2
5. 在元素周期表中金属元素和非金属元素的分界线附近的一些元素能用于制
A.半导体 B.合金 C.催化剂 D.农药
6. 在实验室中,对下列实验事故或药品的处理正确的是
A.加热液体的试管口不能正对着自己或别人
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗
D.实验室中含硫酸的废液可以直接倒入水槽,用水冲入下水道
7. 下列物质中,属于电解质的是
A.铜 B.H2SO4 C.蔗糖 D.酒精
8. 分别向盛有淀粉碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉碘溶液褪色,实验结果见右表。下列说法不正确的是
黄瓜汁 新鲜 久置
滴数 12 20
A.维生素C具有还原性,能将碘单质还原为I—离子
B.实验时两烧杯中的淀粉碘溶液的浓度和体积相等
C.新鲜黄瓜汁中比久置黄瓜汁中维生素C含量低
D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果
9. 关于元素周期表的说法正确的是
A.元素周期表有8个主族 B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期 D.短周期是指第一、二周期
10. 下列叙述或操作正确的是
A.浓硫酸具有强氧化性,稀硫酸无氧化性
B.稀硫酸在加热时与铜的反应放出SO2气体
C.浓硫酸不慎沾到皮肤上,立即用大量的NaOH溶液冲洗
D.稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌
二、选择题(本题包括10小题,每小题3分,计30分。每小题只有一个正确答案,多选、不选或错选均不给分)
11. 现有三种常见治疗胃病药品的标签:
① ② ③
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是: ( )
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
12. 下列反应的离子方程式,正确的是
A.稀盐酸与氢氧化钠反应: NaOH+H+ = Na++H2O
B.铁与稀硫酸反应: 2Fe+6H+ = 2Fe3++3H2↑
C.碳酸钙与盐酸反应: CaCO3+2 H+ = Ca2++H2O+CO2↑
D.氯水滴入氯化亚铁溶液中: Fe2++Cl2= Fe3++2Cl-
13. 家庭使用的天然气(主要成分为CH4)、液化石油气(主要成分为C3H8)燃烧反应的主要化学方程式为CH4+2O2CO2+2H2O;C3H8+5O23CO2+4H2O
现有一套以液化石油气为原料的灶具,欲改为烧天然气,应采取的措施是: ( )
A.减少空气进量,增大天然气进量 B.减少空气进量,减少天然气进量
C.增大空气进量,增大天然气进量 D.增大空气进量,减少天然气进量
14. 关于右图所示装置的叙述正确的是
A.锌是正极
B.铜片质量逐渐减少
C.铜片表面发生还原反应
D.电流从锌片经导线流向铜片
15. 在下列所示的转化关系中,X不可能是
A.N2 B.H2 C.S D.C
16. 下列关于化学反应的速率和限度的说法正确的是
A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.催化剂都能加快化学反应速率,提高原料利用率或转化率
17. 在无土栽培中需用浓度为0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是
A.0.4mol、0.5mol、0.12mol B.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24mol D.0.64mol、0.02mol、0.24mol
18. 量取100mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为
A.液体分层,上层为四氯化碳层,黄色 B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色 D.液体分层,下层为水层,黄色
19. 下列变化中不能通过一步反应就能实现的是
A.K2SiO3→H2SiO3 B.Si→Na2SiO3 C.SiO2→H2SiO3 D.SiO2→K2SiO3
20. 某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温、恒压的条件下,将此混合气体通过浓硫酸时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则混合气体的成份是
A、HCl、CO和CO2 B、HCl、H2和CO
C、CH4和NH3 D、HCl和CO
陕西省2009年高中学业水平考试模拟试题(卷)
化 学(二)
题 号 1 2 3 4 5 6 7 8 9 10
答 案
题 号 11 12 13 14 15 16 17 18 19 20
答 案
题 号 第一部分 第二部分 总 分
1—20 必答题 选答题
得 分
第二部分 (非选择题 共50分)
得 分 评卷人
三、必答题(本题包括5小题,计30分)
21.(4分)分子式为C4H10 的烃的所有的结构简式为
用系统命名法给予命名
22.(5分)欲用18 mol/L的浓硫酸(密度为1.84g/mL)配制成浓度为 0.5mol/L 的稀硫酸 500mL。
(1)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和_________ 。
(2)请将下列各操作按正确的序号填写在横线上__________。
A.用量筒量取浓硫酸 B.反复颠倒摇匀
C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签
E.稀释浓硫酸 F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为______mL;
②如果实验室有15mL 、20mL、50mL的量筒,应选用_____mL。
23. (8分)下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式回答:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦ ⑧
四 ⑨ ⑩
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为
⑵地壳中含量最多的金属元素是_______________.
⑶用电子式表示②与④形成化合物的过程 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
⑸写出⑤与氢氧化钠反应的化学方程式: 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
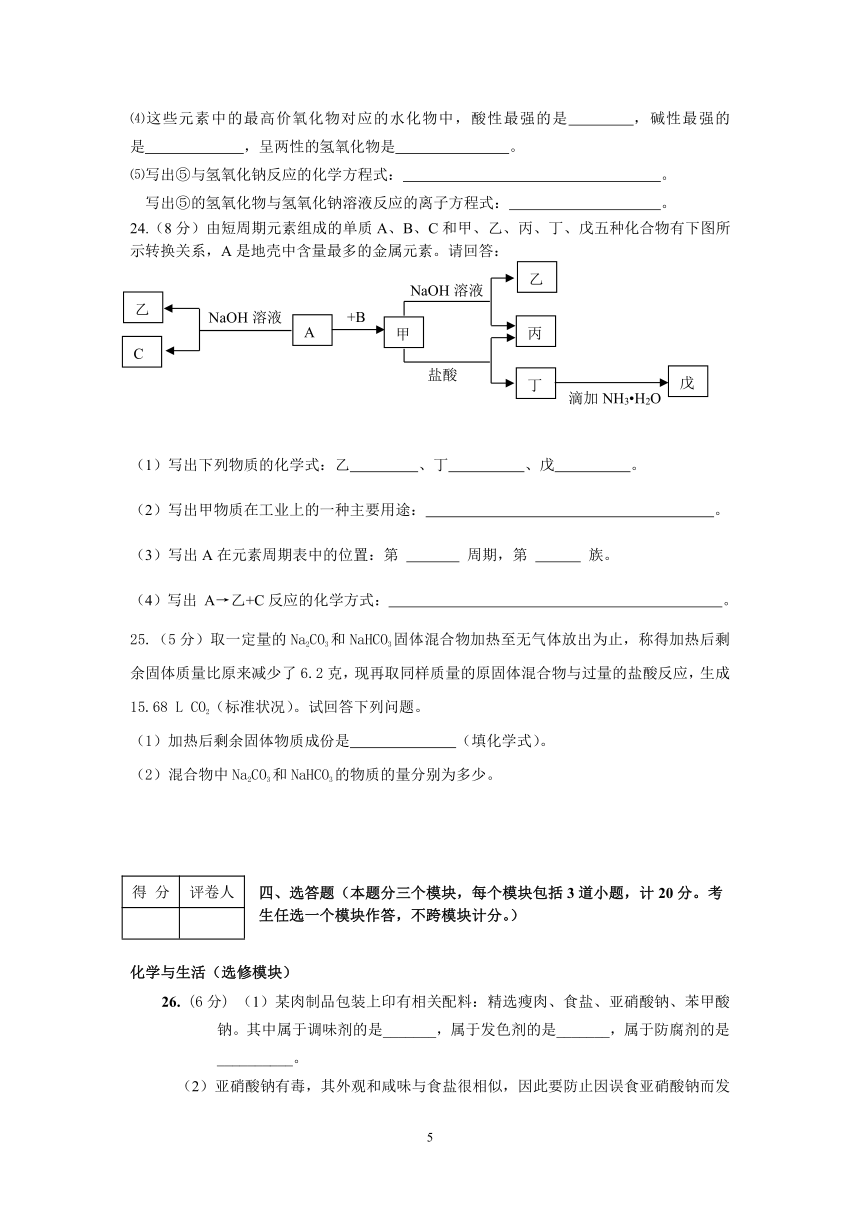
24.(8分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答:
(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出A在元素周期表中的位置:第 周期,第 族。
(4)写出 A→乙+C反应的化学方式: 。
25.(5分)取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2克,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。试回答下列问题。
(1)加热后剩余固体物质成份是 (填化学式)。
(2)混合物中Na2CO3和NaHCO3的物质的量分别为多少。
得 分 评卷人
四、选答题(本题分三个模块,每个模块包括3道小题,计20分。考生任选一个模块作答,不跨模块计分。)
化学与生活(选修模块)
26. (6分) (1)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠。其中属于调味剂的是_______,属于发色剂的是_______,属于防腐剂的是__________。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 亚硝酸钠 氯化钠
1.酸性条伯下的稳定性 微热时分解为NO和NO2 微热时不分解
2.熔点 271℃ 801℃
3.室温时的溶解度 约80g 约35g
请根据表中信息设计一种鉴别NaNO:和NaCl的方法,写出简单的操作过程、现象和结论:_________________________________________
27. (7分)为配合X市创建国家卫生城市活动,某校在综合实践活动中开展了相关研究。
(1)了解X市环境现状: 查阅环境质量监测报告:X市降水的pH年均值约为5.07,说明X市空气中 含量超标。饮用水源地水质为V类水质,主要超标项目为总氮、粪大肠菌群。其水质污染的原因可能是 (任答一个原因)。
(2)寻觅丰富丝绸文化 :X市以盛产蚕丝绸闻名,素有“丝绸之乡”之称。这里的“蚕丝”是指 (填序号) A.人造纤维 B.天然纤维C.合成纤维
(3)参与建设生态城市 :在社区调查中,居民提出了以下建议:①采取措施,减少和控制污染气体的排放;②禁止在河敞放鸭子,以免大量鸭粪污染河流;③植树造林,增大绿化面积;④就地焚烧垃圾,减少固体污染物。你认为合理的是 (填序号)。
28. (7分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的。
(2)微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________。
(3)人体摄入过多的食物时,会引起胃酸分泌过多,胃酸的pH下降,使人体感到不适,此时应服用消酸剂,双羟基铝酸钠就是一种常用的消酸剂,其化学式为NaAl(OH)2CO3,由于Al3+在人体内难以代谢,含量过高可导致老年痴呆症等疾病,为防止人体摄入过量铝元素,请提一
条合理的建议___________________________________________.
化学反应原理(选修模块)
26. (4分)将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:_______________________________________________。
问题2:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:________ ____ 。
27. (8分)(1)在2mL0.1mol/L的NaCl溶液中,加入2mL0.1mol/L的AgNO3溶液,可观察到 ,此反应的离子方程式 。将此混合液过滤,滤渣加入2mL0.1mol/L的KI溶液,搅拌,可观察到 ,反应的离子方程式为 。
(2)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
28. (8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
有机化学基础(选修模块)
26. (5分)在下列物质中选择相应的序号填空:
①甲烷 ②乙烯 ③乙炔 ④甲苯 ⑤乙醇 ⑥乙酸乙酯
分子结构为正四面体的是
分子中含有碳碳三键的是
能发生水解反应 的是
在核磁共振氢谱中有三个吸收峰,且峰面积之比为1:2:3的是
能使酸性高锰酸钾溶液褪色,但不能使溴的四氯化碳溶液褪色的是
27. (8分)根据下面的反应路线及所给信息填空。
(1)A的结构简式是 。①的反应类型是 。②的反应类型是 。
(2)反应④的化学方程式是
。
28. (7分)化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系。试回答下列问题。
(1)A的名称是 。
(2)B的结构简式是 。
(3)D中含有的官能团(填名称) 。
(4)写出B和C生成A的化学方程式 。
参考答案:一、选择题(每小题2分,计20分)
1~5DCDAA 6~10 ABCCD
二、选择题(每小题3分,计30分)
11~15CCACB 16~20 BDCCD
三、必答题(本题包括5小题,计30分)
21.(4分)结构简式略 丁烷 2-甲基丙烷
22.(5分)(1) 500ml容量瓶
(2) AEFCBD (2分)
(3)① 13.6 ② 15
23.(共8分,每空1分,)
(1)Ar
(2)Al (3)
(4)HClO4 KOH Al(OH)3
24.(8分)
(1)NaAlO2、 AlCl3、 Al (OH)3 (各1分)
(2)冶炼金属铝的原料或做耐火材料(坩埚等)(1分)
(3)三,ⅢA (2分)
(4) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
25. (6分)(1)Na2CO3 (2) NaHCO3 0.2mol Na2CO3 0.5mol
四、选答题(本题包括3小题,计20分)
化学与生活(选修模块)(共20分)
26.(6分)(1)食盐,亚硝酸钠,笨甲酸钠(或苯甲酸钠和亚硝酸钠)各1分(共3分)
(2)溶于水制成溶液,加人稀硫酸微热,有棕色气体生成者,原物质为NaNO2,否则为NaCl;或用酒精灯加热,熔化者为NaNO2,不熔者为NaCl;或取两支试管,各加人5 mL水,分别溶解这两种物质,至不再溶解时,溶解量大的为亚硝酸钠,溶解量小的为氯化钠 3分
27.(7分) (1)二氧化硫、氮氧化物;(2分) 生活污水(2分)
(或工业废水、或农业用水等。答其它原因只要合理即可给分)
(2)B (1分) (3)①②③ (2分)
28.(7分)(1)蛋白质(2分)(2)碘、碘、缺铁性贫血(3分)(3)使用碳酸氢钠作为消酸剂(2分)
化学反应原理(选修模块)(共20分)
26.(4分)问题l:改变影响平衡的一个条件。平衡将向能够减弱这种改变的方向移动。(2分)
问题2:C(金刚石、s)=C(石墨、s):△H=-1.90kJ/mol. (2分)
27.(8分)(1)白色沉淀 Ag+ + Cl- = AgCl↓ 白色沉淀变为黄色沉淀 AgCl + I- = AgI↓ + Cl-
(2)酸,< ,Ag+ + H2O AgOH + H+ ,抑制
28.(共8分,每空各2分)
(1); (2)吸热;
(3)B、C; (4)830
有机化学基础(选修模块)(共20分)
26. (5分)(1)① (2)③ (3)⑥ (4)⑤ (5)④
27. (8分)(1) 取代反应 加成反应
(2) +2NaOH +2NaBr+2H2O
28. (7分)(1) 乙酸乙酯(2分) (2) CH3COOH (2分)
(3)醛基 (1分)
(4) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O (2分)
滴加NH3 H2O
C
乙
NaOH溶液
A
+B
甲
NaOH溶液
盐酸
乙
丁
丙
戊
+18888
8
2
8
Mg
F
F
F
Mg
2–
2
乙醇
△
PAGE
1
化 学(二)
考生注意:
1.本试卷分第一部分(选择题)和第二部分(非选择题)两部分。满分100分,考试时间90分钟。
2.请将第一部分的答案填写在第二部分相应的答题栏内,交卷时只交第二部分。
可能用到的相对原子质量: H—1 C—12 N—14 O—16 Na—23 Al—27
S—32 Cl—35.5 Fe—56 Cu—64
第一部分(选择题 共50分)
一、选择题(本题包括10小题,每小题2分,计20分。每小题只有一个正确答案,多选、不选或错选均不给分)
1. 焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
2. 化学反应前后肯定没有变化的是
①原子数目 ②分子数目 ③元素种类 ④物质的总质量 ⑤物质的种类
A.①④ B.①③⑤ C.①③④ D.①②③④
3. 2008年年初我国南方部分省市遭遇了罕见的冰雪灾害,为确保交通安全,融雪剂成为清除道路积雪的有力武器。过去使用的融雪剂以氯化钠等无机盐为主要成分,如向100g冰或雪中加入33g氯化钠可以使冰点降低到-21.2℃,但它对路面和桥梁中钢筋的腐蚀作用相当强,对植物也会产生相当大的危害。现在所用的环保型融雪剂则大量使用有机盐和缓蚀剂,有的还添加了尿素,但它的融雪原理与以前相同。则下列说法不正确的是
A.环保型融雪剂的融雪原理为盐溶于水后,使冰点降低
B.使用环保型融雪剂可以减缓对路面和桥梁中钢筋的腐蚀
C.使用环保型融雪剂可以减少对植物的危害
D.使用环保型融雪剂主要是给植物补充养分
4. 下列变化中加入氧化剂才能发生的是
A.2Cl—→Cl2 B.Fe3+→Fe2+ C.Cu2+→Cu D.MnO4—→MnO2
5. 在元素周期表中金属元素和非金属元素的分界线附近的一些元素能用于制
A.半导体 B.合金 C.催化剂 D.农药
6. 在实验室中,对下列实验事故或药品的处理正确的是
A.加热液体的试管口不能正对着自己或别人
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗
D.实验室中含硫酸的废液可以直接倒入水槽,用水冲入下水道
7. 下列物质中,属于电解质的是
A.铜 B.H2SO4 C.蔗糖 D.酒精
8. 分别向盛有淀粉碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉碘溶液褪色,实验结果见右表。下列说法不正确的是
黄瓜汁 新鲜 久置
滴数 12 20
A.维生素C具有还原性,能将碘单质还原为I—离子
B.实验时两烧杯中的淀粉碘溶液的浓度和体积相等
C.新鲜黄瓜汁中比久置黄瓜汁中维生素C含量低
D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果
9. 关于元素周期表的说法正确的是
A.元素周期表有8个主族 B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期 D.短周期是指第一、二周期
10. 下列叙述或操作正确的是
A.浓硫酸具有强氧化性,稀硫酸无氧化性
B.稀硫酸在加热时与铜的反应放出SO2气体
C.浓硫酸不慎沾到皮肤上,立即用大量的NaOH溶液冲洗
D.稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌
二、选择题(本题包括10小题,每小题3分,计30分。每小题只有一个正确答案,多选、不选或错选均不给分)
11. 现有三种常见治疗胃病药品的标签:
① ② ③
药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是: ( )
A.①=②=③ B.①>②>③ C.③>②>① D.②>③>①
12. 下列反应的离子方程式,正确的是
A.稀盐酸与氢氧化钠反应: NaOH+H+ = Na++H2O
B.铁与稀硫酸反应: 2Fe+6H+ = 2Fe3++3H2↑
C.碳酸钙与盐酸反应: CaCO3+2 H+ = Ca2++H2O+CO2↑
D.氯水滴入氯化亚铁溶液中: Fe2++Cl2= Fe3++2Cl-
13. 家庭使用的天然气(主要成分为CH4)、液化石油气(主要成分为C3H8)燃烧反应的主要化学方程式为CH4+2O2CO2+2H2O;C3H8+5O23CO2+4H2O
现有一套以液化石油气为原料的灶具,欲改为烧天然气,应采取的措施是: ( )
A.减少空气进量,增大天然气进量 B.减少空气进量,减少天然气进量
C.增大空气进量,增大天然气进量 D.增大空气进量,减少天然气进量
14. 关于右图所示装置的叙述正确的是
A.锌是正极
B.铜片质量逐渐减少
C.铜片表面发生还原反应
D.电流从锌片经导线流向铜片
15. 在下列所示的转化关系中,X不可能是
A.N2 B.H2 C.S D.C
16. 下列关于化学反应的速率和限度的说法正确的是
A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.催化剂都能加快化学反应速率,提高原料利用率或转化率
17. 在无土栽培中需用浓度为0.5mol/LNH4Cl、0.16mol/LKCl、0.24mol/LK2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是
A.0.4mol、0.5mol、0.12mol B.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24mol D.0.64mol、0.02mol、0.24mol
18. 量取100mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为
A.液体分层,上层为四氯化碳层,黄色 B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色 D.液体分层,下层为水层,黄色
19. 下列变化中不能通过一步反应就能实现的是
A.K2SiO3→H2SiO3 B.Si→Na2SiO3 C.SiO2→H2SiO3 D.SiO2→K2SiO3
20. 某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温、恒压的条件下,将此混合气体通过浓硫酸时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则混合气体的成份是
A、HCl、CO和CO2 B、HCl、H2和CO
C、CH4和NH3 D、HCl和CO
陕西省2009年高中学业水平考试模拟试题(卷)
化 学(二)
题 号 1 2 3 4 5 6 7 8 9 10
答 案
题 号 11 12 13 14 15 16 17 18 19 20
答 案
题 号 第一部分 第二部分 总 分
1—20 必答题 选答题
得 分
第二部分 (非选择题 共50分)
得 分 评卷人
三、必答题(本题包括5小题,计30分)
21.(4分)分子式为C4H10 的烃的所有的结构简式为
用系统命名法给予命名
22.(5分)欲用18 mol/L的浓硫酸(密度为1.84g/mL)配制成浓度为 0.5mol/L 的稀硫酸 500mL。
(1)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和_________ 。
(2)请将下列各操作按正确的序号填写在横线上__________。
A.用量筒量取浓硫酸 B.反复颠倒摇匀
C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签
E.稀释浓硫酸 F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为______mL;
②如果实验室有15mL 、20mL、50mL的量筒,应选用_____mL。
23. (8分)下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式回答:
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
二 ① ②
三 ③ ④ ⑤ ⑥ ⑦ ⑧
四 ⑨ ⑩
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为
⑵地壳中含量最多的金属元素是_______________.
⑶用电子式表示②与④形成化合物的过程 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
⑸写出⑤与氢氧化钠反应的化学方程式: 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
24.(8分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答:
(1)写出下列物质的化学式:乙 、丁 、戊 。
(2)写出甲物质在工业上的一种主要用途: 。
(3)写出A在元素周期表中的位置:第 周期,第 族。
(4)写出 A→乙+C反应的化学方式: 。
25.(5分)取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2克,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。试回答下列问题。
(1)加热后剩余固体物质成份是 (填化学式)。
(2)混合物中Na2CO3和NaHCO3的物质的量分别为多少。
得 分 评卷人
四、选答题(本题分三个模块,每个模块包括3道小题,计20分。考生任选一个模块作答,不跨模块计分。)
化学与生活(选修模块)
26. (6分) (1)某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠。其中属于调味剂的是_______,属于发色剂的是_______,属于防腐剂的是__________。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 亚硝酸钠 氯化钠
1.酸性条伯下的稳定性 微热时分解为NO和NO2 微热时不分解
2.熔点 271℃ 801℃
3.室温时的溶解度 约80g 约35g
请根据表中信息设计一种鉴别NaNO:和NaCl的方法,写出简单的操作过程、现象和结论:_________________________________________
27. (7分)为配合X市创建国家卫生城市活动,某校在综合实践活动中开展了相关研究。
(1)了解X市环境现状: 查阅环境质量监测报告:X市降水的pH年均值约为5.07,说明X市空气中 含量超标。饮用水源地水质为V类水质,主要超标项目为总氮、粪大肠菌群。其水质污染的原因可能是 (任答一个原因)。
(2)寻觅丰富丝绸文化 :X市以盛产蚕丝绸闻名,素有“丝绸之乡”之称。这里的“蚕丝”是指 (填序号) A.人造纤维 B.天然纤维C.合成纤维
(3)参与建设生态城市 :在社区调查中,居民提出了以下建议:①采取措施,减少和控制污染气体的排放;②禁止在河敞放鸭子,以免大量鸭粪污染河流;③植树造林,增大绿化面积;④就地焚烧垃圾,减少固体污染物。你认为合理的是 (填序号)。
28. (7分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的。
(2)微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________。
(3)人体摄入过多的食物时,会引起胃酸分泌过多,胃酸的pH下降,使人体感到不适,此时应服用消酸剂,双羟基铝酸钠就是一种常用的消酸剂,其化学式为NaAl(OH)2CO3,由于Al3+在人体内难以代谢,含量过高可导致老年痴呆症等疾病,为防止人体摄入过量铝元素,请提一
条合理的建议___________________________________________.
化学反应原理(选修模块)
26. (4分)将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:化学变化过程中的平衡状态可以通过改变反应条件而发生变化。对电离平衡、水解平衡、化学平衡等各种平衡移动的方向与外界条件变化的关系请你运用一句话进行总结:_______________________________________________。
问题2:1840年盖斯根据一系列实验事实得出规律:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g):△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g):△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:________ ____ 。
27. (8分)(1)在2mL0.1mol/L的NaCl溶液中,加入2mL0.1mol/L的AgNO3溶液,可观察到 ,此反应的离子方程式 。将此混合液过滤,滤渣加入2mL0.1mol/L的KI溶液,搅拌,可观察到 ,反应的离子方程式为 。
(2)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
28. (8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
有机化学基础(选修模块)
26. (5分)在下列物质中选择相应的序号填空:
①甲烷 ②乙烯 ③乙炔 ④甲苯 ⑤乙醇 ⑥乙酸乙酯
分子结构为正四面体的是
分子中含有碳碳三键的是
能发生水解反应 的是
在核磁共振氢谱中有三个吸收峰,且峰面积之比为1:2:3的是
能使酸性高锰酸钾溶液褪色,但不能使溴的四氯化碳溶液褪色的是
27. (8分)根据下面的反应路线及所给信息填空。
(1)A的结构简式是 。①的反应类型是 。②的反应类型是 。
(2)反应④的化学方程式是
。
28. (7分)化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系。试回答下列问题。
(1)A的名称是 。
(2)B的结构简式是 。
(3)D中含有的官能团(填名称) 。
(4)写出B和C生成A的化学方程式 。
参考答案:一、选择题(每小题2分,计20分)
1~5DCDAA 6~10 ABCCD
二、选择题(每小题3分,计30分)
11~15CCACB 16~20 BDCCD
三、必答题(本题包括5小题,计30分)
21.(4分)结构简式略 丁烷 2-甲基丙烷
22.(5分)(1) 500ml容量瓶
(2) AEFCBD (2分)
(3)① 13.6 ② 15
23.(共8分,每空1分,)
(1)Ar
(2)Al (3)
(4)HClO4 KOH Al(OH)3
24.(8分)
(1)NaAlO2、 AlCl3、 Al (OH)3 (各1分)
(2)冶炼金属铝的原料或做耐火材料(坩埚等)(1分)
(3)三,ⅢA (2分)
(4) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
25. (6分)(1)Na2CO3 (2) NaHCO3 0.2mol Na2CO3 0.5mol
四、选答题(本题包括3小题,计20分)
化学与生活(选修模块)(共20分)
26.(6分)(1)食盐,亚硝酸钠,笨甲酸钠(或苯甲酸钠和亚硝酸钠)各1分(共3分)
(2)溶于水制成溶液,加人稀硫酸微热,有棕色气体生成者,原物质为NaNO2,否则为NaCl;或用酒精灯加热,熔化者为NaNO2,不熔者为NaCl;或取两支试管,各加人5 mL水,分别溶解这两种物质,至不再溶解时,溶解量大的为亚硝酸钠,溶解量小的为氯化钠 3分
27.(7分) (1)二氧化硫、氮氧化物;(2分) 生活污水(2分)
(或工业废水、或农业用水等。答其它原因只要合理即可给分)
(2)B (1分) (3)①②③ (2分)
28.(7分)(1)蛋白质(2分)(2)碘、碘、缺铁性贫血(3分)(3)使用碳酸氢钠作为消酸剂(2分)
化学反应原理(选修模块)(共20分)
26.(4分)问题l:改变影响平衡的一个条件。平衡将向能够减弱这种改变的方向移动。(2分)
问题2:C(金刚石、s)=C(石墨、s):△H=-1.90kJ/mol. (2分)
27.(8分)(1)白色沉淀 Ag+ + Cl- = AgCl↓ 白色沉淀变为黄色沉淀 AgCl + I- = AgI↓ + Cl-
(2)酸,< ,Ag+ + H2O AgOH + H+ ,抑制
28.(共8分,每空各2分)
(1); (2)吸热;
(3)B、C; (4)830
有机化学基础(选修模块)(共20分)
26. (5分)(1)① (2)③ (3)⑥ (4)⑤ (5)④
27. (8分)(1) 取代反应 加成反应
(2) +2NaOH +2NaBr+2H2O
28. (7分)(1) 乙酸乙酯(2分) (2) CH3COOH (2分)
(3)醛基 (1分)
(4) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O (2分)
滴加NH3 H2O
C
乙
NaOH溶液
A
+B
甲
NaOH溶液
盐酸
乙
丁
丙
戊
+18888
8
2
8
Mg
F
F
F
Mg
2–
2
乙醇
△
PAGE
1
同课章节目录
