如皋市丁堰中学高一第二次规范练习(江苏省南通市如东县)
文档属性
| 名称 | 如皋市丁堰中学高一第二次规范练习(江苏省南通市如东县) |  | |
| 格式 | zip | ||
| 文件大小 | 35.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-02-12 18:00:00 | ||
图片预览



文档简介
如皋市丁堰中学高一第二次规范练习
化 学 试 题
本试卷中可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Fe—56 Cl—35.5 Zn—65 Al—27 Mg—24 Cu—64
第Ⅰ卷 选择题部分(48分)
一、选择题:(本小题共8小题,每小题3分,共24分,每小题只有一个正确答案)
1、关于合金性质的说法中,错误的是
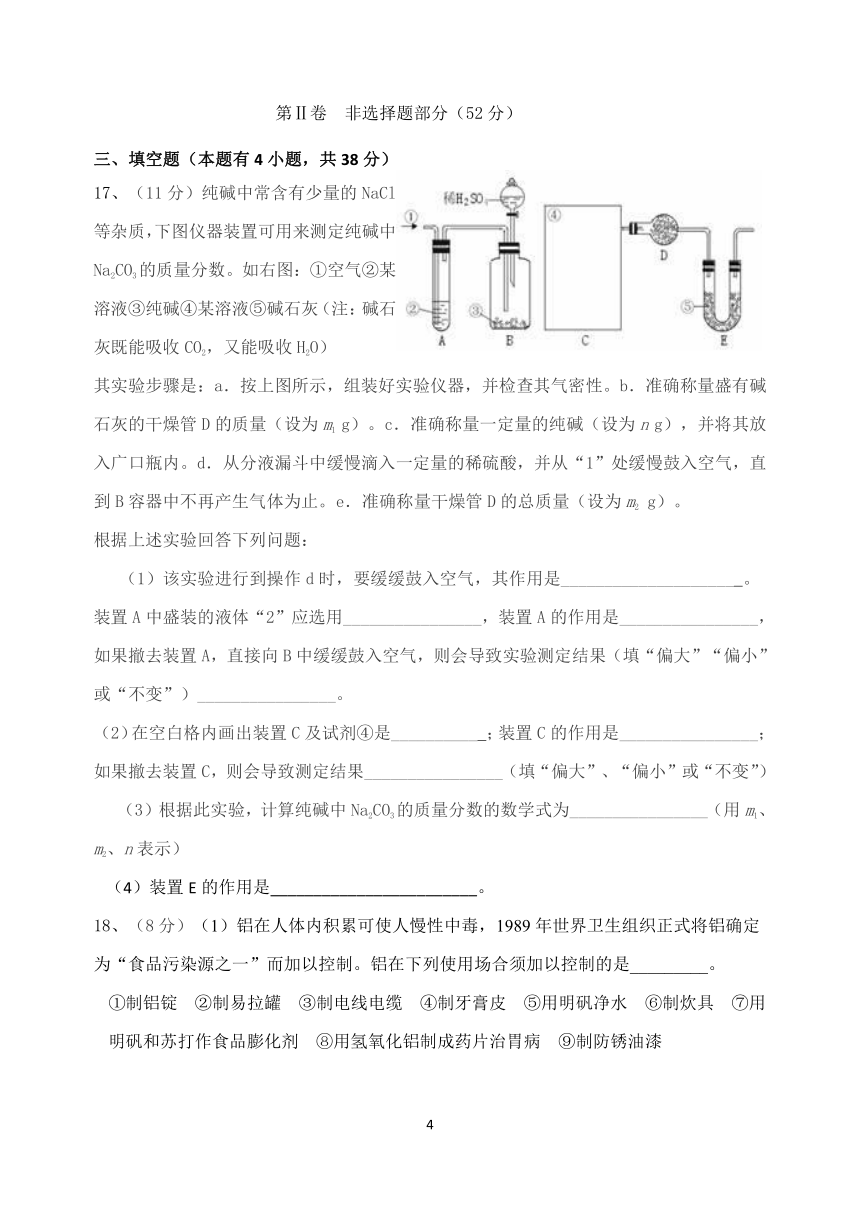
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
2、鉴别固体Na2CO3和NaHCO3,下列方法可行的是
A.分别配成溶液,再加入澄清石灰水
B.分别配成溶液,再加入氢氧化钠溶液
C.分别加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别配成溶液,再进行焰色反应
3、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
4、将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A.KSCN B.BaCl2 C.NaOH D.HCl
5、若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A. Fe3+、NO3、Cl、Na+ B.Ba2+、Mg2+、HCO3、AlO2
C.NO3、Na+、K+、CO32 D.NO3、K+、AlO2、OH
6、由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是
A.Na B.Mg C.Al D.Zn
7、在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
8、有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶溶液中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
二、选择题(有1-2个答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。共8小题,每小题3分,计24分。)
9、向CuSO4的溶液中投入一小块金属钠,可观察到的现象是
A、有较多的铜析出 B、有气体产生
C、有蓝色沉淀产生 D、有白色沉淀产生
10、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
11、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
12、下列关于金属铝的叙述中,说法不正确的是
A.Al 是地壳中含量最多的元素
B.Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.Al箔在空气中受热可以熔化,且发生剧烈燃烧
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
13、一定量的金属钠,进行如下实验,产生氢气最多的是
A、放入足量的盐酸中 B、放入足量的水中
C、放入足量的稀硫酸中 D、用铝箔包好,刺些小孔,放入足量水中
14、某物质灼烧时,焰色为黄色,下列判断正确的是
A、该物质一定是钠的化合物 B、该物质一定含钠元素
C、该物质一定是金属钠 D、不能确定该物质是否含钾元素
15、将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为%和%的两种溶液,则和的关系是
A.= B.> C.< D.无法确定
16、把CO2通入含NaOH0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A.0.44g B.0.88g C.0.66g D.都不是
第Ⅱ卷 非选择题部分(52分)
三、填空题(本题有4小题,共38分)
17、(11分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。如右图:①空气②某溶液③纯碱④某溶液⑤碱石灰(注:碱石灰既能吸收CO2,又能吸收H2O)
其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装置A中盛装的液体“2”应选用________________,装置A的作用是________________,如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是________________;如果撤去装置C,则会导致测定结果________________(填“偏大”、“偏小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________(用m1、m2、n表示)
(4)装置E的作用是________________________。
18、(8分)(1)铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合须加以控制的是_________。
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食品膨化剂 ⑧用氢氧化铝制成药片治胃病 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)小苏打的成分是NaHCO3,胃舒平中含有难溶性的Al(OH)3,它们都是治疗胃酸(主要成分是盐酸)过多的药物。写出有关反应的离子方程式:
、
。
胃穿孔患者若胃酸过多时,医生则禁止其服用小苏打,其原因是:
。
19、(11分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
沉淀固体B ;沉淀D 。
(3)写出①、②、③、④四个反应方程式
① ;② ;
③ ;④ 。
20、(8分) 已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
(2)写出下列反应的化学方程式:
反应①:
反应②:
四、计算题(本题有2小题,共14分)
21、在氯化铁和氯化铜的混合溶液中,加入过量的Fe粉,若充分反应后溶液的质量没有改变,则原混合溶液中Fe3+和Cu2+物质的量之比为多少
22、向20mL2mol/LAlCl3溶液中,加入30mLNaOH溶液,充分反应后,得0.78g沉淀,则NaOH溶液的物质的量浓度为多少
参考答案
D 2、c 3、A 4、C 5、B 6、D 7、D 8、D 9、BC 10、D 11、D 12、AC 13、D 14、BD15、A 16、C
17、(1)使纯碱和H2SO4反应产生的CO2全部排出;NaOH溶液;吸收空气中的CO2;偏大
(2)洗气瓶(图略);浓硫酸吸水;偏大
(3)%
(4)防止空气中的水汽和CO2进入D被吸收
18、(1)C (2)HCO3-+H+CO2↑+H2O Al(OH)3+3H+Al3++3H2O 因服用小苏打会产生大量的CO2气体而加速胃壁穿孔
19、(1)过滤
(2)Al2O3; Fe2O3;
(3)①Al2O3+2NaOH=2NaAlO2+H2O
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③NaAlO2+HCl+H2O=Al(OH) 3↓+NaCl
④2Al(OH) 3Al2O3+3H2O
20、(1)写出物质B、D的化学式:B:Fe3O4 D:FeCl3
(2)写出下列反应的化学方程式:
反应① 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
反应② 3Fe + 4H20(g) === Fe3O4 + 4H2
21、设反应前Fe3+为x mol,Cu2+为ymol,
2Fe3+十Fe3Fe2+ 溶液质量增加
2mol 3mol 56g
xmol 28 x g
Cu2+十FeFe2++Cu 溶液质量减少
1mol 8g
ymol 8y g
由28 xg=8yg得x :y=2:7 所以原混合溶液中Fe3+和Cu2+的物质的量之比为2:7
22、1mol/L 5mol/L;
姓名
班级
学号
X/△
Cl2
NaOH
NaOH
HCl
A
红褐色固体
B
D
F
E
C
反应①
O2
反应②
(ag)
(ag)
(ag)
△
PAGE
1
化 学 试 题
本试卷中可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Fe—56 Cl—35.5 Zn—65 Al—27 Mg—24 Cu—64
第Ⅰ卷 选择题部分(48分)
一、选择题:(本小题共8小题,每小题3分,共24分,每小题只有一个正确答案)
1、关于合金性质的说法中,错误的是
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
2、鉴别固体Na2CO3和NaHCO3,下列方法可行的是
A.分别配成溶液,再加入澄清石灰水
B.分别配成溶液,再加入氢氧化钠溶液
C.分别加热,再检验是否有使澄清石灰水变浑浊的气体产生
D.分别配成溶液,再进行焰色反应
3、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
4、将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A.KSCN B.BaCl2 C.NaOH D.HCl
5、若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是
A. Fe3+、NO3、Cl、Na+ B.Ba2+、Mg2+、HCO3、AlO2
C.NO3、Na+、K+、CO32 D.NO3、K+、AlO2、OH
6、由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是
A.Na B.Mg C.Al D.Zn
7、在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是
A.Fe B.FeO C.Fe(OH)3 D.Fe2O3
8、有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶溶液中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
二、选择题(有1-2个答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。共8小题,每小题3分,计24分。)
9、向CuSO4的溶液中投入一小块金属钠,可观察到的现象是
A、有较多的铜析出 B、有气体产生
C、有蓝色沉淀产生 D、有白色沉淀产生
10、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
11、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
12、下列关于金属铝的叙述中,说法不正确的是
A.Al 是地壳中含量最多的元素
B.Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.Al箔在空气中受热可以熔化,且发生剧烈燃烧
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
13、一定量的金属钠,进行如下实验,产生氢气最多的是
A、放入足量的盐酸中 B、放入足量的水中
C、放入足量的稀硫酸中 D、用铝箔包好,刺些小孔,放入足量水中
14、某物质灼烧时,焰色为黄色,下列判断正确的是
A、该物质一定是钠的化合物 B、该物质一定含钠元素
C、该物质一定是金属钠 D、不能确定该物质是否含钾元素
15、将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为%和%的两种溶液,则和的关系是
A.= B.> C.< D.无法确定
16、把CO2通入含NaOH0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A.0.44g B.0.88g C.0.66g D.都不是
第Ⅱ卷 非选择题部分(52分)
三、填空题(本题有4小题,共38分)
17、(11分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。如右图:①空气②某溶液③纯碱④某溶液⑤碱石灰(注:碱石灰既能吸收CO2,又能吸收H2O)
其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装置A中盛装的液体“2”应选用________________,装置A的作用是________________,如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是________________;如果撤去装置C,则会导致测定结果________________(填“偏大”、“偏小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________(用m1、m2、n表示)
(4)装置E的作用是________________________。
18、(8分)(1)铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合须加以控制的是_________。
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食品膨化剂 ⑧用氢氧化铝制成药片治胃病 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)小苏打的成分是NaHCO3,胃舒平中含有难溶性的Al(OH)3,它们都是治疗胃酸(主要成分是盐酸)过多的药物。写出有关反应的离子方程式:
、
。
胃穿孔患者若胃酸过多时,医生则禁止其服用小苏打,其原因是:
。
19、(11分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
沉淀固体B ;沉淀D 。
(3)写出①、②、③、④四个反应方程式
① ;② ;
③ ;④ 。
20、(8分) 已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:
(2)写出下列反应的化学方程式:
反应①:
反应②:
四、计算题(本题有2小题,共14分)
21、在氯化铁和氯化铜的混合溶液中,加入过量的Fe粉,若充分反应后溶液的质量没有改变,则原混合溶液中Fe3+和Cu2+物质的量之比为多少
22、向20mL2mol/LAlCl3溶液中,加入30mLNaOH溶液,充分反应后,得0.78g沉淀,则NaOH溶液的物质的量浓度为多少
参考答案
D 2、c 3、A 4、C 5、B 6、D 7、D 8、D 9、BC 10、D 11、D 12、AC 13、D 14、BD15、A 16、C
17、(1)使纯碱和H2SO4反应产生的CO2全部排出;NaOH溶液;吸收空气中的CO2;偏大
(2)洗气瓶(图略);浓硫酸吸水;偏大
(3)%
(4)防止空气中的水汽和CO2进入D被吸收
18、(1)C (2)HCO3-+H+CO2↑+H2O Al(OH)3+3H+Al3++3H2O 因服用小苏打会产生大量的CO2气体而加速胃壁穿孔
19、(1)过滤
(2)Al2O3; Fe2O3;
(3)①Al2O3+2NaOH=2NaAlO2+H2O
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③NaAlO2+HCl+H2O=Al(OH) 3↓+NaCl
④2Al(OH) 3Al2O3+3H2O
20、(1)写出物质B、D的化学式:B:Fe3O4 D:FeCl3
(2)写出下列反应的化学方程式:
反应① 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
反应② 3Fe + 4H20(g) === Fe3O4 + 4H2
21、设反应前Fe3+为x mol,Cu2+为ymol,
2Fe3+十Fe3Fe2+ 溶液质量增加
2mol 3mol 56g
xmol 28 x g
Cu2+十FeFe2++Cu 溶液质量减少
1mol 8g
ymol 8y g
由28 xg=8yg得x :y=2:7 所以原混合溶液中Fe3+和Cu2+的物质的量之比为2:7
22、1mol/L 5mol/L;
姓名
班级
学号
X/△
Cl2
NaOH
NaOH
HCl
A
红褐色固体
B
D
F
E
C
反应①
O2
反应②
(ag)
(ag)
(ag)
△
PAGE
1
同课章节目录
