化学能与热能
图片预览







文档简介
课件20张PPT。第一节 化学能与热能第二课时复习提问:1、下列反应属于吸热反应的有( )
A、煤的燃烧
B、碳与二氧化碳反应
C、锌与稀硫酸反应
D、氢氧化钡晶体与氯化铵晶体反应BD常见的放热反应和吸热反应常见的放热反应:
①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应
(特殊:C+CO2= 2CO是吸热反应)。常见的放热反应和吸热反应常见的吸热反应:
①以C、H2、CO为还原剂的氧化
还原反应如:
C(s)+H2O(g) = CO(g)+H2(g)。
②铵盐和碱的反应如:
Ba(OH)2·8H2+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、
CaCO3的分解等。2.微观:化学键的断裂和形成是化学反应中能量变化的主要原因一、化学键与化学反应中能量的关系1.断开化学键:吸收能量
形成化学键:放出能量反应物断键吸收能量之和<生成物成键放出能量之和: 放出能量反应物断键吸收能量之和>生成物成键放出能量之和: 吸收能量练习: 已知拆开1molH2中的化学键要吸收
436kJ的能量,拆开1molO2中的化学键要吸
收496 kJ的能量,形成水分子中的1molH-O键
要放出463 kJ的能量。
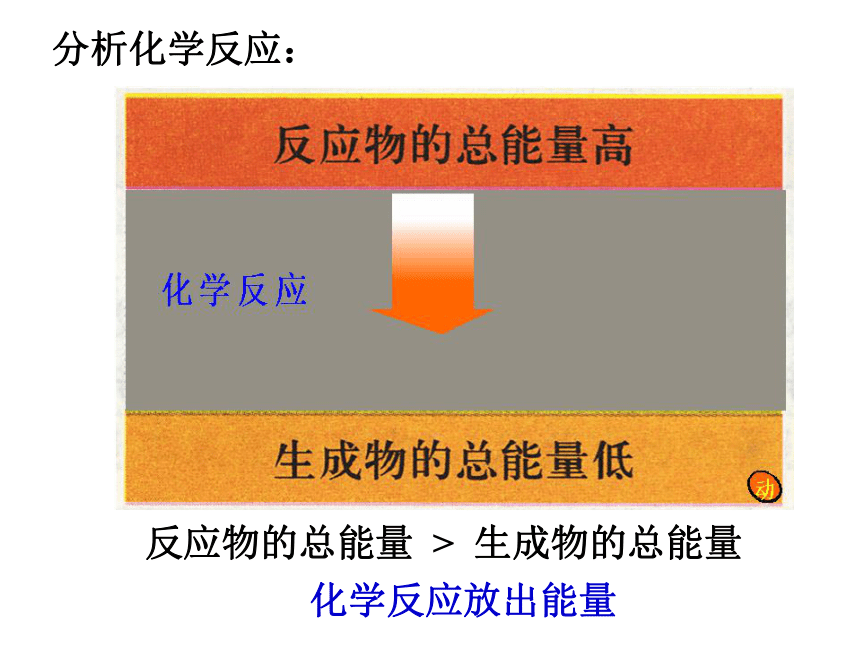
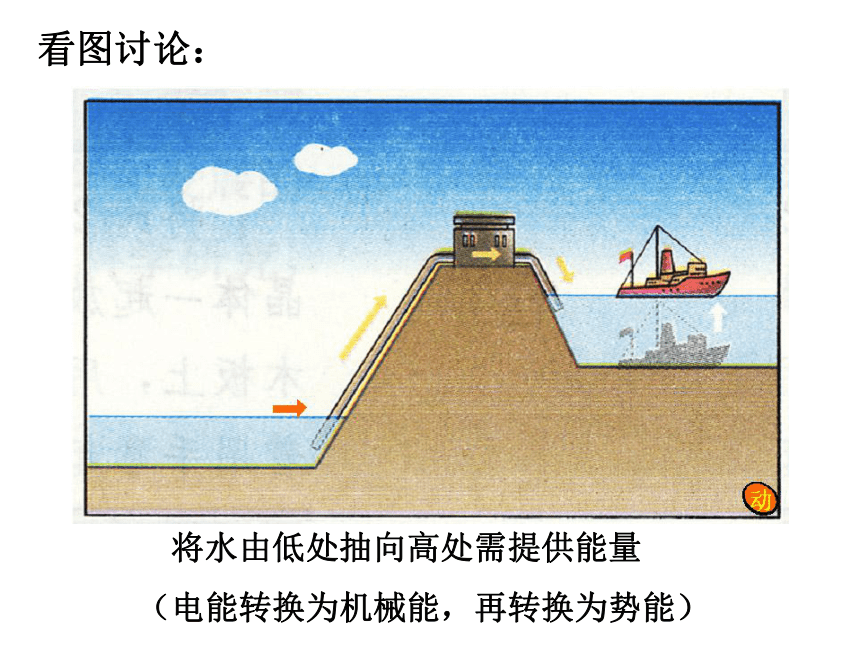
试说明2H2+O2=2H2O中的能量变化。思 考 如何从宏观的角度判断一个反应是吸收能量还是放出能量呢?看图讨论:水由高处向低处流要释放能量(势能转换为动能)分析化学反应:反应物的总能量 > 生成物的总能量化学反应放出能量看图讨论: 将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)分析化学反应:反应物的总能量 < 生成物的总能量化学反应吸收能量2.微观:化学键的断裂和形成是化学反应中能量变化的主要原因一、化学键与化学反应中能量的关系1.断键:吸收能量
成键:放出能量3.宏观:反应物的总能量与生成物的总能量间的相对大小,决定化学反应是吸收能量还是放出能量。反应物总能量>生成物总能量: 放出能量反应物总能量<生成物总能量: 吸收能量反应物断键吸收能量之和<生成物成键放出能量之和: 放出能量反应物断键吸收能量之和>生成物成键放出能量之和: 吸收能量化学反应的过程,可以看成是能量的“贮存”或“释放”的过程4、能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转
化的途径和能量形式可以不同,但是体系包含的总
能量不变,即总能量是守恒的,这就是能量守恒定律化学反应中的物质变化遵守质量守恒定律;
化学反应中的能量变化遵守能量守恒定律。
质量守恒定律和能量守恒定律是两条基本的自然定律。 中和热的概念:
酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。
思考与交流:注:(1)中和反应都放出热量
(2)稀溶液中,强酸与强碱的中和
热为定值:57.3KJ/mol[课堂练习] 1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应
B.灼热的炭与CO2反应
C.铝与稀盐酸
D.H2与O2的燃烧反应B2、已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( ) A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生C祝同学们学习进步
再见化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。
化学键是物质内部微粒之间强烈的相互作用,断开反应物中的化学
键需要吸收能量,形成生成物中的化学键要放出能量。氢气和氯气
反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H键和
Cl-Cl键断开,氢原子和氯原子通过形成H-Cl键而结合成HCl分子。
1molH2中含有1molH-H键,1mol Cl2中含有1mol Cl-Cl键,在25℃
和101kPa的条件下,断开1molH-H键要吸收436kJ的能量,断开
1mol Cl-Cl键要吸收242 kJ的能量,而形成1molHCl分子中的H-Cl键
会放出431 kJ的能量。这样,由于破坏旧键吸收的能量少于形成新键
放出的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。
[归纳小结]
1、 化学键的断裂和形成是化学反应中能量变化的主要原因。
2、 能量是守恒的。在反应H2 + Cl2 =2HCl中,已知
H-H 键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是 反应
放热课堂练习一则(1)化学键断裂时需要吸收能量。吸收总能量为:436kJ+247kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862 kJ,
(3)反应中放出的热量的计算:
862kJ—683kJ=179kJ实验2-2有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉。Ba(OH)2·8H2O与NH4Cl反应的过程吸收热量。
A、煤的燃烧
B、碳与二氧化碳反应
C、锌与稀硫酸反应
D、氢氧化钡晶体与氯化铵晶体反应BD常见的放热反应和吸热反应常见的放热反应:
①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应
(特殊:C+CO2= 2CO是吸热反应)。常见的放热反应和吸热反应常见的吸热反应:
①以C、H2、CO为还原剂的氧化
还原反应如:
C(s)+H2O(g) = CO(g)+H2(g)。
②铵盐和碱的反应如:
Ba(OH)2·8H2+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、
CaCO3的分解等。2.微观:化学键的断裂和形成是化学反应中能量变化的主要原因一、化学键与化学反应中能量的关系1.断开化学键:吸收能量
形成化学键:放出能量反应物断键吸收能量之和<生成物成键放出能量之和: 放出能量反应物断键吸收能量之和>生成物成键放出能量之和: 吸收能量练习: 已知拆开1molH2中的化学键要吸收
436kJ的能量,拆开1molO2中的化学键要吸
收496 kJ的能量,形成水分子中的1molH-O键
要放出463 kJ的能量。
试说明2H2+O2=2H2O中的能量变化。思 考 如何从宏观的角度判断一个反应是吸收能量还是放出能量呢?看图讨论:水由高处向低处流要释放能量(势能转换为动能)分析化学反应:反应物的总能量 > 生成物的总能量化学反应放出能量看图讨论: 将水由低处抽向高处需提供能量
(电能转换为机械能,再转换为势能)分析化学反应:反应物的总能量 < 生成物的总能量化学反应吸收能量2.微观:化学键的断裂和形成是化学反应中能量变化的主要原因一、化学键与化学反应中能量的关系1.断键:吸收能量
成键:放出能量3.宏观:反应物的总能量与生成物的总能量间的相对大小,决定化学反应是吸收能量还是放出能量。反应物总能量>生成物总能量: 放出能量反应物总能量<生成物总能量: 吸收能量反应物断键吸收能量之和<生成物成键放出能量之和: 放出能量反应物断键吸收能量之和>生成物成键放出能量之和: 吸收能量化学反应的过程,可以看成是能量的“贮存”或“释放”的过程4、能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转
化的途径和能量形式可以不同,但是体系包含的总
能量不变,即总能量是守恒的,这就是能量守恒定律化学反应中的物质变化遵守质量守恒定律;
化学反应中的能量变化遵守能量守恒定律。
质量守恒定律和能量守恒定律是两条基本的自然定律。 中和热的概念:
酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。
思考与交流:注:(1)中和反应都放出热量
(2)稀溶液中,强酸与强碱的中和
热为定值:57.3KJ/mol[课堂练习] 1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应
B.灼热的炭与CO2反应
C.铝与稀盐酸
D.H2与O2的燃烧反应B2、已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( ) A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生C祝同学们学习进步
再见化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。
化学键是物质内部微粒之间强烈的相互作用,断开反应物中的化学
键需要吸收能量,形成生成物中的化学键要放出能量。氢气和氯气
反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H键和
Cl-Cl键断开,氢原子和氯原子通过形成H-Cl键而结合成HCl分子。
1molH2中含有1molH-H键,1mol Cl2中含有1mol Cl-Cl键,在25℃
和101kPa的条件下,断开1molH-H键要吸收436kJ的能量,断开
1mol Cl-Cl键要吸收242 kJ的能量,而形成1molHCl分子中的H-Cl键
会放出431 kJ的能量。这样,由于破坏旧键吸收的能量少于形成新键
放出的能量,根据“能量守恒定律”,多余的能量就会以热量的形式释放出来。
[归纳小结]
1、 化学键的断裂和形成是化学反应中能量变化的主要原因。
2、 能量是守恒的。在反应H2 + Cl2 =2HCl中,已知
H-H 键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是 反应
放热课堂练习一则(1)化学键断裂时需要吸收能量。吸收总能量为:436kJ+247kJ=683 kJ,
(2)化学键形成时需要释放能量。释放总能量为:431kJ+431kJ=862 kJ,
(3)反应中放出的热量的计算:
862kJ—683kJ=179kJ实验2-2有刺激性气味气体产生;玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉。Ba(OH)2·8H2O与NH4Cl反应的过程吸收热量。
