原电池的工作原理 练习
图片预览

文档简介
普通高中课程标准实验教科书--化学选修4[江苏版]
课时练习4 原电池的工作原理
1.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是 ( )
A.正极附近的SO42—离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
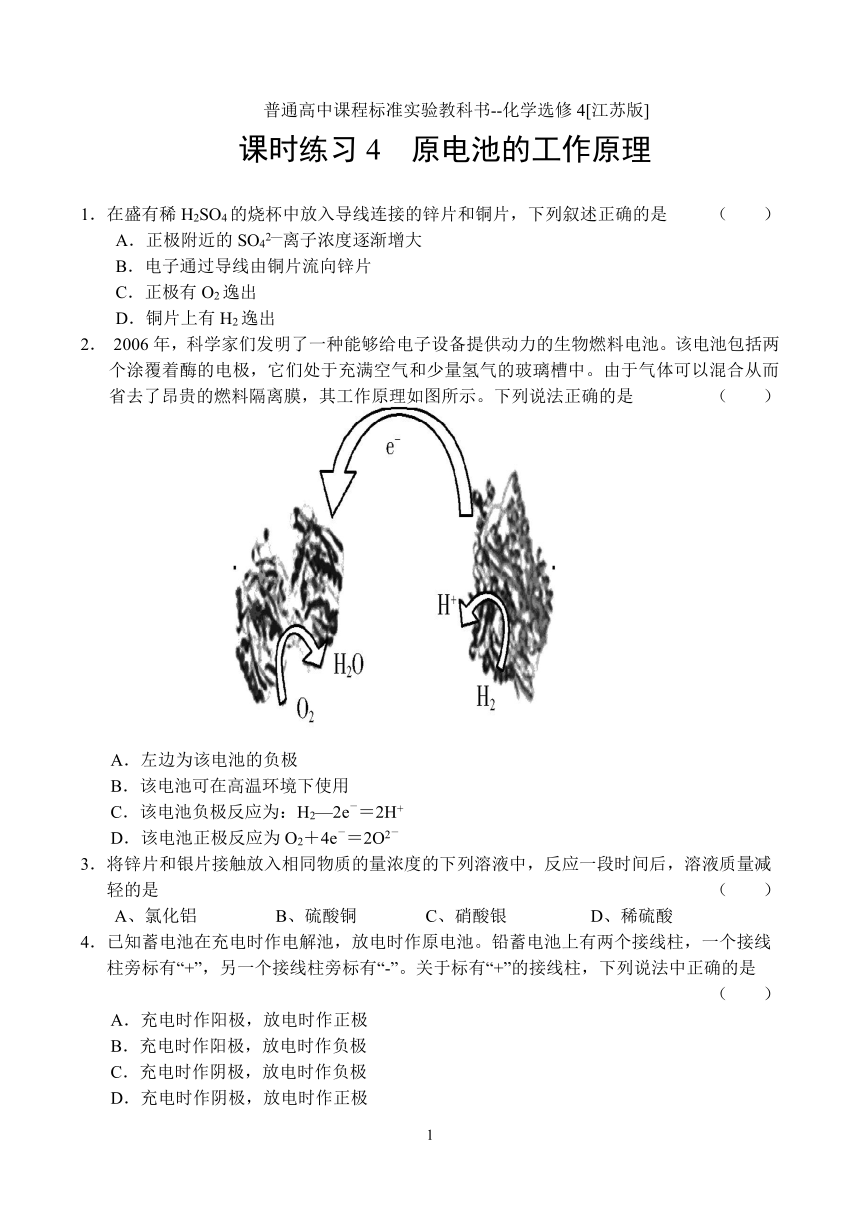
2. 2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料 ( http: / / info.pf. / Html / zt / ranshao / index.htm" \t "_blank )电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃 ( http: / / info.bm. / list / zt050127.shtml" \t "_blank )槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是 ( )
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
3.将锌片和银片接触放入相同物质的量浓度的下列溶液中,反应一段时间后,溶液质量减
轻的是 ( )
A、氯化铝 B、硫酸铜 C、硝酸银 D、稀硫酸
4.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线
柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是
( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
5.下列事实不能说明Al的金属活动性比Cu强的是 ( )
A.常温下将铝投入CuSO4溶液中
B.常温下将铝和铜用导线连接一起放入到稀盐酸溶液中
C.常温下将铝和铜不用导线连接一起放入到稀盐酸溶液中
D.常温下将铝和铜用导线连接一起放入到氢氧化钠溶液中
6.铁钉和碳棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能发生 ( )
A、碳棒上放出Cl2 B、碳棒附近产生OH-
C、碳棒上放出O2 D、铁钉被氧化
7.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,
不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
8.普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是 ( )
A.普通水泥的主要成分是2CaO·SiO2,
3CaO·SiO2和3CaO·Al2O3
B.测量原理示意图中,Ag2O为负极
C.正极的电极反应为:2Cu+2OH--2e-=Cu2O+H2O
D.电池工作时, OH-向正极移动
9.2007年1月8日,国防科工委举行新闻发布会,明确承认“中国具备制造航空母舰的能力”.初步计划,预计国产大功率镍氢动力电池将在制造航空母舰中发挥作用。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6
+ 6NiOOH LaNi5 + 6Ni(OH)2下列说法不正确的是 ( )
A.放电时储氢合金作负极
B.充电时储氢合金作阴极
C.1mol LaNi5H6参加放电,能提供12mol电子。
D.充电是将电能能转化为化学的过程。
10.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6 CoO2 + LiC6 ,下列说法正确的是
( )
A.充电时,电池的负极反应为LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
11.目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以能使Na+自由通过而导电的β—Al2O3陶瓷作固体电解质,反应式为:2Na+xSNa2Sx。
(1)放电时正负极的电极反应式:
正极反应式:_______________________;负极反应式:______________________。
(2)用该电池作电源进行电解含有0.2molCuSO4和0.2molNaCl的混合溶液500ml时,若此
电池工作一段时间后消耗23gNa。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2L,溶液的pH为:________。
12.化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。你认为可燃冰晶体的类别及理由:
____ 。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决能源紧缺问题的两点建议 。
13.银器皿日久表面逐渐变黑色,这是由于生成硫代银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。
试回答:在此原电池反应中,负极发生的反应为 ;正极发生的反应为 ;
反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为
14.从某铝镁合金上剪下一小片(其质量为2.0g),立刻投入盛有20mL5mol·L-1氢氧化钠溶液的小烧杯中。
(1)由反应开始到反应结束,可能观察到烧杯中的现象依次为 。
(2)反应开始时,合金片表面产生气泡较慢,其原因是 ,一段时间后反应速率相当快,其原因是 。
(3)写出合金片与溶液反应时可能形成的微电池的负极材料是 ,正极的电极反应式: 。
(4)若要利用该反应来测定合金中铝的质量分数,还应测定哪些数据(如有多种可能,请逐一写出)?答: 。
15.有人设计以铂和锌为电极材料,埋入人体作某种心脏病人的心脏起搏器的能源,它依靠人体血液中有一定浓度的O2和H2O进行工作。
(1)正极材料是 ,电极反应为 。
(2)负极材料是 ,电极反应为 。
16、由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少。
原电池参考答案
1.D 2.C 3.C 4.A 5.D 6.BD 7.D 8.A 9.C 10.B
11.⑴xS+2e-= (2分);2Na-2e-=2Na+
(2)6.72;1
12.(1)该晶体是分子晶体,理由为“可燃冰”熔沸点较低
(2)①O2+4e-=2 O2– 向负极移动②固体碳(或炭粒)
(3)寻找新能源,提高燃料的燃烧效率等
13.Al-3e-=Al3+ Ag2S+2e-=2Ag+S2-
3Ag2S+2Al+6H2O=6Ag+2Al(OH)3↓+3H2S↑
14、(1)切口断面上先产生少量气泡;氧化膜能溶于NaOH溶液导致反应会逐渐加快;后来反应剧烈,产生气体较多,导致小合金片在溶液中上下翻动;反应放热导致溶液会发烫;烧杯底会有少量黑色固体残留。
(2)影响反应速率的因素有多方面。开始时由于表面氧化膜存在,反应速率慢,后来氧化膜溶解,NaOH浓度大,铝镁合金片表面形成原电池,反应放热使溶液温度升高等因素综合起来,使反应速率加快。
(3)铝;6H2O+6e- 3H2↑+6OH-。
(4)至少有以下四种可能测出任一个值都可计算出铝的质量分数:(a)测定残留固体质量;(b)测定产生H2的体积;(c)测定生成的NaAlO2的物质的量;(d)测定反应后溶液中NaOH的浓度。
15.(1)铂 O2+2H2O+4e-4OH-
(2)锌 Zn-2e-Zn2+
16、(1)9.75g (2)1.846×1023个 (3)0.75mol·L-1
PAGE
5
课时练习4 原电池的工作原理
1.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是 ( )
A.正极附近的SO42—离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
2. 2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料 ( http: / / info.pf. / Html / zt / ranshao / index.htm" \t "_blank )电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃 ( http: / / info.bm. / list / zt050127.shtml" \t "_blank )槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是 ( )
A.左边为该电池的负极
B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
3.将锌片和银片接触放入相同物质的量浓度的下列溶液中,反应一段时间后,溶液质量减
轻的是 ( )
A、氯化铝 B、硫酸铜 C、硝酸银 D、稀硫酸
4.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线
柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是
( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
5.下列事实不能说明Al的金属活动性比Cu强的是 ( )
A.常温下将铝投入CuSO4溶液中
B.常温下将铝和铜用导线连接一起放入到稀盐酸溶液中
C.常温下将铝和铜不用导线连接一起放入到稀盐酸溶液中
D.常温下将铝和铜用导线连接一起放入到氢氧化钠溶液中
6.铁钉和碳棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能发生 ( )
A、碳棒上放出Cl2 B、碳棒附近产生OH-
C、碳棒上放出O2 D、铁钉被氧化
7.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,
不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
8.普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是 ( )
A.普通水泥的主要成分是2CaO·SiO2,
3CaO·SiO2和3CaO·Al2O3
B.测量原理示意图中,Ag2O为负极
C.正极的电极反应为:2Cu+2OH--2e-=Cu2O+H2O
D.电池工作时, OH-向正极移动
9.2007年1月8日,国防科工委举行新闻发布会,明确承认“中国具备制造航空母舰的能力”.初步计划,预计国产大功率镍氢动力电池将在制造航空母舰中发挥作用。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6
+ 6NiOOH LaNi5 + 6Ni(OH)2下列说法不正确的是 ( )
A.放电时储氢合金作负极
B.充电时储氢合金作阴极
C.1mol LaNi5H6参加放电,能提供12mol电子。
D.充电是将电能能转化为化学的过程。
10.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6 CoO2 + LiC6 ,下列说法正确的是
( )
A.充电时,电池的负极反应为LiC6 - e- == Li + C6
B.放电时,电池的正极反应为 CoO2 + Li+ + e- == LiCoO2 ,
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
11.目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以能使Na+自由通过而导电的β—Al2O3陶瓷作固体电解质,反应式为:2Na+xSNa2Sx。
(1)放电时正负极的电极反应式:
正极反应式:_______________________;负极反应式:______________________。
(2)用该电池作电源进行电解含有0.2molCuSO4和0.2molNaCl的混合溶液500ml时,若此
电池工作一段时间后消耗23gNa。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2L,溶液的pH为:________。
12.化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。你认为可燃冰晶体的类别及理由:
____ 。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O2――26e―=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决能源紧缺问题的两点建议 。
13.银器皿日久表面逐渐变黑色,这是由于生成硫代银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。
试回答:在此原电池反应中,负极发生的反应为 ;正极发生的反应为 ;
反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为
14.从某铝镁合金上剪下一小片(其质量为2.0g),立刻投入盛有20mL5mol·L-1氢氧化钠溶液的小烧杯中。
(1)由反应开始到反应结束,可能观察到烧杯中的现象依次为 。
(2)反应开始时,合金片表面产生气泡较慢,其原因是 ,一段时间后反应速率相当快,其原因是 。
(3)写出合金片与溶液反应时可能形成的微电池的负极材料是 ,正极的电极反应式: 。
(4)若要利用该反应来测定合金中铝的质量分数,还应测定哪些数据(如有多种可能,请逐一写出)?答: 。
15.有人设计以铂和锌为电极材料,埋入人体作某种心脏病人的心脏起搏器的能源,它依靠人体血液中有一定浓度的O2和H2O进行工作。
(1)正极材料是 ,电极反应为 。
(2)负极材料是 ,电极反应为 。
16、由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少。
原电池参考答案
1.D 2.C 3.C 4.A 5.D 6.BD 7.D 8.A 9.C 10.B
11.⑴xS+2e-= (2分);2Na-2e-=2Na+
(2)6.72;1
12.(1)该晶体是分子晶体,理由为“可燃冰”熔沸点较低
(2)①O2+4e-=2 O2– 向负极移动②固体碳(或炭粒)
(3)寻找新能源,提高燃料的燃烧效率等
13.Al-3e-=Al3+ Ag2S+2e-=2Ag+S2-
3Ag2S+2Al+6H2O=6Ag+2Al(OH)3↓+3H2S↑
14、(1)切口断面上先产生少量气泡;氧化膜能溶于NaOH溶液导致反应会逐渐加快;后来反应剧烈,产生气体较多,导致小合金片在溶液中上下翻动;反应放热导致溶液会发烫;烧杯底会有少量黑色固体残留。
(2)影响反应速率的因素有多方面。开始时由于表面氧化膜存在,反应速率慢,后来氧化膜溶解,NaOH浓度大,铝镁合金片表面形成原电池,反应放热使溶液温度升高等因素综合起来,使反应速率加快。
(3)铝;6H2O+6e- 3H2↑+6OH-。
(4)至少有以下四种可能测出任一个值都可计算出铝的质量分数:(a)测定残留固体质量;(b)测定产生H2的体积;(c)测定生成的NaAlO2的物质的量;(d)测定反应后溶液中NaOH的浓度。
15.(1)铂 O2+2H2O+4e-4OH-
(2)锌 Zn-2e-Zn2+
16、(1)9.75g (2)1.846×1023个 (3)0.75mol·L-1
PAGE
5
