物质结构元素周期律课件
图片预览











文档简介
课件34张PPT。第一章 物质结构 元素周期律 2019/2/27
收集整理考纲要求1.元素、核素和同位素的含义(了解)
2.原子结构; (了解)
原子序数、核电荷数、质子数、中子数、核外电子数、以及它们之间的相互关系(掌握)
3.原子核外电子排布(理解)
4.化学键的定义;离子键、共价键的形成 (理解)物质结构1.元素周期律的实质 (了解)
2.元素周期表(长式)的结构(周期、族) (了解)
3.金属、非金属在元素周期表中的位置及其性质递变的规律(理解)
4.同一周期内元素性质的递变规律与原子结构的关系(理解)
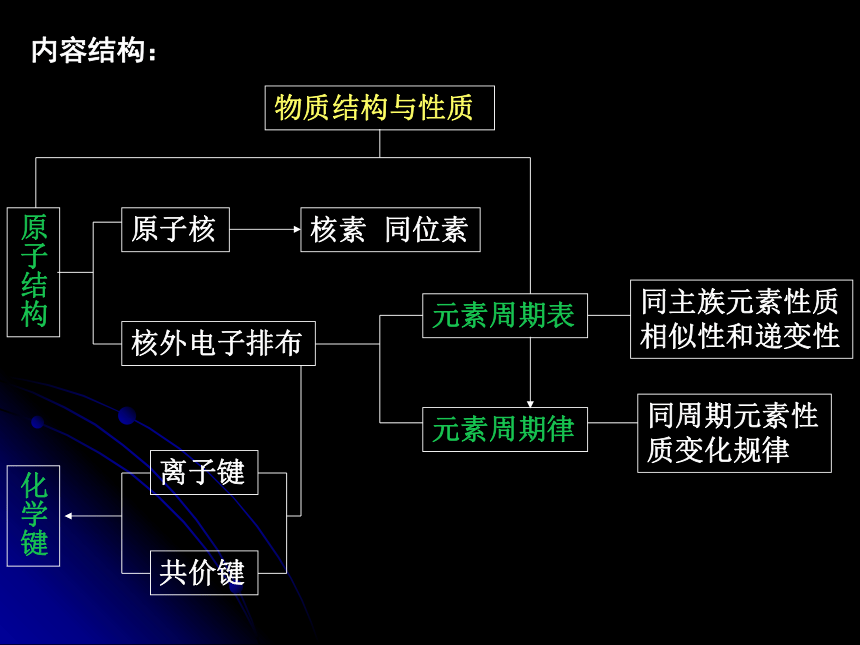
5.同一主族内元素性质的低变规律与原子结构的关系(理解)元素周期律和元素周期表 物质结构与性质原子核核素 同位素原子结构化学键核外电子排布元素周期表元素周期律同主族元素性质相似性和递变性同周期元素性质变化规律离子键共价键内容结构:第一节元素周期表1、1869年,化学家门捷列夫(R)制出第一张元素周期表。2、原子序数 = 核电荷数 = 质子数 = 核外电子数一、元素周期表原子序数:按照元素原子中核电荷数的顺序给元素 编号,得到原子序数。3、元素周期表的结构 (1)周期:
①周期的定义:在元素周期表中,把原子的 相同的元素,按原子序数递增的顺序从左到右排成横行,叫做 ;共有 个横行,即 。
②周期数与原子结构的关系:同一周期内的所有元素,原子的 相同; 周期的序数等于该周期内元素的 。在同一周期内,从左到右原子序数 。电子层数目周期7七个周期 名称分别为第一至第七周期分别有2、8、8、18、18、32、26种元素,其中一、二、三周期为短周期,四、五、六周期为长周期,第七周期为不完全周期。电子层数电子层数逐渐递增3、元素周期表的结构 (2)族:
①族的定义:在元素周期表中,把不同横行(即周期)中原子的 相同的元素按照 递增的顺序由上而下排成纵行,叫做 ;现在常用的元素周期表有18个纵行,被划分为16个族。(长式周期表)
②主族和0族元素原子结构特点:主族的序数与该主族内元素的 相同。 0族元素最外层电子数为 。外围电子数电子层数族族的序数一般用罗马数字I、II、III、IV、V、VI、VII、VIII来表示,零族的序数记为0。主族的序数后标A,副族的序数后标B。 最外层电子数2或8元素周期表与原子结构的关系
周期序数= 。
主族序数= = ______________
主族元素的最低负化合价=8 - 。 电子层数 最外层电子数 最高正化合价 主族序数 熟悉元素周期表,
能画出1—20号
元素的位置 元素的性质与________ 有密切的关系,主要与____________________,特别是______________有关。原子核外电子的排布原子结构 最外层电子数三、核素2、质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,该数值即为质量数。质量数(A)= 质子数(Z)+ 中子数(N)1、元素:具有相同质子数的一类原子的总称。一)几个概念如:1H、2H、3H;12C、14C4、同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。(同一种元素的不同核素互称为同位素)3、核素:把具有一定数目的质子和一定数目的中子的一种原子叫做核素。(1)元素、核素与同位素的关系:(2) 同位素的性质: 同位素的各核素的核外电子数相同,化学性质几乎相同 。二)理解同位素的概念: (3)同位素的应用:同位素在日常生活、工农业生产和科学研究中有着重要的用途,如考古时利用( ) 测定一些文物的年代,( )用于制造氢弹,利用( )育种,治疗癌症和肿瘤。放射性元素三)原子结构知识
原子的表示
1、原子( X)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=ZA-ZZ 质子数+中子数Az (2)原子序数 = 核电荷数 = 质子数 = 核外电子数a——代表质量数;
b——代表核电荷数;
c——代表离子的所带电荷数;
d——代表化合价;
e ——代表原子个数a、b、c、d、e各代表什么? 1、1H、2H、3H、H+、H2是( )
A.氢的5种同位素
B.5种氢元素
C.氢的5种同素异形体
D.氢元素的5种不同微粒D练习B3、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B.金刚石和足球烯C60???
C.H2O和D2O???? D.16O和18OD 第二节元素周期律一、原子核外电子的排布1、电子层2、原子核外电子排布的规律1).从内层向外层 ,
2).原子核外最外层电子数不超过 。能量由低向高。8 个(当K层为最外层时不超过2个) 原子核外次外层电子数不超过18个;倒数第三层电子数不超过32个。3).每层最多容纳的电子数2n2个。
n=1,2,3,4时,最多可容纳的电子数分别是:2,8,18,32。元素周期律的内容: 元素的性质随着原子序数的递增呈周期性的变化。元素周期律的实质: 元素的性质周期性变化是元素的原子核外电子排布呈周期性变化的必然结果。二、元素周期律大→小小→大逐渐减小
逐渐增大逐渐增大
逐渐减小金属性递减、
非金属性递增金属性递增、非金属性递减电子层数相同、最外层电子增多电子层增多最外层电子数相同酸性增强碱性减弱减弱气态氢化物稳定性增强最高价氧化物对应的水化物碱性增强酸性减弱(1)是学习和研究化学的一种重要工具。?
(2)为新元素的发现及预测它们的原子结构和性质提供了新的线索。?
(3)启发人们在周期表中一定的区域内,寻找新的物质。 3、元素周期律及元素周期表的其他应用 1.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. O、N、F
C. P、Si、Al D. C、Si、P2.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化练习:AA3、据报道,月球上有大量3He存在。以下有关3He的说法正确的是( )
A、原子核外有2个电子层 B、最外层电子层上有2个电子
C、比4He多1个中子 D、比4He少1个质子4、下列性质的递变中,正确的是( )?
A、O、S、Na的原子半径依次增大
B、LiOH、KOH、CsOH的碱性依次减弱?
C、HF、NH3、SiH4的稳定性依次增强
D、HCl、HBr、HI的还原性依次减弱 BAD第三节 化学键一、离子键1、定义:带相反电荷离子之间的相互作用称为离子键。2、形成范围:活泼金属与活泼非金属之间。3、离子化合物:含有离子键的化合物叫做离子化合物。4、电子式:元素符号周围用“?”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式。5、含离子键的化合物:NaCl、KCl、NH4Cl、NaOH等。判断离子键或离子化合物的方法:
含有金属离子或NH4+ 化合物二、共价键1、定义:原子间通过共用电子对所形成的相互作用。2、形成条件:
1)同种或不同种非金属元素原子结合;
2)部分金属元素元素原子与非金属元素原子, 如AlCl3 3、共价化合物:只含共价键的化合物。如:H—Cl、H—F键等为极性键;H—H、Cl—Cl键等为非极性键。5、共价键可分为极性键和非极性键。4、共价键的存在:HCl、H2等,一些离子化合物中,如NaOH、Na2O2等。同种原子之间形成的共价键不同种原子之间形成的共价键三、化学键1、定义;使离子相结合或原子相结合的作用力通称为化学键。2、离子键和共价键通称为化学键。3、化学反应的实质:旧化学键断裂,新化学键形成的过程。5、氢键:象NH3、H2O、HF分子间存在着比分子间作用力稍强的相互作用称为氢键。也比化学键弱得多。4、分子间作用力;把分子聚集在一起的作用力称为分子间作用力(又称范德华力)。比化学键弱得多。分子间作用力和氢键不属于化学键
收集整理考纲要求1.元素、核素和同位素的含义(了解)
2.原子结构; (了解)
原子序数、核电荷数、质子数、中子数、核外电子数、以及它们之间的相互关系(掌握)
3.原子核外电子排布(理解)
4.化学键的定义;离子键、共价键的形成 (理解)物质结构1.元素周期律的实质 (了解)
2.元素周期表(长式)的结构(周期、族) (了解)
3.金属、非金属在元素周期表中的位置及其性质递变的规律(理解)
4.同一周期内元素性质的递变规律与原子结构的关系(理解)
5.同一主族内元素性质的低变规律与原子结构的关系(理解)元素周期律和元素周期表 物质结构与性质原子核核素 同位素原子结构化学键核外电子排布元素周期表元素周期律同主族元素性质相似性和递变性同周期元素性质变化规律离子键共价键内容结构:第一节元素周期表1、1869年,化学家门捷列夫(R)制出第一张元素周期表。2、原子序数 = 核电荷数 = 质子数 = 核外电子数一、元素周期表原子序数:按照元素原子中核电荷数的顺序给元素 编号,得到原子序数。3、元素周期表的结构 (1)周期:
①周期的定义:在元素周期表中,把原子的 相同的元素,按原子序数递增的顺序从左到右排成横行,叫做 ;共有 个横行,即 。
②周期数与原子结构的关系:同一周期内的所有元素,原子的 相同; 周期的序数等于该周期内元素的 。在同一周期内,从左到右原子序数 。电子层数目周期7七个周期 名称分别为第一至第七周期分别有2、8、8、18、18、32、26种元素,其中一、二、三周期为短周期,四、五、六周期为长周期,第七周期为不完全周期。电子层数电子层数逐渐递增3、元素周期表的结构 (2)族:
①族的定义:在元素周期表中,把不同横行(即周期)中原子的 相同的元素按照 递增的顺序由上而下排成纵行,叫做 ;现在常用的元素周期表有18个纵行,被划分为16个族。(长式周期表)
②主族和0族元素原子结构特点:主族的序数与该主族内元素的 相同。 0族元素最外层电子数为 。外围电子数电子层数族族的序数一般用罗马数字I、II、III、IV、V、VI、VII、VIII来表示,零族的序数记为0。主族的序数后标A,副族的序数后标B。 最外层电子数2或8元素周期表与原子结构的关系
周期序数= 。
主族序数= = ______________
主族元素的最低负化合价=8 - 。 电子层数 最外层电子数 最高正化合价 主族序数 熟悉元素周期表,
能画出1—20号
元素的位置 元素的性质与________ 有密切的关系,主要与____________________,特别是______________有关。原子核外电子的排布原子结构 最外层电子数三、核素2、质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,该数值即为质量数。质量数(A)= 质子数(Z)+ 中子数(N)1、元素:具有相同质子数的一类原子的总称。一)几个概念如:1H、2H、3H;12C、14C4、同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。(同一种元素的不同核素互称为同位素)3、核素:把具有一定数目的质子和一定数目的中子的一种原子叫做核素。(1)元素、核素与同位素的关系:(2) 同位素的性质: 同位素的各核素的核外电子数相同,化学性质几乎相同 。二)理解同位素的概念: (3)同位素的应用:同位素在日常生活、工农业生产和科学研究中有着重要的用途,如考古时利用( ) 测定一些文物的年代,( )用于制造氢弹,利用( )育种,治疗癌症和肿瘤。放射性元素三)原子结构知识
原子的表示
1、原子( X)中,质子有 个,中子有 个,核外电子有 个。
2、相互关系
(1)??质量数=ZA-ZZ 质子数+中子数Az (2)原子序数 = 核电荷数 = 质子数 = 核外电子数a——代表质量数;
b——代表核电荷数;
c——代表离子的所带电荷数;
d——代表化合价;
e ——代表原子个数a、b、c、d、e各代表什么? 1、1H、2H、3H、H+、H2是( )
A.氢的5种同位素
B.5种氢元素
C.氢的5种同素异形体
D.氢元素的5种不同微粒D练习B3、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B.金刚石和足球烯C60???
C.H2O和D2O???? D.16O和18OD 第二节元素周期律一、原子核外电子的排布1、电子层2、原子核外电子排布的规律1).从内层向外层 ,
2).原子核外最外层电子数不超过 。能量由低向高。8 个(当K层为最外层时不超过2个) 原子核外次外层电子数不超过18个;倒数第三层电子数不超过32个。3).每层最多容纳的电子数2n2个。
n=1,2,3,4时,最多可容纳的电子数分别是:2,8,18,32。元素周期律的内容: 元素的性质随着原子序数的递增呈周期性的变化。元素周期律的实质: 元素的性质周期性变化是元素的原子核外电子排布呈周期性变化的必然结果。二、元素周期律大→小小→大逐渐减小
逐渐增大逐渐增大
逐渐减小金属性递减、
非金属性递增金属性递增、非金属性递减电子层数相同、最外层电子增多电子层增多最外层电子数相同酸性增强碱性减弱减弱气态氢化物稳定性增强最高价氧化物对应的水化物碱性增强酸性减弱(1)是学习和研究化学的一种重要工具。?
(2)为新元素的发现及预测它们的原子结构和性质提供了新的线索。?
(3)启发人们在周期表中一定的区域内,寻找新的物质。 3、元素周期律及元素周期表的其他应用 1.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. O、N、F
C. P、Si、Al D. C、Si、P2.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化练习:AA3、据报道,月球上有大量3He存在。以下有关3He的说法正确的是( )
A、原子核外有2个电子层 B、最外层电子层上有2个电子
C、比4He多1个中子 D、比4He少1个质子4、下列性质的递变中,正确的是( )?
A、O、S、Na的原子半径依次增大
B、LiOH、KOH、CsOH的碱性依次减弱?
C、HF、NH3、SiH4的稳定性依次增强
D、HCl、HBr、HI的还原性依次减弱 BAD第三节 化学键一、离子键1、定义:带相反电荷离子之间的相互作用称为离子键。2、形成范围:活泼金属与活泼非金属之间。3、离子化合物:含有离子键的化合物叫做离子化合物。4、电子式:元素符号周围用“?”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式。5、含离子键的化合物:NaCl、KCl、NH4Cl、NaOH等。判断离子键或离子化合物的方法:
含有金属离子或NH4+ 化合物二、共价键1、定义:原子间通过共用电子对所形成的相互作用。2、形成条件:
1)同种或不同种非金属元素原子结合;
2)部分金属元素元素原子与非金属元素原子, 如AlCl3 3、共价化合物:只含共价键的化合物。如:H—Cl、H—F键等为极性键;H—H、Cl—Cl键等为非极性键。5、共价键可分为极性键和非极性键。4、共价键的存在:HCl、H2等,一些离子化合物中,如NaOH、Na2O2等。同种原子之间形成的共价键不同种原子之间形成的共价键三、化学键1、定义;使离子相结合或原子相结合的作用力通称为化学键。2、离子键和共价键通称为化学键。3、化学反应的实质:旧化学键断裂,新化学键形成的过程。5、氢键:象NH3、H2O、HF分子间存在着比分子间作用力稍强的相互作用称为氢键。也比化学键弱得多。4、分子间作用力;把分子聚集在一起的作用力称为分子间作用力(又称范德华力)。比化学键弱得多。分子间作用力和氢键不属于化学键
