元素周期表及其应用
图片预览






文档简介
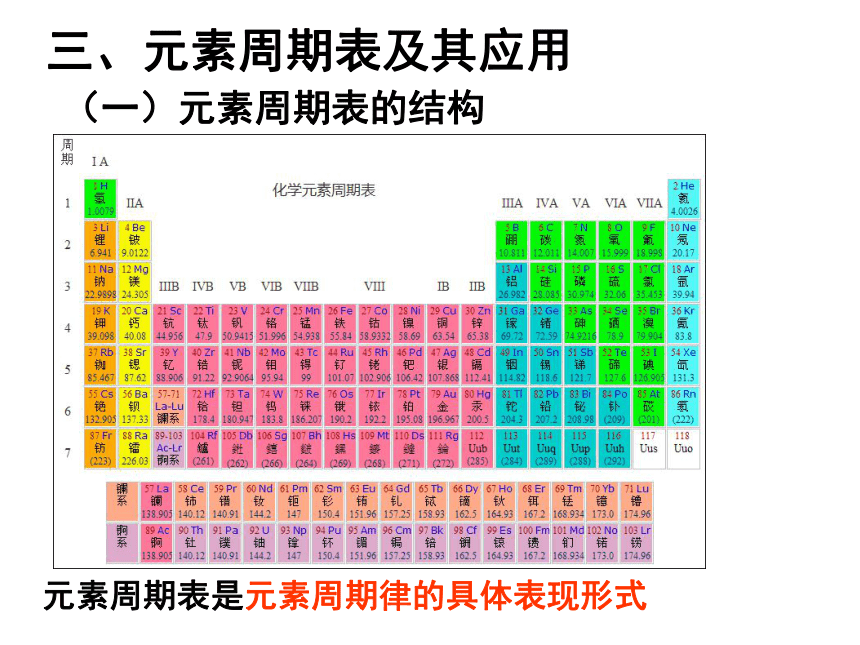
课件24张PPT。元素周期表及其应用法国人布瓦博德朗于1875年发现的三、元素周期表及其应用元素周期表是元素周期律的具体表现形式(一)元素周期表的结构元素周期表的结构(周期)周期(横行)
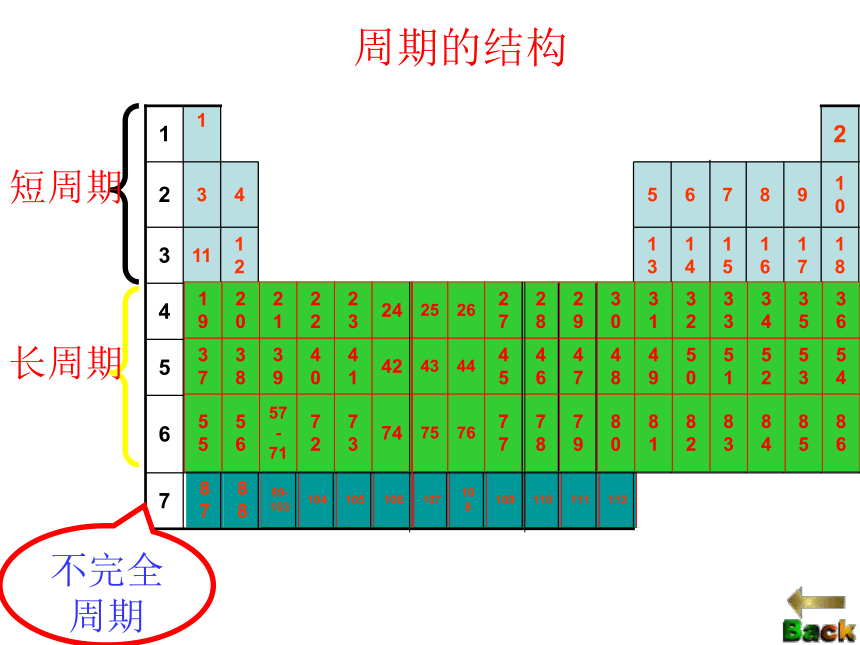
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。短周期:
长周期:
不完全周期:周期第一、二、三周期第四、五、六周期第七周期返回子菜单三长三短一不全765418
8
2M
L
k38
2L
K22K1周期的结构不完全周期元素周期表的结构(族)族(纵行)
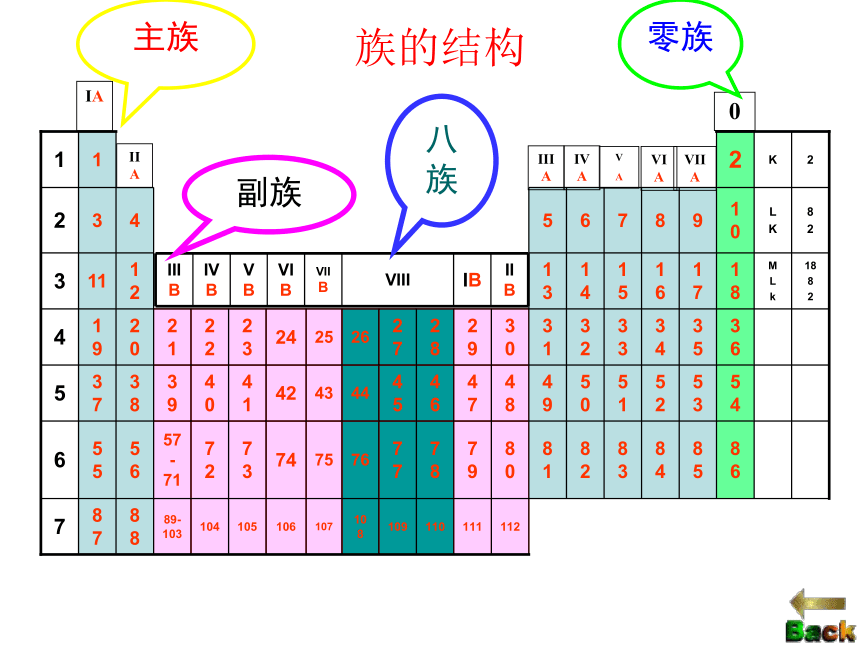
(1).主族 由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、ⅢA、… 主族序数=最外层电子数
(2).副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
(3).第Ⅷ族:
(4)0族:(“八、九、十” 三个纵行)稀有气体元素七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构2。元素周期表的编排原则横行(周期):将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行(族):将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数=核电荷数=质子数=核外电子数(电中性原子) 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期:26种元素三长三短一不全周期数 = 电子层数 族
Groups
or
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 共七个副族包含三列七主七副零八族主族序数=最外层电子数周期序数 = 电子层数 主族序数 = 最外层电子数 同周期元素电子层数相等 同主族元素最外层电子数相等 元素原子结构与其在周期表中位置关系(二) .元素的性质和元素周期表的位置关系1.同周期元素的性质变化规律同一
周期最 外 层 电 子 数 逐 渐 增 多原 子 半 径 逐 渐 减 小(稀有气体除外)金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强电子层数相同化合价+1+2+3+4-4+5-3+6-2+7-10最高氧化物R对应
水化
物碱性酸性气态氢化物稳定性R2OROR2O3RO2R2O5RO3R2O7对应水化物
化学式ROHR(OH)2R(OH)3H2RO3HRO3H3RO4H4RO4H2RO4HRO4递 增递 增递 减RH4RH3H2RHR金 属 性减 弱,非 金 属 性增 强2、同主族元素性质的变化规律同一主族(电子层数相同)电
子
层
数
依
次
增
多原
子
半
径
依
次
增
大单
质
还
原
性
增
强金
属
性
?
增
强原
子
半
径
增
大电
子
层
数
依
次
增
多单
质
氧
化
性
减
弱气
态
氢
化
物
稳
定
性
递
减非
金
属
性
减
弱原
子
半
径氧化
还原
性金属性
非金属
性高价氧
化对应
水化物
酸碱性气态
氢化
物稳
定性递
增单
质
还
原
性
增
氧
化
性
递
减金
属
性
递
增
非
金
属
性
递
减碱
性
递
增
酸
性
递
减递
减元素金属性与非金属性的递变金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大非 金 属 性 递 增金 属 性 递 增金 属 最 强同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱(三)周期表的应用寻找催化剂寻找半导体寻找农药(四)、性质、结构、位置之间的关系原子结构元素性质元素在表中位置告诉你原子序数,应能推测原子结构、元素在周期表中位置、元素金属性、非金属性。练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有: 练习与思考:14 3、19 H、Be 、 Al C S Li、Ca
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。周期数为其电子层数。短周期:
长周期:
不完全周期:周期第一、二、三周期第四、五、六周期第七周期返回子菜单三长三短一不全765418
8
2M
L
k38
2L
K22K1周期的结构不完全周期元素周期表的结构(族)族(纵行)
(1).主族 由短周期元素和长周期元素共同构成的族。 表示方法:在族序数后面标一“A”字。ⅠA、ⅡA、ⅢA、… 主族序数=最外层电子数
(2).副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
(3).第Ⅷ族:
(4)0族:(“八、九、十” 三个纵行)稀有气体元素七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构2。元素周期表的编排原则横行(周期):将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行(族):将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数=核电荷数=质子数=核外电子数(电中性原子) 短周期
short periods 长周期
long periods 不完全周期
uncompleted period 第7周期:26种元素三长三短一不全周期数 = 电子层数 族
Groups
or
Families主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素 零族:共七个主族ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 共七个副族包含三列七主七副零八族主族序数=最外层电子数周期序数 = 电子层数 主族序数 = 最外层电子数 同周期元素电子层数相等 同主族元素最外层电子数相等 元素原子结构与其在周期表中位置关系(二) .元素的性质和元素周期表的位置关系1.同周期元素的性质变化规律同一
周期最 外 层 电 子 数 逐 渐 增 多原 子 半 径 逐 渐 减 小(稀有气体除外)金 属 性 逐 渐 减 弱,非 金 属 性 逐 渐 增 强电子层数相同化合价+1+2+3+4-4+5-3+6-2+7-10最高氧化物R对应
水化
物碱性酸性气态氢化物稳定性R2OROR2O3RO2R2O5RO3R2O7对应水化物
化学式ROHR(OH)2R(OH)3H2RO3HRO3H3RO4H4RO4H2RO4HRO4递 增递 增递 减RH4RH3H2RHR金 属 性减 弱,非 金 属 性增 强2、同主族元素性质的变化规律同一主族(电子层数相同)电
子
层
数
依
次
增
多原
子
半
径
依
次
增
大单
质
还
原
性
增
强金
属
性
?
增
强原
子
半
径
增
大电
子
层
数
依
次
增
多单
质
氧
化
性
减
弱气
态
氢
化
物
稳
定
性
递
减非
金
属
性
减
弱原
子
半
径氧化
还原
性金属性
非金属
性高价氧
化对应
水化物
酸碱性气态
氢化
物稳
定性递
增单
质
还
原
性
增
氧
化
性
递
减金
属
性
递
增
非
金
属
性
递
减碱
性
递
增
酸
性
递
减递
减元素金属性与非金属性的递变金属性逐渐增强非金属性逐渐增强金属性逐渐增强非金属性逐渐增强B
Al Si
Ge As
Sb Te
Po At 半径由大变小半径由小变大非 金 属 性 递 增金 属 性 递 增金 属 最 强同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱(三)周期表的应用寻找催化剂寻找半导体寻找农药(四)、性质、结构、位置之间的关系原子结构元素性质元素在表中位置告诉你原子序数,应能推测原子结构、元素在周期表中位置、元素金属性、非金属性。练习金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。CsFClCs第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有: 练习与思考:14 3、19 H、Be 、 Al C S Li、Ca
