高二化学学业水平测试模拟试卷
图片预览
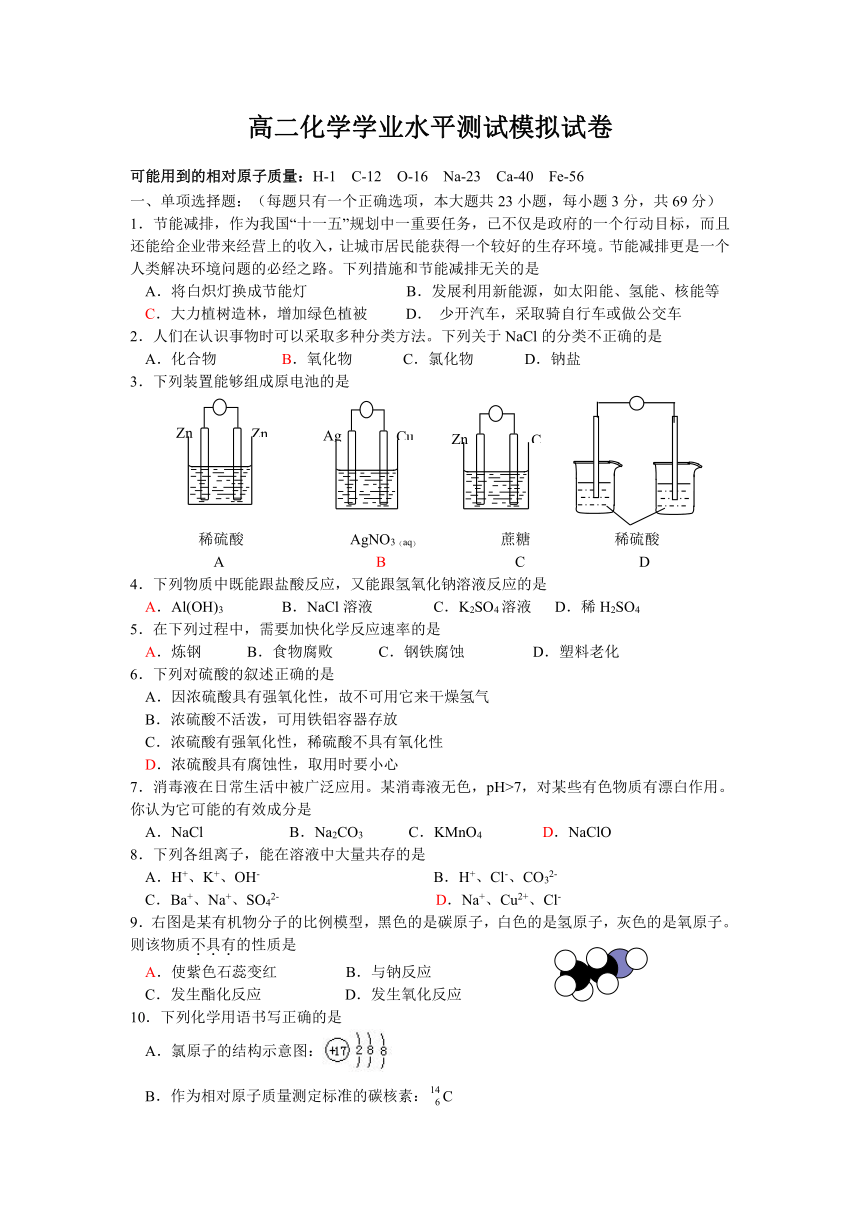

文档简介
高二化学学业水平测试模拟试卷
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Ca-40 Fe-56
一、单项选择题:(每题只有一个正确选项,本大题共23小题,每小题3分,共69分)
1.节能减排,作为我国“十一五”规划中一重要任务,已不仅是政府的一个行动目标,而且还能给企业带来经营上的收入,让城市居民能获得一个较好的生存环境。节能减排更是一个人类解决环境问题的必经之路。下列措施和节能减排无关的是
A.将白炽灯换成节能灯 B.发展利用新能源,如太阳能、氢能、核能等
C.大力植树造林,增加绿色植被 D. 少开汽车,采取骑自行车或做公交车
2.人们在认识事物时可以采取多种分类方法。下列关于NaCl的分类不正确的是
A.化合物 B.氧化物 C.氯化物 D.钠盐
3.下列装置能够组成原电池的是
稀硫酸 AgNO3(aq) 蔗糖 稀硫酸
A B C D
4.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是
A.Al(OH)3 B.NaCl溶液 C.K2SO4溶液 D.稀H2SO4
5.在下列过程中,需要加快化学反应速率的是
A.炼钢 B.食物腐败 C.钢铁腐蚀 D.塑料老化
6.下列对硫酸的叙述正确的是
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸不活泼,可用铁铝容器存放
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.浓硫酸具有腐蚀性,取用时要小心
7.消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
A.NaCl B.Na2CO3 C.KMnO4 D.NaClO
8.下列各组离子,能在溶液中大量共存的是
A.H+、K+、OH- B.H+、Cl-、CO32-
C.Ba+、Na+、SO42- D.Na+、Cu2+、Cl-
9.右图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是
A.使紫色石蕊变红 B.与钠反应
C.发生酯化反应 D.发生氧化反应
10.下列化学用语书写正确的是
A.氯原子的结构示意图:
B.作为相对原子质量测定标准的碳核素:C
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
11.酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是
A.化学能部分转化为热能 B.电能部分转化为化学能
C.热能部分转化为化学能 D.光能部分转化为化学能
12.下列离子方程式书写不正确的是
A.常温下氯气与烧碱溶液反应:Cl2 + 2OH - ══ Cl- + ClO- + H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O ══ Al(OH)3↓+3NH4+
C.铜与稀硝酸反应:Cu + 2H+ ══ Cu2+ + H2↑
D.FeCl2溶液中加入氯水:2Fe2++Cl2══2Fe3++2Cl-
13.在下列溶液中,c(Cl—)与150mL 1mol/LAlCl3溶液中的c(Cl—)相等的是
A.150mL 3mol/L的CaCl2溶液 B.75mL l.5mol/L的MgCl2溶液
C.50mL l mol/L的FeCl2溶液 D.225mL 2mol/L的NH4Cl溶液
14.下列叙述不正确的是
A.Na、Mg、Al元素最高化合价依次升高
B.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
C.N、O、F元素非金属性依次减弱
D.Li、Na、K原子的电子层数依次增多
15.在配制250mL2.0mol/L NaCl溶液的实验中,必须使用的仪器是
A B C D
16.下列有关碳酸钠、碳酸氢钠的说法中,正确的是
A.除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法
B.相同条件下,碳酸钠的溶解度小于碳酸氢钠的溶解度
C.碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠
D.向同浓度的碳酸钠溶液和碳酸氢钠溶液中滴加少量酚酞试液,都能显红色,碳酸氢钠溶液的颜色淡一些
17.从2008年6月1日起,我国禁止生产、销售、使用超薄塑料购物袋。下列对聚乙烯塑料叙述不正确的是
A.它属于有机高分子 B.它能产生“白色污染”
C.它形成的单体是乙烯 D.对聚乙烯塑料垃圾应进行深埋或倾倒入海
18.下列物质中含有共价键的离子化合物是
A.H2 B.NaCl C.NaOH D.H2S
19.下列过程合乎实际并用于工业生产的是
A.钠在氯气中燃烧制氯化钠 B.氯化铵与氢氧化钙共热制氨气
C.浓盐酸与二氧化锰共热制氯气 D.氯气与石灰乳反应制漂白粉
20.下列说法不符合ⅦA族元素性质特征的是
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.从上到下非金属性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
21.从节约原料和防止环境污染因素考虑,用铜制取硝酸铜,方法最佳的是
A.Cu Cu(NO3)2 B.Cu Cu(NO3)2
C.Cu CuCl2 Cu(NO3)2 D.Cu CuO Cu(NO3)2
22.下列除去杂质的方法正确的是
物质
杂质
试剂
主要操作
A
SiO2
Fe2O3
盐酸
过滤
B
CO2
CO
O2
点燃
C
FeCl2溶液
FeCl3
Cu
分液
D
CH3CH2OH
H2O
Na
蒸馏
23.在一条件下,反应N2+3H2 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol/(L·min) B.1.0 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
二、本大题包括2小题,共15分。
24.(4分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)微量元素与人体健康密切相关。为此,我国启动了多项工程,帮助居民补充微量元素,预防疾病。例如为了解决 问题启动了“酱油加铁”工程;为预防碘缺乏症,启动了“食盐加碘”工程,就是在食盐中加入适量的 (填“碘化钾”、“碘酸钾”或“碘单质”)。
(2)我国居民在平时的饮食中应多吃碱性食物。下列属于碱性食物的是 (填“肉类”、“鸡蛋”或“水果”)。
(3)服用药物时要对症下药。胃舒平(主要成分Al(OH)3)适合于治疗 (填“感冒发热”、“细菌感染”或“胃酸过多”)。
25.(11分)
(1)现有下列五种物质 A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素,F.阿司匹林请按下列要求填空(填序号)。
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;既可作为调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 ,使用最早的解热镇痛药 。
(2)蛋白质缺乏是可以致命的。人体内蛋白质约占体重的16%。一个体重为60kg的人,体内含有10~11kg的蛋白质。如果人体丢失体内20%以上的蛋白质,生命活动有可能会被迫停止。常见的蛋白质缺乏症表现为代谢下降,生命变得脆弱易病。蛋白质的生理功能与它的化学性质密切相关。人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸。这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量。
①蛋白质分子中主要含有 四种元素。
②天然蛋白质水解得到的都是 氨基酸。
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性。这个过程称为 。
④蛋白质遇到酸、碱、重金属盐、乙醇等化学物质时会发生凝结,失去原来的活性,这个变化称为 。
⑤人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为 氨基酸。
三、本大题包括两小题,共16分。
26.(8分)下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色。
请回答以下问题:
⑴A的元素在元素周期表中位于 ,C的化学式是_______________。
⑵写出D与E反应转化为F和B的化学方程式_________________________________。
⑶在常温下,B的稀溶液也可与Cu反应生成F。此反应的离子方程式:
。
27.(8分) “阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴ 取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已部分被 ;
步骤⑵ 将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0?g。8.0?g滤渣中活性炭的质量为 g;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于 mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为 。
参考答案:
24.(1)缺铁性贫血 碘酸钾 (2)水果 (3)胃酸过多
25.C D E B A F (1)C、H、O、N (2)α (3)盐析 (4)变性 (5)必需(每空1分)
26.⑴第二周期、ⅣA族 CO2 ⑵3NO2 + H2O ===2HNO3 +NO
⑶3Cu +8H+ +2NO3- ===3Cu2+ +2NO↑ + 4H2O (每空2分,共8分)
27.(每空2分) 氧化 2.4 52.5 2︰1
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Ca-40 Fe-56
一、单项选择题:(每题只有一个正确选项,本大题共23小题,每小题3分,共69分)
1.节能减排,作为我国“十一五”规划中一重要任务,已不仅是政府的一个行动目标,而且还能给企业带来经营上的收入,让城市居民能获得一个较好的生存环境。节能减排更是一个人类解决环境问题的必经之路。下列措施和节能减排无关的是
A.将白炽灯换成节能灯 B.发展利用新能源,如太阳能、氢能、核能等
C.大力植树造林,增加绿色植被 D. 少开汽车,采取骑自行车或做公交车
2.人们在认识事物时可以采取多种分类方法。下列关于NaCl的分类不正确的是
A.化合物 B.氧化物 C.氯化物 D.钠盐
3.下列装置能够组成原电池的是
稀硫酸 AgNO3(aq) 蔗糖 稀硫酸
A B C D
4.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是
A.Al(OH)3 B.NaCl溶液 C.K2SO4溶液 D.稀H2SO4
5.在下列过程中,需要加快化学反应速率的是
A.炼钢 B.食物腐败 C.钢铁腐蚀 D.塑料老化
6.下列对硫酸的叙述正确的是
A.因浓硫酸具有强氧化性,故不可用它来干燥氢气
B.浓硫酸不活泼,可用铁铝容器存放
C.浓硫酸有强氧化性,稀硫酸不具有氧化性
D.浓硫酸具有腐蚀性,取用时要小心
7.消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
A.NaCl B.Na2CO3 C.KMnO4 D.NaClO
8.下列各组离子,能在溶液中大量共存的是
A.H+、K+、OH- B.H+、Cl-、CO32-
C.Ba+、Na+、SO42- D.Na+、Cu2+、Cl-
9.右图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。则该物质不具有的性质是
A.使紫色石蕊变红 B.与钠反应
C.发生酯化反应 D.发生氧化反应
10.下列化学用语书写正确的是
A.氯原子的结构示意图:
B.作为相对原子质量测定标准的碳核素:C
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
11.酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是
A.化学能部分转化为热能 B.电能部分转化为化学能
C.热能部分转化为化学能 D.光能部分转化为化学能
12.下列离子方程式书写不正确的是
A.常温下氯气与烧碱溶液反应:Cl2 + 2OH - ══ Cl- + ClO- + H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O ══ Al(OH)3↓+3NH4+
C.铜与稀硝酸反应:Cu + 2H+ ══ Cu2+ + H2↑
D.FeCl2溶液中加入氯水:2Fe2++Cl2══2Fe3++2Cl-
13.在下列溶液中,c(Cl—)与150mL 1mol/LAlCl3溶液中的c(Cl—)相等的是
A.150mL 3mol/L的CaCl2溶液 B.75mL l.5mol/L的MgCl2溶液
C.50mL l mol/L的FeCl2溶液 D.225mL 2mol/L的NH4Cl溶液
14.下列叙述不正确的是
A.Na、Mg、Al元素最高化合价依次升高
B.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
C.N、O、F元素非金属性依次减弱
D.Li、Na、K原子的电子层数依次增多
15.在配制250mL2.0mol/L NaCl溶液的实验中,必须使用的仪器是
A B C D
16.下列有关碳酸钠、碳酸氢钠的说法中,正确的是
A.除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法
B.相同条件下,碳酸钠的溶解度小于碳酸氢钠的溶解度
C.碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠
D.向同浓度的碳酸钠溶液和碳酸氢钠溶液中滴加少量酚酞试液,都能显红色,碳酸氢钠溶液的颜色淡一些
17.从2008年6月1日起,我国禁止生产、销售、使用超薄塑料购物袋。下列对聚乙烯塑料叙述不正确的是
A.它属于有机高分子 B.它能产生“白色污染”
C.它形成的单体是乙烯 D.对聚乙烯塑料垃圾应进行深埋或倾倒入海
18.下列物质中含有共价键的离子化合物是
A.H2 B.NaCl C.NaOH D.H2S
19.下列过程合乎实际并用于工业生产的是
A.钠在氯气中燃烧制氯化钠 B.氯化铵与氢氧化钙共热制氨气
C.浓盐酸与二氧化锰共热制氯气 D.氯气与石灰乳反应制漂白粉
20.下列说法不符合ⅦA族元素性质特征的是
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.从上到下非金属性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
21.从节约原料和防止环境污染因素考虑,用铜制取硝酸铜,方法最佳的是
A.Cu Cu(NO3)2 B.Cu Cu(NO3)2
C.Cu CuCl2 Cu(NO3)2 D.Cu CuO Cu(NO3)2
22.下列除去杂质的方法正确的是
物质
杂质
试剂
主要操作
A
SiO2
Fe2O3
盐酸
过滤
B
CO2
CO
O2
点燃
C
FeCl2溶液
FeCl3
Cu
分液
D
CH3CH2OH
H2O
Na
蒸馏
23.在一条件下,反应N2+3H2 2NH3在10L密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol/(L·min) B.1.0 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
二、本大题包括2小题,共15分。
24.(4分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)微量元素与人体健康密切相关。为此,我国启动了多项工程,帮助居民补充微量元素,预防疾病。例如为了解决 问题启动了“酱油加铁”工程;为预防碘缺乏症,启动了“食盐加碘”工程,就是在食盐中加入适量的 (填“碘化钾”、“碘酸钾”或“碘单质”)。
(2)我国居民在平时的饮食中应多吃碱性食物。下列属于碱性食物的是 (填“肉类”、“鸡蛋”或“水果”)。
(3)服用药物时要对症下药。胃舒平(主要成分Al(OH)3)适合于治疗 (填“感冒发热”、“细菌感染”或“胃酸过多”)。
25.(11分)
(1)现有下列五种物质 A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素,F.阿司匹林请按下列要求填空(填序号)。
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;既可作为调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 ,使用最早的解热镇痛药 。
(2)蛋白质缺乏是可以致命的。人体内蛋白质约占体重的16%。一个体重为60kg的人,体内含有10~11kg的蛋白质。如果人体丢失体内20%以上的蛋白质,生命活动有可能会被迫停止。常见的蛋白质缺乏症表现为代谢下降,生命变得脆弱易病。蛋白质的生理功能与它的化学性质密切相关。人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸。这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量。
①蛋白质分子中主要含有 四种元素。
②天然蛋白质水解得到的都是 氨基酸。
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性。这个过程称为 。
④蛋白质遇到酸、碱、重金属盐、乙醇等化学物质时会发生凝结,失去原来的活性,这个变化称为 。
⑤人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为 氨基酸。
三、本大题包括两小题,共16分。
26.(8分)下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色。
请回答以下问题:
⑴A的元素在元素周期表中位于 ,C的化学式是_______________。
⑵写出D与E反应转化为F和B的化学方程式_________________________________。
⑶在常温下,B的稀溶液也可与Cu反应生成F。此反应的离子方程式:
。
27.(8分) “阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴ 取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已部分被 ;
步骤⑵ 将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0?g。8.0?g滤渣中活性炭的质量为 g;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于 mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为 。
参考答案:
24.(1)缺铁性贫血 碘酸钾 (2)水果 (3)胃酸过多
25.C D E B A F (1)C、H、O、N (2)α (3)盐析 (4)变性 (5)必需(每空1分)
26.⑴第二周期、ⅣA族 CO2 ⑵3NO2 + H2O ===2HNO3 +NO
⑶3Cu +8H+ +2NO3- ===3Cu2+ +2NO↑ + 4H2O (每空2分,共8分)
27.(每空2分) 氧化 2.4 52.5 2︰1
同课章节目录
