1-4-1研究有机物的方法和步骤第一课时
文档属性
| 名称 | 1-4-1研究有机物的方法和步骤第一课时 |  | |
| 格式 | rar | ||
| 文件大小 | 438.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-11 16:29:00 | ||
图片预览






文档简介
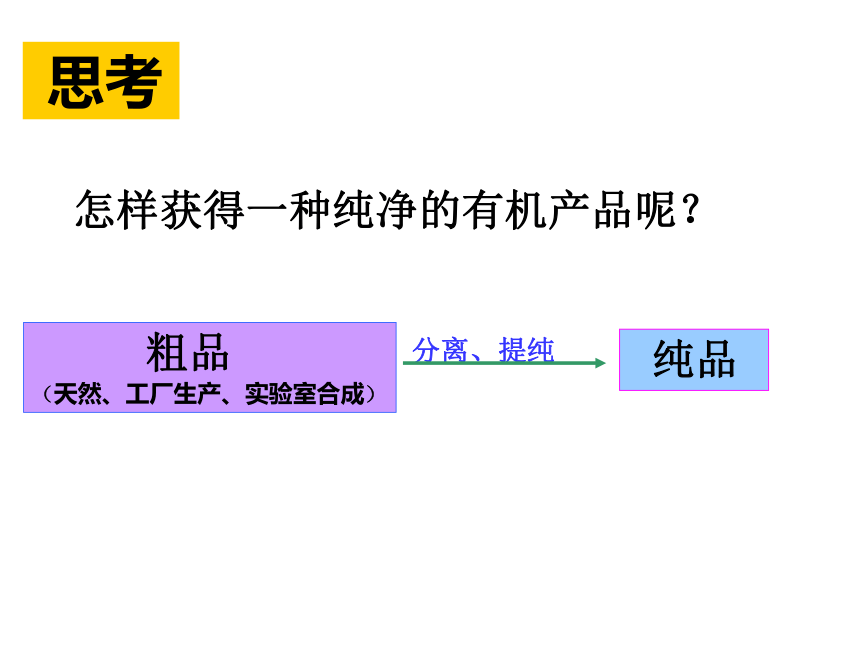
课件20张PPT。2019年2月27日星期三第一章 认识有机化合物4 研究有机化合物的一般步骤和方法怎样获得一种纯净的有机产品呢?分离、提纯 思考 粗品
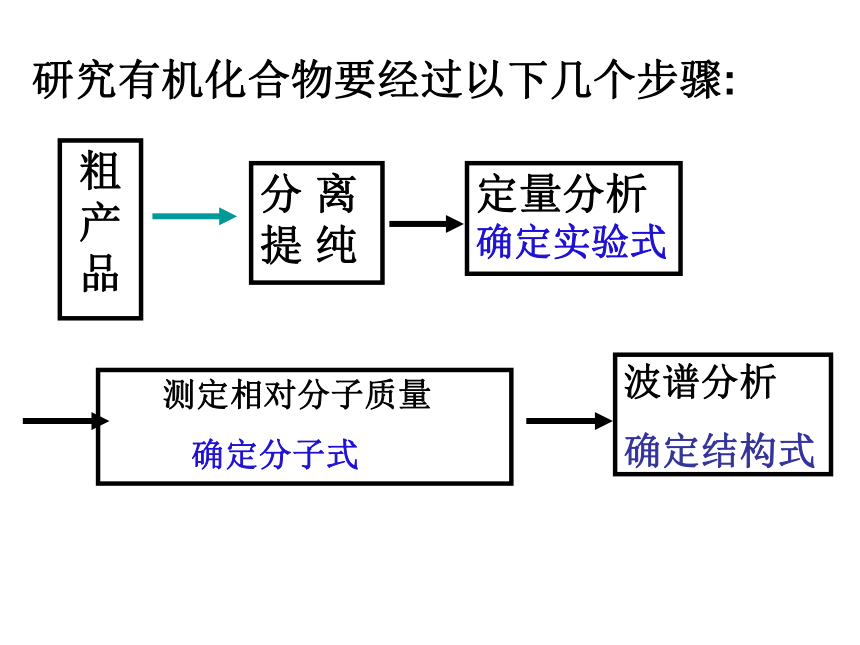
(天然、工厂生产、实验室合成) 纯品研究有机化合物要经过以下几个步骤:粗产品分 离提 纯定量分析 确定实验式 测定相对分子质量
确定分子式波谱分析
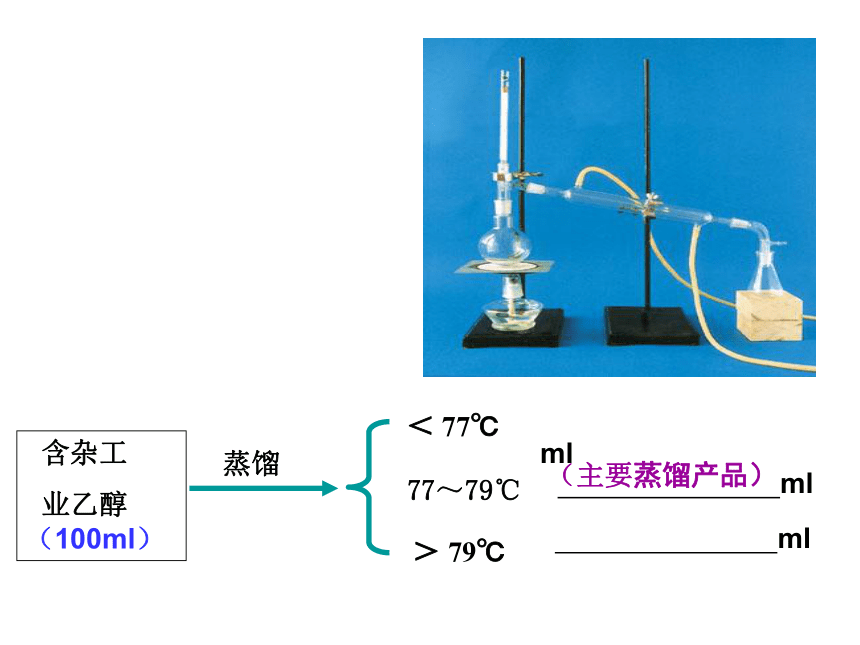
确定结构式 含杂工
业乙醇(100ml)蒸馏< 77℃ 77~79℃> 79℃ ml ml ml (主要蒸馏产品) 蒸馏法分离、提纯有机物的原理和适用条件是什么?
思考与交流:原理:
利用液态有机混合物中各种成分的沸点不同而使其分离。
适用条件:
液态、热稳定性较强有机物含少量杂质;
且与杂质沸点相差较大(30℃左右)
蒸馏烧瓶冷凝管温度计尾接管铁架台酒精灯锥形瓶 石棉网1、实验室进行蒸馏时,用到的仪器有哪些?
2、这套蒸馏装置在实验过程中,需要注意哪些问题?注意事项:①仪器组装的顺序:
②温度计水银球的位置:
③蒸馏烧瓶所盛放液体容量:④冷凝管中冷却水从 进,从 出。
⑤蒸馏烧瓶中加少量 ,防止 。
⑥先通水再加热,要加石棉网,温度不能超过混合物中沸点最高物质的沸点。
2.重结晶(1)重结晶的原理
有机物在热溶液中的溶解度较大,而在冷溶液中的溶解度较小,冷却后易于结晶析出。
(2)重结晶对溶剂的要求
P18
(3)步骤: 粗产品趁热过滤冷却结晶纯产品加热溶解过滤(1)粗苯甲酸的状态: 。(2)加热边搅拌:
。(3)滤液静置冷却:
。上面漂浮物为未溶解的苯甲酸(4)重结晶后苯甲酸的状态:
。灰黄色粉末不断有白色晶体析出白色片状晶体(1)实验所需仪器;
(2)烧杯经冷却结晶后,混合物应如何进一步分离?
(3)粗品全溶后为什么要再加入少量蒸馏水?酒精灯、(三脚架)、石棉网、烧杯、
玻璃棒、铁架台、漏斗、滤纸过滤后得晶体。减少趁热过滤过程中损失苯甲酸。思考与交流固体有机粗品残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成热溶液,趁热过滤冷却,结晶,过滤,洗涤如何洗涤结晶?如何检验结晶洗净与否?(4)归纳(1)洗涤沉淀或晶体的方法:
往盛有晶体的过滤器中注入蒸馏水直至晶体被浸没,待水完全滤出后,重复两至三次,直至晶体被洗净。(2)检验洗涤效果:
取最后一次的洗出液,再选择适当的试剂,是否检验出含有某些离子或物质。 温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
(1)实验原理是什么?
(2)用到哪些仪器?
(3)实验操作过程有哪些注意事项?
(4)如何选取萃取剂?
(5)常见的萃取剂有哪些?
知识回忆并交流回忆必修①第一章介绍的[实验1-4]:
如何从饱和碘水中萃取碘?1)原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
2)主要仪器:分液漏斗3)操作过程:振荡静置分液3、萃取4、萃取剂的选择:
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
5、常见的有机萃取剂:
苯、乙醚、石油醚、二氯甲烷、四氯化碳……6、萃取的类型: 1)液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。 2)固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 。(专用仪器设备)[练习]下列每组都能用分液漏斗分离的是
A 酒精和水,植物油和水
B 四氯化碳和水,乙酸和水,
C 乙酸和乙醇,溴和四氯化碳
D 苯和水,己烷和水√小结:研究有机化合物的一般过程与方法
有机化合物分离提纯的常用方法和分离原理
(一)蒸馏
(二)重结晶
(三)萃取
(四)色谱法
液态、热稳定性较强有机物含少量杂质;与杂质沸点相差较大蒸馏烧瓶、
温度计、
冷凝管、
尾接管
(牛角管)
锥形瓶、
铁架台、
酒精灯、
石棉网制取蒸馏水
工业酒精的
蒸馏1、仪器组装
2、温度计水 银球位置
3、水流方向水汽逆流
4、加碎瓷片
5、液体容量
6、加热事项溶解度不同,随温度变化不同的固态有机混合物烧杯
玻璃棒
普通漏斗
铁架台
酒精灯
石棉网、
三角架KNO3、NaCl
混合液中
提纯KNO3
粗苯甲酸
的重结晶
1、先配较高温度下的浓溶液,然后降温结晶;
2、结晶后
过滤,分离出晶体
3、温度控制
4、如何洗涤检验洗净
(天然、工厂生产、实验室合成) 纯品研究有机化合物要经过以下几个步骤:粗产品分 离提 纯定量分析 确定实验式 测定相对分子质量
确定分子式波谱分析
确定结构式 含杂工
业乙醇(100ml)蒸馏< 77℃ 77~79℃> 79℃ ml ml ml (主要蒸馏产品) 蒸馏法分离、提纯有机物的原理和适用条件是什么?
思考与交流:原理:
利用液态有机混合物中各种成分的沸点不同而使其分离。
适用条件:
液态、热稳定性较强有机物含少量杂质;
且与杂质沸点相差较大(30℃左右)
蒸馏烧瓶冷凝管温度计尾接管铁架台酒精灯锥形瓶 石棉网1、实验室进行蒸馏时,用到的仪器有哪些?
2、这套蒸馏装置在实验过程中,需要注意哪些问题?注意事项:①仪器组装的顺序:
②温度计水银球的位置:
③蒸馏烧瓶所盛放液体容量:④冷凝管中冷却水从 进,从 出。
⑤蒸馏烧瓶中加少量 ,防止 。
⑥先通水再加热,要加石棉网,温度不能超过混合物中沸点最高物质的沸点。
2.重结晶(1)重结晶的原理
有机物在热溶液中的溶解度较大,而在冷溶液中的溶解度较小,冷却后易于结晶析出。
(2)重结晶对溶剂的要求
P18
(3)步骤: 粗产品趁热过滤冷却结晶纯产品加热溶解过滤(1)粗苯甲酸的状态: 。(2)加热边搅拌:
。(3)滤液静置冷却:
。上面漂浮物为未溶解的苯甲酸(4)重结晶后苯甲酸的状态:
。灰黄色粉末不断有白色晶体析出白色片状晶体(1)实验所需仪器;
(2)烧杯经冷却结晶后,混合物应如何进一步分离?
(3)粗品全溶后为什么要再加入少量蒸馏水?酒精灯、(三脚架)、石棉网、烧杯、
玻璃棒、铁架台、漏斗、滤纸过滤后得晶体。减少趁热过滤过程中损失苯甲酸。思考与交流固体有机粗品残渣
(不溶性杂质)滤液母液
(可溶性杂质和部分被提纯物)晶体
(产品)溶于溶剂,制成热溶液,趁热过滤冷却,结晶,过滤,洗涤如何洗涤结晶?如何检验结晶洗净与否?(4)归纳(1)洗涤沉淀或晶体的方法:
往盛有晶体的过滤器中注入蒸馏水直至晶体被浸没,待水完全滤出后,重复两至三次,直至晶体被洗净。(2)检验洗涤效果:
取最后一次的洗出液,再选择适当的试剂,是否检验出含有某些离子或物质。 温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
(1)实验原理是什么?
(2)用到哪些仪器?
(3)实验操作过程有哪些注意事项?
(4)如何选取萃取剂?
(5)常见的萃取剂有哪些?
知识回忆并交流回忆必修①第一章介绍的[实验1-4]:
如何从饱和碘水中萃取碘?1)原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
2)主要仪器:分液漏斗3)操作过程:振荡静置分液3、萃取4、萃取剂的选择:
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
5、常见的有机萃取剂:
苯、乙醚、石油醚、二氯甲烷、四氯化碳……6、萃取的类型: 1)液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。 2)固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 。(专用仪器设备)[练习]下列每组都能用分液漏斗分离的是
A 酒精和水,植物油和水
B 四氯化碳和水,乙酸和水,
C 乙酸和乙醇,溴和四氯化碳
D 苯和水,己烷和水√小结:研究有机化合物的一般过程与方法
有机化合物分离提纯的常用方法和分离原理
(一)蒸馏
(二)重结晶
(三)萃取
(四)色谱法
液态、热稳定性较强有机物含少量杂质;与杂质沸点相差较大蒸馏烧瓶、
温度计、
冷凝管、
尾接管
(牛角管)
锥形瓶、
铁架台、
酒精灯、
石棉网制取蒸馏水
工业酒精的
蒸馏1、仪器组装
2、温度计水 银球位置
3、水流方向水汽逆流
4、加碎瓷片
5、液体容量
6、加热事项溶解度不同,随温度变化不同的固态有机混合物烧杯
玻璃棒
普通漏斗
铁架台
酒精灯
石棉网、
三角架KNO3、NaCl
混合液中
提纯KNO3
粗苯甲酸
的重结晶
1、先配较高温度下的浓溶液,然后降温结晶;
2、结晶后
过滤,分离出晶体
3、温度控制
4、如何洗涤检验洗净
