梅梁中学2008—2009学年度第二学期高一化学3月份月考测试卷
文档属性
| 名称 | 梅梁中学2008—2009学年度第二学期高一化学3月份月考测试卷 |

|
|
| 格式 | rar | ||
| 文件大小 | 53.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-14 00:00:00 | ||
图片预览


文档简介
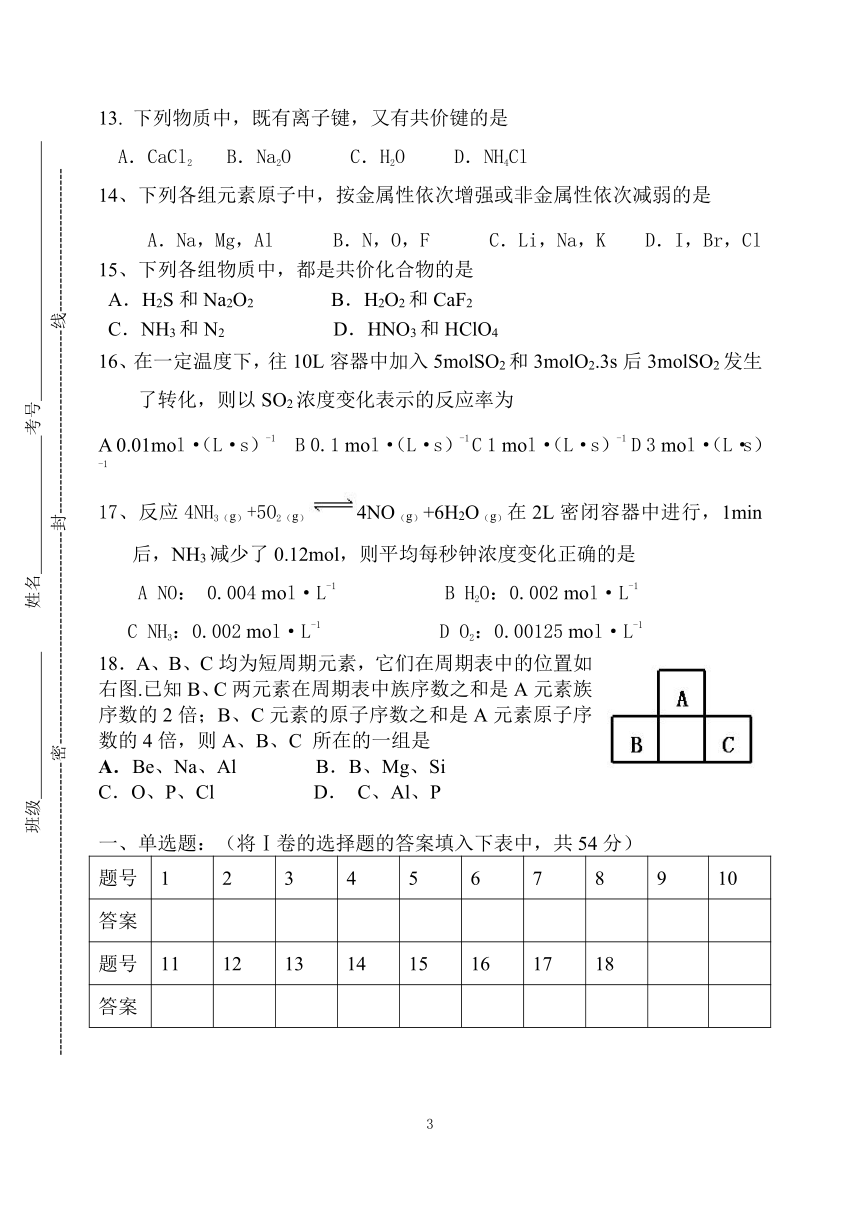
梅梁中学2008—2009学年度第二学期
高一化学3月份月考测试卷
09.3.14
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择卷)两部分,满分120分。
可能用到的数据:相对原子质量:H 1 O 16 C 12 Na 23 Cl 35.5 Br 80 Fe 56 Cu 64
第Ⅰ卷(选择题,54分)
(每小题3分,共48分,每小题只有一个选项是符合题目要求的)
选择题:(每小题只有一个选项是符合题意,每题3分共54分)
1、据报导我国最近合成多种元素的新的同位素,其中一种是(铪),它的中子数是
A.72 B.113 C.185 D.257
2、决定化学反应速率的根本原因是
A 温度和压强 B反应物的浓度
C 参加反应的各物质的性质 D 催化剂的加入
3、C60是60个碳原子形成的封闭笼状分子,形似足球,它与石墨互为
A.同位素 B.同素异形体 C.同分异构体 D.同一物质
4、下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F-- B.热稳定性:HCl>H2S>PH2>AsH2
C.酸性强弱:H2AlO4<H2SiO3<H2CO3<H3PO4 D.熔点:SiO2>NaCl>Na>CO2
5、某元素X的最高价氧化物的分子式为X2O5,在它的气态氢化物中含氢3.85%,该元素的原子中有42个中子,则该元素的原子序数为
A.14 B.31 C.33 D.75
6、原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有:
A、1种 B、2种 C、3种 D4种
7.下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的位置相符的是
8、已知X元素原子的L电子层比Y元素原子的L电子层少3个电子,Y元素原子核外总电子数比X元素总电子数多5个,则X、Y可形成
A.离子化合物Y( XO3)2 B. 离子化合物Y2X3
C. 共价化合物Y3X2 D. 共价化合物XY2
9、下列四种元素中,单质的氧化性最强的是
A、原子最外层电子数为次外层电子数的2倍
B、第三周期ⅢA族元素
C、第16号元素
D、原子核外L层电子数为K层电子数的三倍
10、在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
11、下列物质的电子式书写正确的是
12、下列说法正确的是
A.离子化合物中一定含有金属离子
B.稀有气体形成的晶体属于分子晶体
C.氯化钠晶体熔化时,不发生化学键断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
13. 下列物质中,既有离子键,又有共价键的是
A.CaCl2 B.Na2O C.H2O D.NH4Cl
14、下列各组元素原子中,按金属性依次增强或非金属性依次减弱的是
A.Na,Mg,Al B.N,O,F C.Li,Na,K D.I,Br,Cl
15、下列各组物质中,都是共价化合物的是
A.H2S和Na2O2????????????????B.H2O2和CaF2
C.NH3和N2???????????????? D.HNO3和HClO4
16、在一定温度下,往10L容器中加入5molSO2和3molO2.3s后3molSO2发生了转化,则以SO2浓度变化表示的反应率为
A 0.01mol·(L·s)-1 B 0.1 mol·(L·s)-1 C 1 mol·(L·s)-1 D 3 mol·(L·s)-1
17、反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在2L密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A NO: 0.004 mol·L-1 B H2O:0.002 mol·L-1
C NH3:0.002 mol·L-1 D O2:0.00125 mol·L-1
18.A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D. C、Al、P
一、单选题:(将Ⅰ卷的选择题的答案填入下表中,共54分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
答案
第Ⅱ卷(非选择题,66分)
19、(8分)下列物质中:
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (4)属于同一种物质的有 。(填序号)
①液氯 ② ③白磷 ④氯气
⑤ ⑥Cl ⑦Cl ⑧红磷
20.(12分)写出下列物质或微粒的电子式
(1) N2 (2)CO2 (3)NaOH
(4)H2O2 (5) K2S (6) NH4Cl
21、(16分)下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物的对应水化物的酸(或碱)性强弱顺序为 > (用化学式表示)
22、(6分)某温度时,在3L密闭容器中,X、Y、Z 3种物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式____________。
(2)反应开始至2min末,X的反应速率为_____________。
23、(14分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
元素名称: A ________ B __________ C __________ D ___________
写出AB2 的结构式为 ______________
写出C单质在高温下与B单质充分反应的化学方程式 ___________ ____ _,
写出此反应中生成的淡黄色固态化合物与水反应的化学方程式____________________________________.
三、计算题
24、(10分)把0.6 molX气体和0.6molY气体混合于2L密闭容器中,使他们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.1 mol·(L·min)-1,计算:
前2min内用X的浓度变化表示的平均反应速率;
2min末时Y的浓度
化学方程式中n值是多少?
高一化学月考参考答案
1-18 选择题(18x3=54)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
B
A
C
B
D
A
D
D
题号
11
12
13
14
15
16
17
18
答案
C
B
D
C
D
B
D
C
19、(1)②与⑤
(2)③⑧
(3)⑥⑦
(4)①与④
20、略
21、(9分)每空1分
(1)Ar,K,F,Br,M (2)PH3
(3)Cl (4)Mg(OH)2 Al(OH)3
22、(1)Y+2Z3X;(2)0.1mol /(L·min)
23、(9分)
(1)C、O、Na、S 每空1分
(2)O=C=O 1分
(3)
2Na+O2 ====Na2O2 2分 2Na2O2 +2H2O=4NaOH+ O2 ↑ 2分
19、(1)0.05 mol·(L·min)-1
(2)0.25 mol·L-1
(3)4
高一化学3月份月考测试卷
09.3.14
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择卷)两部分,满分120分。
可能用到的数据:相对原子质量:H 1 O 16 C 12 Na 23 Cl 35.5 Br 80 Fe 56 Cu 64
第Ⅰ卷(选择题,54分)
(每小题3分,共48分,每小题只有一个选项是符合题目要求的)
选择题:(每小题只有一个选项是符合题意,每题3分共54分)
1、据报导我国最近合成多种元素的新的同位素,其中一种是(铪),它的中子数是
A.72 B.113 C.185 D.257
2、决定化学反应速率的根本原因是
A 温度和压强 B反应物的浓度
C 参加反应的各物质的性质 D 催化剂的加入
3、C60是60个碳原子形成的封闭笼状分子,形似足球,它与石墨互为
A.同位素 B.同素异形体 C.同分异构体 D.同一物质
4、下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F-- B.热稳定性:HCl>H2S>PH2>AsH2
C.酸性强弱:H2AlO4<H2SiO3<H2CO3<H3PO4 D.熔点:SiO2>NaCl>Na>CO2
5、某元素X的最高价氧化物的分子式为X2O5,在它的气态氢化物中含氢3.85%,该元素的原子中有42个中子,则该元素的原子序数为
A.14 B.31 C.33 D.75
6、原子序数在20号以前的元素,原子最外层电子数等于次外层电子数的有:
A、1种 B、2种 C、3种 D4种
7.下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的位置相符的是
8、已知X元素原子的L电子层比Y元素原子的L电子层少3个电子,Y元素原子核外总电子数比X元素总电子数多5个,则X、Y可形成
A.离子化合物Y( XO3)2 B. 离子化合物Y2X3
C. 共价化合物Y3X2 D. 共价化合物XY2
9、下列四种元素中,单质的氧化性最强的是
A、原子最外层电子数为次外层电子数的2倍
B、第三周期ⅢA族元素
C、第16号元素
D、原子核外L层电子数为K层电子数的三倍
10、在短周期元素中,原子最外电子层只有1个或2个电子的元素是
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
11、下列物质的电子式书写正确的是
12、下列说法正确的是
A.离子化合物中一定含有金属离子
B.稀有气体形成的晶体属于分子晶体
C.氯化钠晶体熔化时,不发生化学键断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
13. 下列物质中,既有离子键,又有共价键的是
A.CaCl2 B.Na2O C.H2O D.NH4Cl
14、下列各组元素原子中,按金属性依次增强或非金属性依次减弱的是
A.Na,Mg,Al B.N,O,F C.Li,Na,K D.I,Br,Cl
15、下列各组物质中,都是共价化合物的是
A.H2S和Na2O2????????????????B.H2O2和CaF2
C.NH3和N2???????????????? D.HNO3和HClO4
16、在一定温度下,往10L容器中加入5molSO2和3molO2.3s后3molSO2发生了转化,则以SO2浓度变化表示的反应率为
A 0.01mol·(L·s)-1 B 0.1 mol·(L·s)-1 C 1 mol·(L·s)-1 D 3 mol·(L·s)-1
17、反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在2L密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是
A NO: 0.004 mol·L-1 B H2O:0.002 mol·L-1
C NH3:0.002 mol·L-1 D O2:0.00125 mol·L-1
18.A、B、C均为短周期元素,它们在周期表中的位置如右图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D. C、Al、P
一、单选题:(将Ⅰ卷的选择题的答案填入下表中,共54分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
答案
第Ⅱ卷(非选择题,66分)
19、(8分)下列物质中:
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (4)属于同一种物质的有 。(填序号)
①液氯 ② ③白磷 ④氯气
⑤ ⑥Cl ⑦Cl ⑧红磷
20.(12分)写出下列物质或微粒的电子式
(1) N2 (2)CO2 (3)NaOH
(4)H2O2 (5) K2S (6) NH4Cl
21、(16分)下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物的对应水化物的酸(或碱)性强弱顺序为 > (用化学式表示)
22、(6分)某温度时,在3L密闭容器中,X、Y、Z 3种物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式____________。
(2)反应开始至2min末,X的反应速率为_____________。
23、(14分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
元素名称: A ________ B __________ C __________ D ___________
写出AB2 的结构式为 ______________
写出C单质在高温下与B单质充分反应的化学方程式 ___________ ____ _,
写出此反应中生成的淡黄色固态化合物与水反应的化学方程式____________________________________.
三、计算题
24、(10分)把0.6 molX气体和0.6molY气体混合于2L密闭容器中,使他们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min末已生成0.2molW,若测知以Z的浓度变化表示的反应速率为0.1 mol·(L·min)-1,计算:
前2min内用X的浓度变化表示的平均反应速率;
2min末时Y的浓度
化学方程式中n值是多少?
高一化学月考参考答案
1-18 选择题(18x3=54)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
B
A
C
B
D
A
D
D
题号
11
12
13
14
15
16
17
18
答案
C
B
D
C
D
B
D
C
19、(1)②与⑤
(2)③⑧
(3)⑥⑦
(4)①与④
20、略
21、(9分)每空1分
(1)Ar,K,F,Br,M (2)PH3
(3)Cl (4)Mg(OH)2 Al(OH)3
22、(1)Y+2Z3X;(2)0.1mol /(L·min)
23、(9分)
(1)C、O、Na、S 每空1分
(2)O=C=O 1分
(3)
2Na+O2 ====Na2O2 2分 2Na2O2 +2H2O=4NaOH+ O2 ↑ 2分
19、(1)0.05 mol·(L·min)-1
(2)0.25 mol·L-1
(3)4
同课章节目录
