物质组成、分类、变化和化学用语(湖南省郴州市)
文档属性
| 名称 | 物质组成、分类、变化和化学用语(湖南省郴州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 135.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-22 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
物质的组成、分类、变化和化学用语
[考情探究]
1. 常考知识点:物质的分子、原子、离子、元素等概念的含义以及原子团的定义;混合物和纯净物、单质和化合物、金属和非金属的概念;正确书写常见元素的名称、符号、离子符号;电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;质量守恒定律的含义;热化学方程式的含义;化学方程式、离子方程式、电离方程式、电极反应式的正确书写。
2. 命题新动向:无论是基础型试题还是能力型试题,问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案,每年的高考化学试题的答案中化学用语占有很大的比例。多年来高考对本专题知识的考查,无论是内容还是难度方面都较为稳定,估计近几年也不会有很大的变化。但在题型方面的多样化还是有可能的,如出现基本概念的简答题等,基本概念与其他部分化学知识和能力的相互渗透和结合将会有所加强
[知识网络]
[ 题 型 ]
题型一 物质组成、性质、分类、变化等概念的判断性考察
例1、我国拥有最大的稀土矿藏,提炼时使稀土元素(可用RE表示)与铁、锰等分离的方法之一是往处理矿石后的硫酸浸出液中加入Na2SO4粉末,使稀土元素转化为沉淀,反应可表示为:RE2(SO4)3+xNa2SO4+yH2O=RE2(SO4)3·xNa2SO4·yH2O↓ 以下叙述正确的是( )
A. 该反应一定在碱性溶液中进行 B. 该反应类型属于复分解反应
C. 反应表现出Na2SO4的反应活性很大 D. 该反应类型属于化合反应
[解析] 该反应没有离子互换,所以,不是复分解反应。 [答案] D
例2、 对于复分解反应:X+Y=Z+W,下列叙述正确的是( )
A. 若Z是强酸,则X和Y必有一种是酸,而不能是强酸的酸式盐
B. 若Y是强碱,X是盐,则Z或W必有一种是弱碱
C. 若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
D. 若W是弱碱,Z是盐,则X和Y必有一种是强碱
[解析] A答案的反例:NaHSO4+NaCl =HCl↑+Na2SO4;B答案的反例:NaHCO3+NaOH=Na2CO3+H2O;C答案正确;D答案反例:氨水与铝盐反应生成弱碱Al(OH)3和铵盐。 [答案] C
题型二 用化学方程式、离子方程式、结构简式等基本化学用语进行化学描述
例3、 某研究性小组探究实验室制O2的新原理,经过查阅大量的文献资料,最终选定了两种方案:
方案一:选择KMnO4、Na2O2固体混合受热
方案二:选择Al2O3、Na2O2固体混合受热
两种方案都能较快较好的产生O2(假定两种方案中都无反应物剩余)。但方案一产生O2后残留的固体为绿色(K2MnO4和Na2MnO4的混合物),方案二的残留固体加水溶解、静置,取上层清液用pH试纸检验溶液呈强碱性。试回答下列问题:
(1)方案一可能的反应方程式为: ;
(2)方案二中溶液呈强碱性的原因是: ;如果向此强碱性溶液中加入足量的盐酸,对应的离子方程式为: ;
(3)以上两个方案中Na2O2的作用是否相同?请简要说明: 。
[解析]解决本题的关键是对反应原理的推测与分析,应该要联想到如下两个反应:2Na2O2+2CO2=2Na2CO3+O2; 2Na2O2+2H2O=4NaOH+O2↑;
由此可见,Na2O2虽然不是碱性氧化物,但在反应中的表现常常是先释放一个“O”后再类似于碱性氧化物“Na2O”(为此,可以在思维时把Na2O2想成是“Na2O·O”)。所以,可以很快写出两个方案中的相应方程式:
方案一:2KMnO4+Na2O2 O2↑+K2MnO4+Na2MnO4;
方案二:2Al2O3+2Na2O2 4NaAlO2+O2↑。
[答案] (1)2KMnO4+Na2O2 O2↑+K2MnO4+Na2MnO4;
(2)2Al2O3+2Na2O2 4NaAlO2+O2↑,NaAlO2溶于水后水解使溶液呈较强碱性 AlO2-+4H+=2H2O+Al3+;
(3)方案一中Na2O2是还原剂,而方案二中Na2O2既是氧化剂又是还原剂。
[互动课堂]
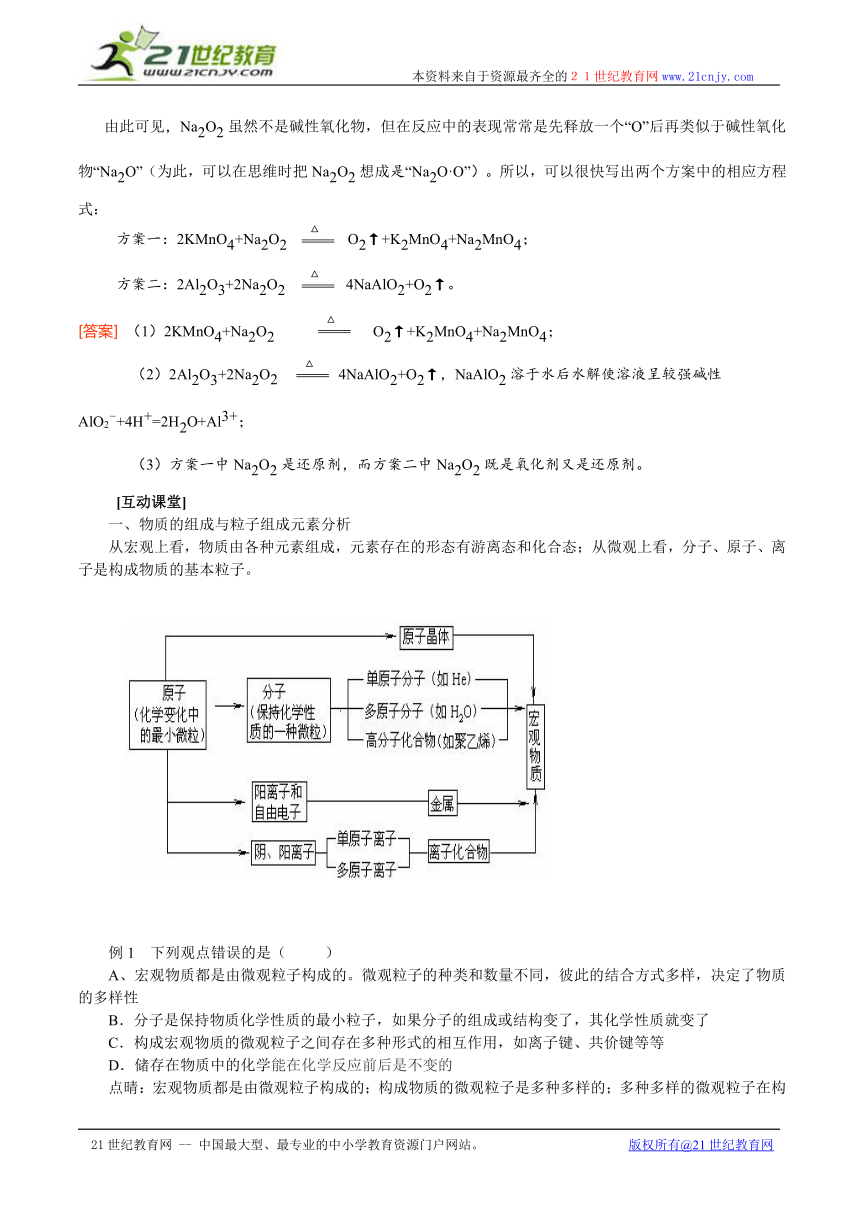
一、物质的组成与粒子组成元素分析
从宏观上看,物质由各种元素组成,元素存在的形态有游离态和化合态;从微观上看,分子、原子、离子是构成物质的基本粒子。
例1 下列观点错误的是( )
A、宏观物质都是由微观粒子构成的。微观粒子的种类和数量不同,彼此的结合方式多样,决定了物质的多样性
B.分子是保持物质化学性质的最小粒子,如果分子的组成或结构变了,其化学性质就变了
C.构成宏观物质的微观粒子之间存在多种形式的相互作用,如离子键、共价键等等
D.储存在物质中的化学能在化学反应前后是不变的
点晴:宏观物质都是由微观粒子构成的;构成物质的微观粒子是多种多样的;多种多样的微观粒子在构成物质时彼此之间存在相互作用(如离子键、共价键、分子间作用力等);一定种类和数量的微观粒子之间通过相互作用按照特定的方式结合才构成特定的物质;每种物质都有其自身独有的性质是因为每种物质都有其独特的微观组成和结构;物质一旦发生了化学变化,其微观结构乃至微观组成就改变了;这种微观组成、结构、粒子间相互作用的方式等的改变决定了化学反应是从环境中吸收能量,还是往环境中释放能量。
例2.下列变化过程一定不可逆的是 ( )
A、溶解 B、水解 C、电解 D、电离
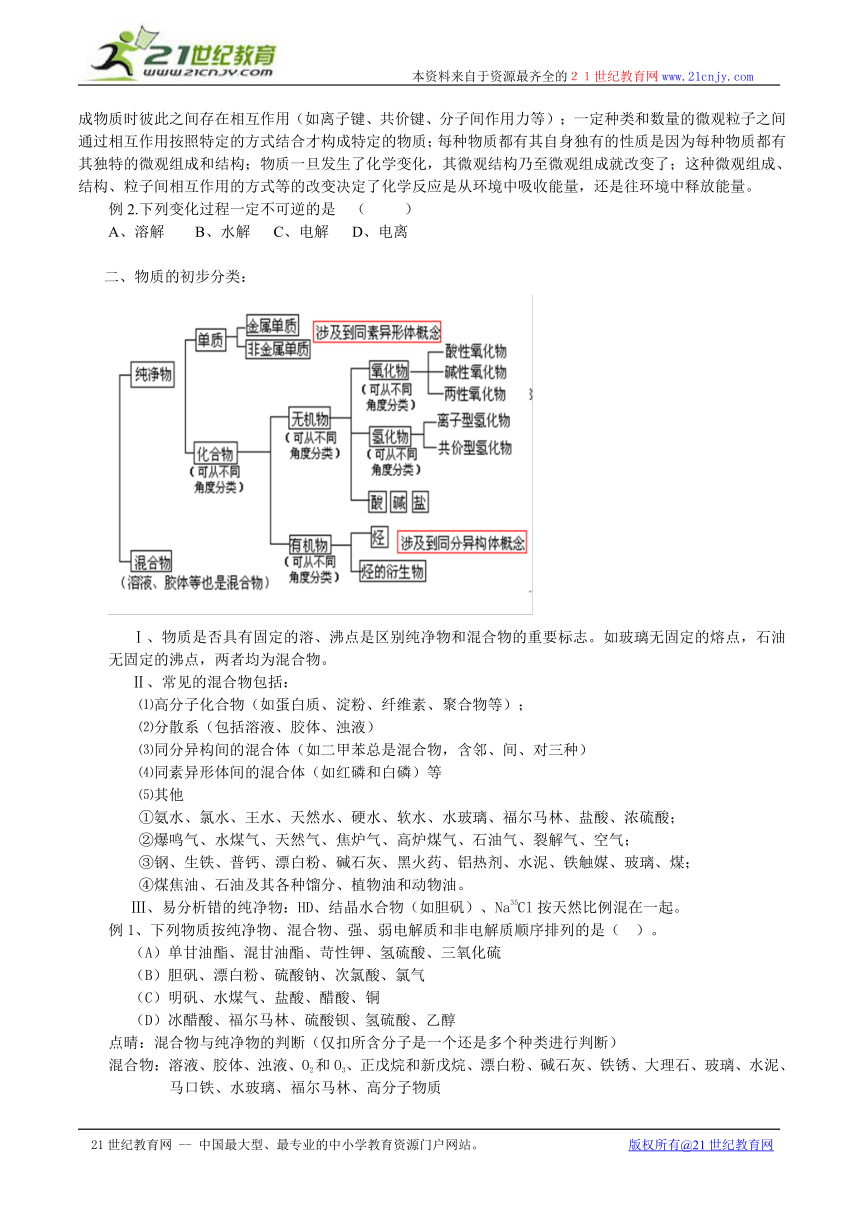
二、物质的初步分类:
Ⅰ、物质是否具有固定的溶、沸点是区别纯净物和混合物的重要标志。如玻璃无固定的熔点,石油无固定的沸点,两者均为混合物。
Ⅱ、常见的混合物包括:
⑴高分子化合物(如蛋白质、淀粉、纤维素、聚合物等);
⑵分散系(包括溶液、胶体、浊液)
⑶同分异构间的混合体(如二甲苯总是混合物,含邻、间、对三种)
⑷同素异形体间的混合体(如红磷和白磷)等
⑸其他
①氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、盐酸、浓硫酸;
②爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气;
③钢、生铁、普钙、漂白粉、碱石灰、黑火药、铝热剂、水泥、铁触媒、玻璃、煤;
④煤焦油、石油及其各种馏分、植物油和动物油。
Ⅲ、易分析错的纯净物:HD、结晶水合物(如胆矾)、Na35Cl按天然比例混在一起。
例1、下列物质按纯净物、混合物、强、弱电解质和非电解质顺序排列的是( )。
(A)单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫
(B)胆矾、漂白粉、硫酸钠、次氯酸、氯气
(C)明矾、水煤气、盐酸、醋酸、铜
(D)冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇
点晴:混合物与纯净物的判断(仅扣所含分子是一个还是多个种类进行判断)
混合物:溶液、胶体、浊液、O2和O3、正戊烷和新戊烷、漂白粉、碱石灰、铁锈、大理石、玻璃、水泥、马口铁、水玻璃、福尔马林、高分子物质
纯净物:HD、石墨、结晶水合物、石炭酸、水银等
例3、下列物质一定是纯净物的是 ( )
A、只含有一种元素的物质 B、福尔马林
C、在加热条件下8gCuO与0.2gH2完全反应后的固体残余物 D、胆矾
三、化学用语
注意:化学用语、表达式书写注意事项:
1、原子(离子)结构示意图
2、电子式
3、电离方程式
4、水解方程式
5、电极方程式
6、热化学方程式
例4.下列各项中表达正确的是 ( )
A.F—的结构示意图: B.CO2的分子模型示意图:
C.NaCl的电子式: D.N2的结构式::N≡N:
例5 .表示下列变化的化学用语正确的是( )
A. NaHCO3的水解:
B.金属铝溶于NaOH溶液:
C.钢铁吸氧腐蚀的正极反应式:
D.1 L 0.5 mol/L稀硫酸与1L 1 mol/L氢氧化钠溶液反应放出57.3 kJ的热:
[随堂练习]
1.下列物质中有固定组成的是
A、空气 B、石蜡 C、氨水 D、二氧化碳气体
2.下列物质中有固定熔点的是
A、玻璃 B、冰 C、蔗糖 D、天然橡胶
3.下列物质中属于纯净物的一组是( )
(1)冰水混合物 (2)爆鸣气 (3)铝热剂 (4)普通玻璃 (5)水玻璃
(6)漂白粉 (7)二甲苯 (8)TNT(9)溴苯 (10)C4H8 (11)含氧40%的氧化镁 (12)混甘油酯(13)福尔马林 (14)密封保存的NO2气体
A.(2)(3)(4)(6
B.(7)(10)(12)(13)(14)
C.(1)(8)(9)(11)
D.(1)(4)(8)(9)(11)(12)
4. 氧化物概念辨析:
⑴酸性氧化物一定是非金属氧化物。( )
⑵非金属氧化物不一定是酸性氧化物。( )
⑶金属氧化物不一定是碱性氧化物。( )
⑷酸酐一定是酸性氧化物。( )
⑸碱一定都有对应的的碱性氧化物。( )
⑹既能跟酸溶液,又能跟碱溶液反应的氧化物不一定就是两性氧化物。( )
5.下列化学用语中错误的是 ( )
A、二氧化硅的化学式为SiO2
B、Br-的结构示意图为
C、次氯酸的结构式为H—Cl—O
D、一氯甲烷的电子式为
6.化学科学需要借助化学专用语言来描述,判断下列化学用语是否正确
A、硫原子的电子式 ( )
B、乙酸的最简式CH2O ( )
C、乙烯的结构简图C2H4 ( )
D、质量数为37的氯原子3717Cl ( )
E、CO2的电子式 ( )
F、氢有三种同位素:1H、1H、1H,帮可以形成三种分子 ( )
G、氧气和臭氧、红磷和白磷、普通水和重水互称为同素异形体( )
H、原子晶体中共价键越强,熔点越高 ( )
I、O2与O2互为同位素 ( )
J、C2H4与C6H12互为同系物 ( )
K、碳和硅是同族元素,故CO2和SiO2结构相似,性质相似 ( )
L、P4和NO2都是共价化合物
M、酸根活泼金属反应一定生成盐和氢气
N、金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
7、下列叙述正确的是 ( )
A、金属与盐溶液反应都是置换反应
B、阴离子都只有还原性
C、与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D、分子晶体中都存在范德瓦尔斯力,可能不存在共价健
8、请写出表示下列物质的化学用语
(1)NH4H的电子式 (9)次氯酸的电子式
(2)硝基苯的结构简式 (10)氯化氢的电子式
(3)葡萄糖的实验式 (11)过氧化钠的电子式
(4)甲烷分子的比例模型 (12)氮分子的电子式
(5)CO2的电子式: (13)羟基的电子式
(6)Cl-的结构示意图 (14)氢氧根离子的电子式
(7)乙烯的结构简式 (15)用电子式表示氯化镁的形成过程
(8)质量数为37的氯原子 ; 。
[仿真练习]
1. “混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根离子的盐如KAl(SO4)2, 下列各化合物中属于混盐的是( )
A. CaOCl2 B. (NH4)2Fe(SO4)2
C. Na2O2 D. K3[Fe(CN)6]
[解析] A答案中CaOCl2中Ca为+2价,O为-2价,所以,Cl平均化合价为0,可肯定该化合物中一个氯为-1价,另一个氯为+1价,所以,CaOCl2可写成下式:CaCl2·Ca(ClO)2,所以,它是一种混盐。
2. 下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸④复分解反应中既没有生成水,也没有生成沉淀和气体
②两种氧化物发生反应有气体生成 ③两种酸的溶液充分反应后溶液呈中性
A. ①③ B. ②④ C. ①②④ D. ①②③④
[解析] 举例如下:①H2S+CuSO4=CuS↓+H2SO4;②NO2+SO2 =NO+SO3;
③2H2S+H2SO3=3S↓+3H2O;④CH3COONa+HCl=NaCl+ CH3COOH。
3、由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125 mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是( )
A. 水分子的化学性质改变 B. 水分子中氢氧键缩短
C. 水分子间的作用力减小 D. 水分子间结构、物理性质改变
[解析] 小分子团水仍是以分子为基本单位组成的聚集体,所以分子结构并没有改变,分子中的氢氧键并没有缩短,化学性质更不会改变。它改变的是分子间的结构,分子间作用力增强,物理性质改变。
4. 已知在一定条件下2KClO3与I2之间可以发生反应:2KClO3+I2=2KIO3+Cl2,此反应属于 反应(从分解、化合、置换、复分解反应中选择填空)。有人根据此反应认为碘的非金属性比氯强,你认为对吗?(正确与否,都需说明原因)。 ;
[解析] 一般来说,非金属元素置换非金属元素,非金属单质是作为氧化剂和氧化产物,在此情况下,可以说是强的非金属性元素置换弱的非金属性元素;金属元素置换金属元素,金属单质是还原剂和还原产物,在此情况下,可以说是强的金属性元素置换弱的金属性元素。本题是非金属元素之间的置换反应,但非金属单质不是作为氧化剂和氧化产物,上述规则不适用。本题反应中I2是作为还原剂,Cl2也是还原产物,可以说是I元素还原性强于Cl元素,以此反推,可知是Cl元素非金属性强于I元素非金属性。
[答案] 置换,非金属性是指元素原子的得电子能力,而此反应中I元素是失电子。
[考后升华]
(1)正确掌握本部分内容是突破其他考点的基础。只有充分理解这些概念的内涵和外延及其之间的相互关系,才能提高分析和解决化学问题的能力。
(2)高考中对这部分知识的单独考查出现频率不高,常以选择、填空或简答形式出现,如选择题中往往以“下列说法正确的是”出现,以考查考生对这些概念的辨析、应用能力。
; H=-114.6 KJ/mol
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
物质的组成、分类、变化和化学用语
[考情探究]
1. 常考知识点:物质的分子、原子、离子、元素等概念的含义以及原子团的定义;混合物和纯净物、单质和化合物、金属和非金属的概念;正确书写常见元素的名称、符号、离子符号;电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;质量守恒定律的含义;热化学方程式的含义;化学方程式、离子方程式、电离方程式、电极反应式的正确书写。
2. 命题新动向:无论是基础型试题还是能力型试题,问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用语来表述答案,每年的高考化学试题的答案中化学用语占有很大的比例。多年来高考对本专题知识的考查,无论是内容还是难度方面都较为稳定,估计近几年也不会有很大的变化。但在题型方面的多样化还是有可能的,如出现基本概念的简答题等,基本概念与其他部分化学知识和能力的相互渗透和结合将会有所加强
[知识网络]
[ 题 型 ]
题型一 物质组成、性质、分类、变化等概念的判断性考察
例1、我国拥有最大的稀土矿藏,提炼时使稀土元素(可用RE表示)与铁、锰等分离的方法之一是往处理矿石后的硫酸浸出液中加入Na2SO4粉末,使稀土元素转化为沉淀,反应可表示为:RE2(SO4)3+xNa2SO4+yH2O=RE2(SO4)3·xNa2SO4·yH2O↓ 以下叙述正确的是( )
A. 该反应一定在碱性溶液中进行 B. 该反应类型属于复分解反应
C. 反应表现出Na2SO4的反应活性很大 D. 该反应类型属于化合反应
[解析] 该反应没有离子互换,所以,不是复分解反应。 [答案] D
例2、 对于复分解反应:X+Y=Z+W,下列叙述正确的是( )
A. 若Z是强酸,则X和Y必有一种是酸,而不能是强酸的酸式盐
B. 若Y是强碱,X是盐,则Z或W必有一种是弱碱
C. 若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
D. 若W是弱碱,Z是盐,则X和Y必有一种是强碱
[解析] A答案的反例:NaHSO4+NaCl =HCl↑+Na2SO4;B答案的反例:NaHCO3+NaOH=Na2CO3+H2O;C答案正确;D答案反例:氨水与铝盐反应生成弱碱Al(OH)3和铵盐。 [答案] C
题型二 用化学方程式、离子方程式、结构简式等基本化学用语进行化学描述
例3、 某研究性小组探究实验室制O2的新原理,经过查阅大量的文献资料,最终选定了两种方案:
方案一:选择KMnO4、Na2O2固体混合受热
方案二:选择Al2O3、Na2O2固体混合受热
两种方案都能较快较好的产生O2(假定两种方案中都无反应物剩余)。但方案一产生O2后残留的固体为绿色(K2MnO4和Na2MnO4的混合物),方案二的残留固体加水溶解、静置,取上层清液用pH试纸检验溶液呈强碱性。试回答下列问题:
(1)方案一可能的反应方程式为: ;
(2)方案二中溶液呈强碱性的原因是: ;如果向此强碱性溶液中加入足量的盐酸,对应的离子方程式为: ;
(3)以上两个方案中Na2O2的作用是否相同?请简要说明: 。
[解析]解决本题的关键是对反应原理的推测与分析,应该要联想到如下两个反应:2Na2O2+2CO2=2Na2CO3+O2; 2Na2O2+2H2O=4NaOH+O2↑;
由此可见,Na2O2虽然不是碱性氧化物,但在反应中的表现常常是先释放一个“O”后再类似于碱性氧化物“Na2O”(为此,可以在思维时把Na2O2想成是“Na2O·O”)。所以,可以很快写出两个方案中的相应方程式:
方案一:2KMnO4+Na2O2 O2↑+K2MnO4+Na2MnO4;
方案二:2Al2O3+2Na2O2 4NaAlO2+O2↑。
[答案] (1)2KMnO4+Na2O2 O2↑+K2MnO4+Na2MnO4;
(2)2Al2O3+2Na2O2 4NaAlO2+O2↑,NaAlO2溶于水后水解使溶液呈较强碱性 AlO2-+4H+=2H2O+Al3+;
(3)方案一中Na2O2是还原剂,而方案二中Na2O2既是氧化剂又是还原剂。
[互动课堂]
一、物质的组成与粒子组成元素分析
从宏观上看,物质由各种元素组成,元素存在的形态有游离态和化合态;从微观上看,分子、原子、离子是构成物质的基本粒子。
例1 下列观点错误的是( )
A、宏观物质都是由微观粒子构成的。微观粒子的种类和数量不同,彼此的结合方式多样,决定了物质的多样性
B.分子是保持物质化学性质的最小粒子,如果分子的组成或结构变了,其化学性质就变了
C.构成宏观物质的微观粒子之间存在多种形式的相互作用,如离子键、共价键等等
D.储存在物质中的化学能在化学反应前后是不变的
点晴:宏观物质都是由微观粒子构成的;构成物质的微观粒子是多种多样的;多种多样的微观粒子在构成物质时彼此之间存在相互作用(如离子键、共价键、分子间作用力等);一定种类和数量的微观粒子之间通过相互作用按照特定的方式结合才构成特定的物质;每种物质都有其自身独有的性质是因为每种物质都有其独特的微观组成和结构;物质一旦发生了化学变化,其微观结构乃至微观组成就改变了;这种微观组成、结构、粒子间相互作用的方式等的改变决定了化学反应是从环境中吸收能量,还是往环境中释放能量。
例2.下列变化过程一定不可逆的是 ( )
A、溶解 B、水解 C、电解 D、电离
二、物质的初步分类:
Ⅰ、物质是否具有固定的溶、沸点是区别纯净物和混合物的重要标志。如玻璃无固定的熔点,石油无固定的沸点,两者均为混合物。
Ⅱ、常见的混合物包括:
⑴高分子化合物(如蛋白质、淀粉、纤维素、聚合物等);
⑵分散系(包括溶液、胶体、浊液)
⑶同分异构间的混合体(如二甲苯总是混合物,含邻、间、对三种)
⑷同素异形体间的混合体(如红磷和白磷)等
⑸其他
①氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、盐酸、浓硫酸;
②爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气;
③钢、生铁、普钙、漂白粉、碱石灰、黑火药、铝热剂、水泥、铁触媒、玻璃、煤;
④煤焦油、石油及其各种馏分、植物油和动物油。
Ⅲ、易分析错的纯净物:HD、结晶水合物(如胆矾)、Na35Cl按天然比例混在一起。
例1、下列物质按纯净物、混合物、强、弱电解质和非电解质顺序排列的是( )。
(A)单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫
(B)胆矾、漂白粉、硫酸钠、次氯酸、氯气
(C)明矾、水煤气、盐酸、醋酸、铜
(D)冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇
点晴:混合物与纯净物的判断(仅扣所含分子是一个还是多个种类进行判断)
混合物:溶液、胶体、浊液、O2和O3、正戊烷和新戊烷、漂白粉、碱石灰、铁锈、大理石、玻璃、水泥、马口铁、水玻璃、福尔马林、高分子物质
纯净物:HD、石墨、结晶水合物、石炭酸、水银等
例3、下列物质一定是纯净物的是 ( )
A、只含有一种元素的物质 B、福尔马林
C、在加热条件下8gCuO与0.2gH2完全反应后的固体残余物 D、胆矾
三、化学用语
注意:化学用语、表达式书写注意事项:
1、原子(离子)结构示意图
2、电子式
3、电离方程式
4、水解方程式
5、电极方程式
6、热化学方程式
例4.下列各项中表达正确的是 ( )
A.F—的结构示意图: B.CO2的分子模型示意图:
C.NaCl的电子式: D.N2的结构式::N≡N:
例5 .表示下列变化的化学用语正确的是( )
A. NaHCO3的水解:
B.金属铝溶于NaOH溶液:
C.钢铁吸氧腐蚀的正极反应式:
D.1 L 0.5 mol/L稀硫酸与1L 1 mol/L氢氧化钠溶液反应放出57.3 kJ的热:
[随堂练习]
1.下列物质中有固定组成的是
A、空气 B、石蜡 C、氨水 D、二氧化碳气体
2.下列物质中有固定熔点的是
A、玻璃 B、冰 C、蔗糖 D、天然橡胶
3.下列物质中属于纯净物的一组是( )
(1)冰水混合物 (2)爆鸣气 (3)铝热剂 (4)普通玻璃 (5)水玻璃
(6)漂白粉 (7)二甲苯 (8)TNT(9)溴苯 (10)C4H8 (11)含氧40%的氧化镁 (12)混甘油酯(13)福尔马林 (14)密封保存的NO2气体
A.(2)(3)(4)(6
B.(7)(10)(12)(13)(14)
C.(1)(8)(9)(11)
D.(1)(4)(8)(9)(11)(12)
4. 氧化物概念辨析:
⑴酸性氧化物一定是非金属氧化物。( )
⑵非金属氧化物不一定是酸性氧化物。( )
⑶金属氧化物不一定是碱性氧化物。( )
⑷酸酐一定是酸性氧化物。( )
⑸碱一定都有对应的的碱性氧化物。( )
⑹既能跟酸溶液,又能跟碱溶液反应的氧化物不一定就是两性氧化物。( )
5.下列化学用语中错误的是 ( )
A、二氧化硅的化学式为SiO2
B、Br-的结构示意图为
C、次氯酸的结构式为H—Cl—O
D、一氯甲烷的电子式为
6.化学科学需要借助化学专用语言来描述,判断下列化学用语是否正确
A、硫原子的电子式 ( )
B、乙酸的最简式CH2O ( )
C、乙烯的结构简图C2H4 ( )
D、质量数为37的氯原子3717Cl ( )
E、CO2的电子式 ( )
F、氢有三种同位素:1H、1H、1H,帮可以形成三种分子 ( )
G、氧气和臭氧、红磷和白磷、普通水和重水互称为同素异形体( )
H、原子晶体中共价键越强,熔点越高 ( )
I、O2与O2互为同位素 ( )
J、C2H4与C6H12互为同系物 ( )
K、碳和硅是同族元素,故CO2和SiO2结构相似,性质相似 ( )
L、P4和NO2都是共价化合物
M、酸根活泼金属反应一定生成盐和氢气
N、金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
7、下列叙述正确的是 ( )
A、金属与盐溶液反应都是置换反应
B、阴离子都只有还原性
C、与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D、分子晶体中都存在范德瓦尔斯力,可能不存在共价健
8、请写出表示下列物质的化学用语
(1)NH4H的电子式 (9)次氯酸的电子式
(2)硝基苯的结构简式 (10)氯化氢的电子式
(3)葡萄糖的实验式 (11)过氧化钠的电子式
(4)甲烷分子的比例模型 (12)氮分子的电子式
(5)CO2的电子式: (13)羟基的电子式
(6)Cl-的结构示意图 (14)氢氧根离子的电子式
(7)乙烯的结构简式 (15)用电子式表示氯化镁的形成过程
(8)质量数为37的氯原子 ; 。
[仿真练习]
1. “混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根离子的盐如KAl(SO4)2, 下列各化合物中属于混盐的是( )
A. CaOCl2 B. (NH4)2Fe(SO4)2
C. Na2O2 D. K3[Fe(CN)6]
[解析] A答案中CaOCl2中Ca为+2价,O为-2价,所以,Cl平均化合价为0,可肯定该化合物中一个氯为-1价,另一个氯为+1价,所以,CaOCl2可写成下式:CaCl2·Ca(ClO)2,所以,它是一种混盐。
2. 下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸④复分解反应中既没有生成水,也没有生成沉淀和气体
②两种氧化物发生反应有气体生成 ③两种酸的溶液充分反应后溶液呈中性
A. ①③ B. ②④ C. ①②④ D. ①②③④
[解析] 举例如下:①H2S+CuSO4=CuS↓+H2SO4;②NO2+SO2 =NO+SO3;
③2H2S+H2SO3=3S↓+3H2O;④CH3COONa+HCl=NaCl+ CH3COOH。
3、由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。一次饮用125 mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是( )
A. 水分子的化学性质改变 B. 水分子中氢氧键缩短
C. 水分子间的作用力减小 D. 水分子间结构、物理性质改变
[解析] 小分子团水仍是以分子为基本单位组成的聚集体,所以分子结构并没有改变,分子中的氢氧键并没有缩短,化学性质更不会改变。它改变的是分子间的结构,分子间作用力增强,物理性质改变。
4. 已知在一定条件下2KClO3与I2之间可以发生反应:2KClO3+I2=2KIO3+Cl2,此反应属于 反应(从分解、化合、置换、复分解反应中选择填空)。有人根据此反应认为碘的非金属性比氯强,你认为对吗?(正确与否,都需说明原因)。 ;
[解析] 一般来说,非金属元素置换非金属元素,非金属单质是作为氧化剂和氧化产物,在此情况下,可以说是强的非金属性元素置换弱的非金属性元素;金属元素置换金属元素,金属单质是还原剂和还原产物,在此情况下,可以说是强的金属性元素置换弱的金属性元素。本题是非金属元素之间的置换反应,但非金属单质不是作为氧化剂和氧化产物,上述规则不适用。本题反应中I2是作为还原剂,Cl2也是还原产物,可以说是I元素还原性强于Cl元素,以此反推,可知是Cl元素非金属性强于I元素非金属性。
[答案] 置换,非金属性是指元素原子的得电子能力,而此反应中I元素是失电子。
[考后升华]
(1)正确掌握本部分内容是突破其他考点的基础。只有充分理解这些概念的内涵和外延及其之间的相互关系,才能提高分析和解决化学问题的能力。
(2)高考中对这部分知识的单独考查出现频率不高,常以选择、填空或简答形式出现,如选择题中往往以“下列说法正确的是”出现,以考查考生对这些概念的辨析、应用能力。
; H=-114.6 KJ/mol
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
