化学能与热能
图片预览




文档简介
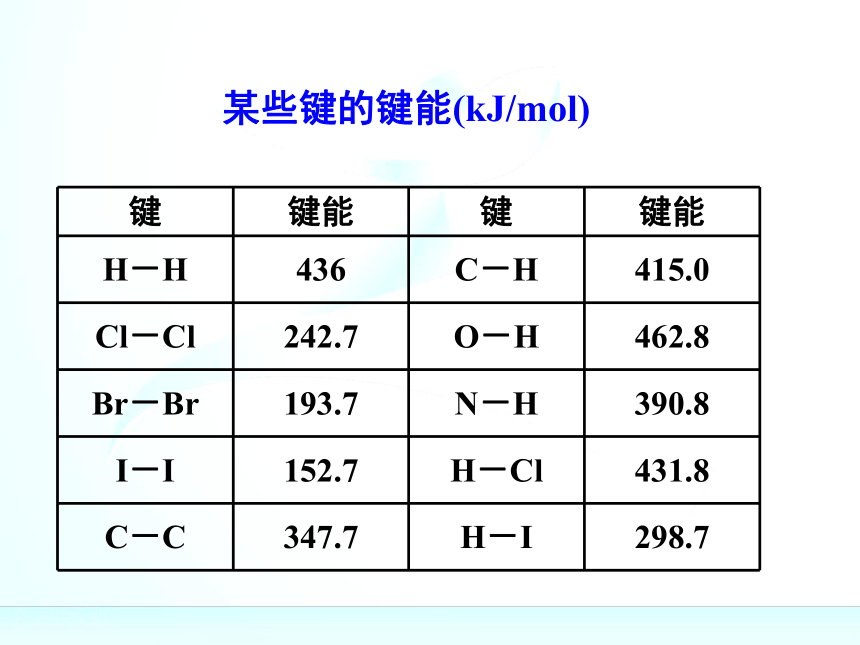
课件56张PPT。第一节 化学能与热能 主讲教师:谭达林湘乡二中关于键能:
关于键能:
实验测得,在25℃,101KPa条件下,将
1molH2(H-H)变为2molH原子需吸收436kJ
能量,而2molH原子变成1molH2(H-H)放出
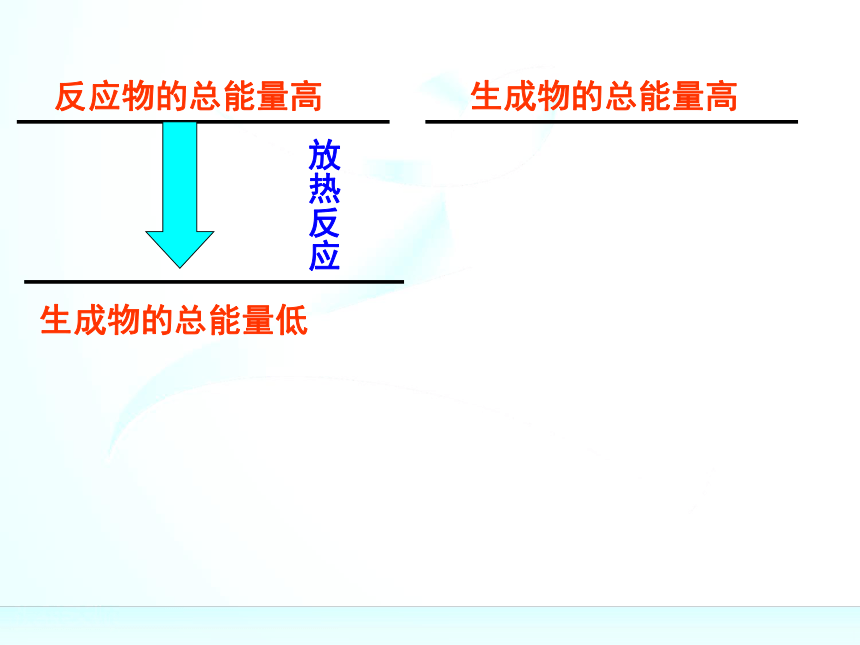
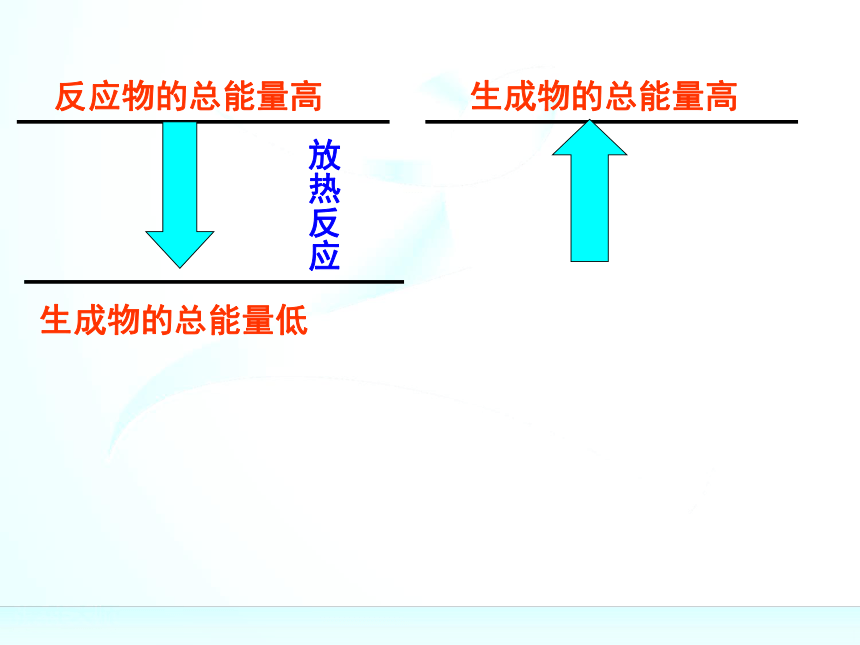
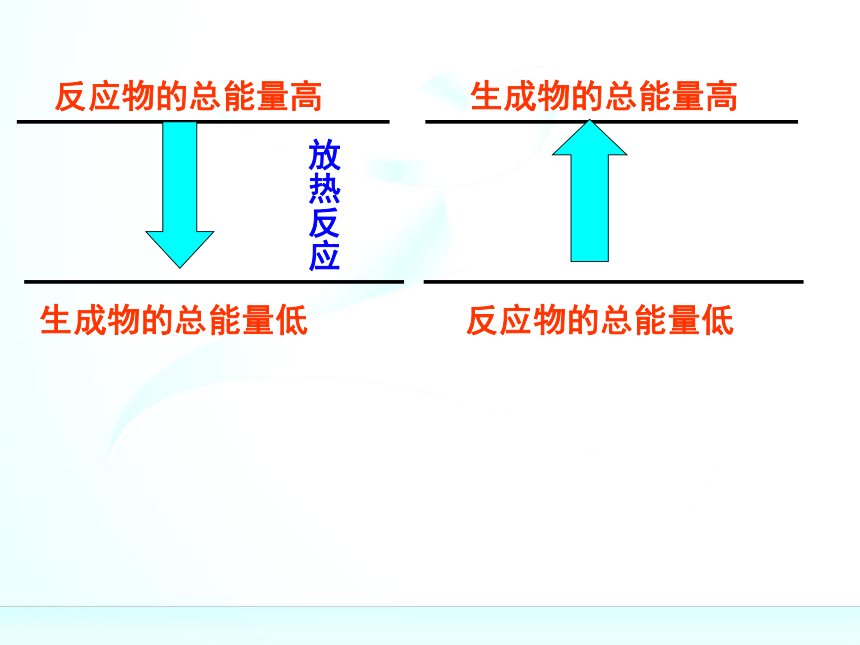
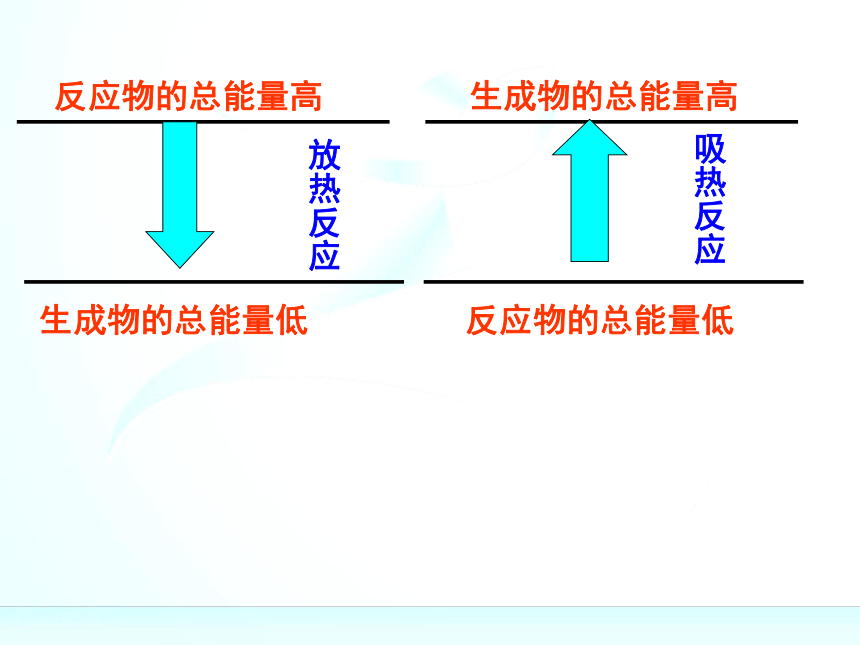
436kJ能量,这个能量就是H-H的键能。某些键的键能(kJ/mol)反应物的总能量高反应物的总能量高反应物的总能量高生成物的总能量低反应物的总能量高生成物的总能量低放热反应反应物的总能量高生成物的总能量低生成物的总能量高放热反应反应物的总能量高生成物的总能量低生成物的总能量高放热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量化学反应的过程,可以看成是能量的“贮存”或
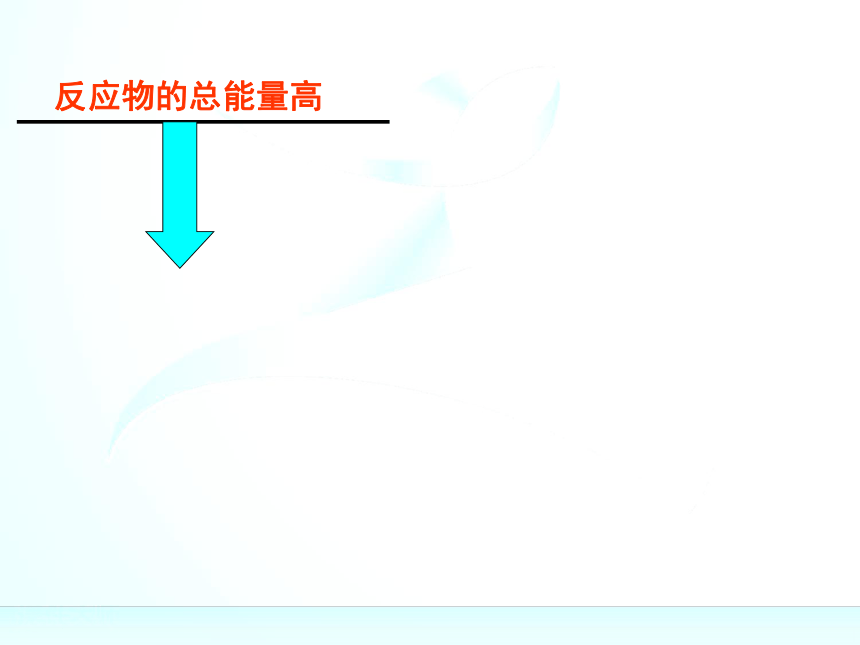
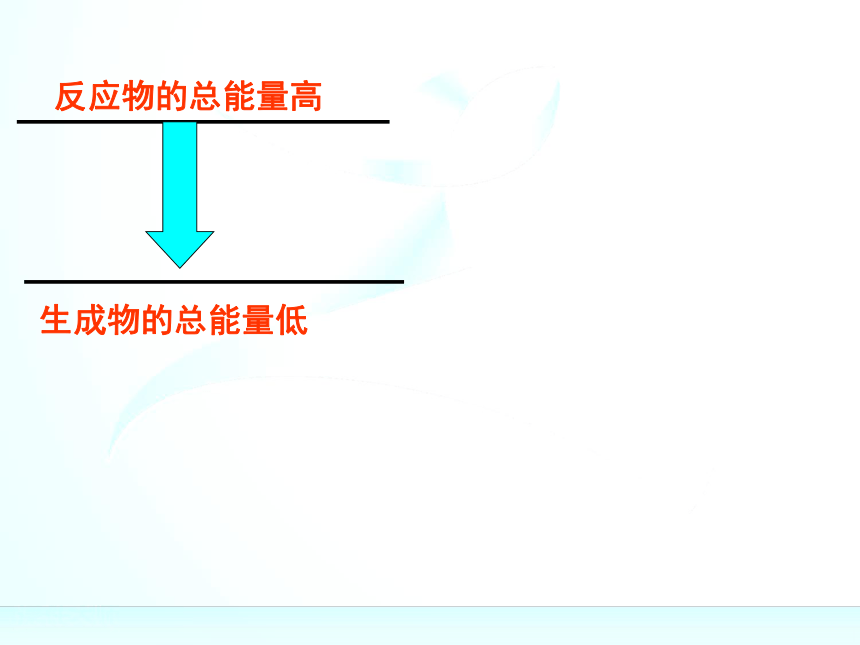
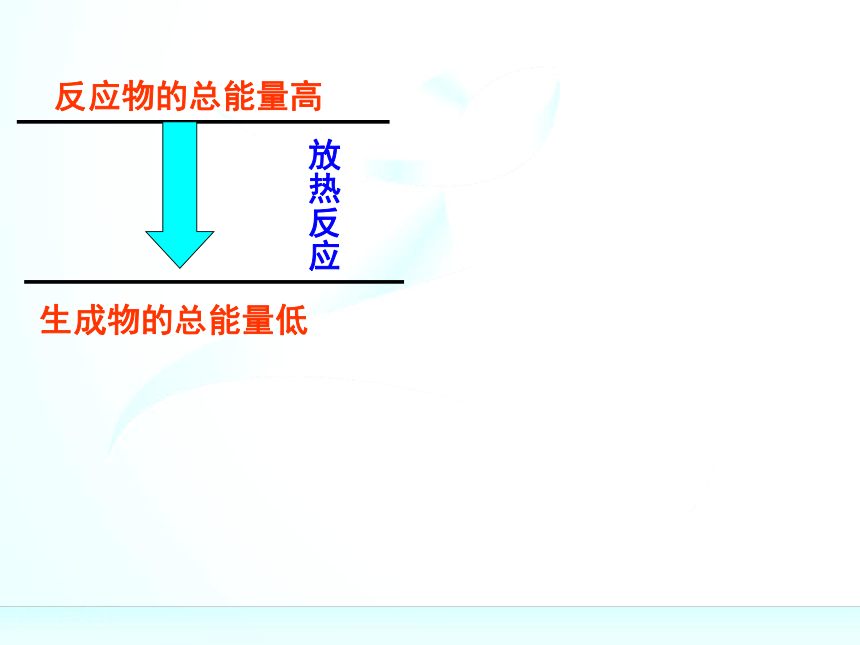
“释放”的过程规律:规律:(1)如果反应物所具有的总能量高于生成物所具有
的总能量,那么在发生化学反应时,就有部分能量
以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有
的总能量,那么在发生化学反应时,反应物就需要
吸收能量,才能转化为生成物。关于键能与物质的能量之间的关系关于键能与物质的能量之间的关系化学键的断裂和形成是化学反应中能量变化的主要
原因——化学键的断裂要吸收能量,化学键的形成
要放出能量。
知道一个化学反应是吸收能量还是放出能量,决定
于反应物的总能量与生成物的总能量的相对高低。
关于键能与物质的能量之间的关系化学键的断裂和形成是化学反应中能量变化的主要
原因——化学键的断裂要吸收能量,化学键的形成
要放出能量。
知道一个化学反应是吸收能量还是放出能量,决定
于反应物的总能量与生成物的总能量的相对高低。
通常来说:键能越大,物质越稳定。物质越稳定,
则所具有的能量越低。物质能量越高就说明越容易反应。就像水总
是从高的地方往低的地方流一样,物质能量
高了就不稳定容易反应趋向与能量比较低的
状态。
键能越小说明这个键容易被破坏,同样说明
容易发生化学反应,所以两者是一致的,都
容易发生化学反应。相反,键能越大,同样
说明破坏这个键所需要的能量很大,难以发
生化学反应。 表示如下:
Q1+E1=Q2+E2 Q代表从外界吸进来的能量(热量)。 E代表物质本身的能量 根据能量守恒。 Q1大于Q2则E2大于E1 表示如下:
Q1+E1=Q2+E2 Q代表从外界吸进来的能量(热量)。 E代表物质本身的能量 根据能量守恒。 Q1大于Q2则E2大于E1 键能越大,说明分子内的原子间结合更加牢固,
不容易被拆开,要拆开需要提供更大的能量;
从另一个角度说,该物质化学性质不活泼,本身
能量低,要使之发生化学反应,需要外界供其更
大的能量才会发生化学反应。信息:物质能量越低,物质越稳定
例:反应 C(石墨)== C(金刚石)是吸热反应
问题:石墨和金刚石哪一个更稳定?关于中和热信息:物质能量越低,物质越稳定
例:反应 C(石墨)== C(金刚石)是吸热反应
问题:石墨和金刚石哪一个更稳定?解答:E生成物总能量 >E反应物总能量 吸热反应
因此,金刚石的能量大于石墨的能量
所以,石墨更稳定关于中和热放热反应和吸热反应放热反应和吸热反应放热反应和吸热反应热量放出放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ 放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应;中和反应;大多数化合反应;金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O吸收热量所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O吸收热量所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。Ba(OH)2·8H2O+2NH4Cl == BaCl2 + 2NH3↑+10H2O放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。吸收热量△Ba(OH)2·8H2O+2NH4Cl == BaCl2 + 2NH3↑+10H2OC + CO2== 2COH2+CuO==Cu + H2OC+H2O(g)== CO+H2 △ △1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH2. 下列反应中既属于氧化还原反应同时
又是吸热反应的是:A.Ba(OH)2·8H2O与NH4Cl反应B.镁与稀盐酸 C.灼热的炭与CO2D.甲烷与O2反应随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH2. 下列反应中既属于氧化还原反应同时
又是吸热反应的是:A.Ba(OH)2·8H2O与NH4Cl反应B.镁与稀盐酸 C.灼热的炭与CO2D.甲烷与O2反应随堂练习:3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小分析:反应物的状态,数量和生成物的数量
都相同,但由于气态水转化为液态要放出一
定数量的热量点燃点燃3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小分析:反应物的状态,数量和生成物的数量
都相同,但由于气态水转化为液态要放出一
定数量的热量∴Q2>Q1点燃点燃4. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃4. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小两式数量相同,S由固态吸收热量转化为气态,
在氧化燃烧生成SO2。其放出热量的总和小于
由气态S直接燃烧所放出的热量点燃点燃5. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃5. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小固态C氧化为CO,释放出热量Q1,CO是气体
燃料,和O2反应生成CO2,又释放热量Q3,
两次释放热量的总和Q1+Q3,等于固态C氧化
为气态CO2释放的热量Q2,∴Q2>Q1点燃点燃6. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃状态相同,但数量后式仅是前式的一半,
释放的热量也应是前式的一半,Q2<Q16. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃 巩固练习: 巩固练习:BC 巩固练习: 巩固练习:CD 巩固练习: 巩固练习:C
关于键能:
实验测得,在25℃,101KPa条件下,将
1molH2(H-H)变为2molH原子需吸收436kJ
能量,而2molH原子变成1molH2(H-H)放出
436kJ能量,这个能量就是H-H的键能。某些键的键能(kJ/mol)反应物的总能量高反应物的总能量高反应物的总能量高生成物的总能量低反应物的总能量高生成物的总能量低放热反应反应物的总能量高生成物的总能量低生成物的总能量高放热反应反应物的总能量高生成物的总能量低生成物的总能量高放热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量化学反应的过程,可以看成是能量的“贮存”或
“释放”的过程规律:规律:(1)如果反应物所具有的总能量高于生成物所具有
的总能量,那么在发生化学反应时,就有部分能量
以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有
的总能量,那么在发生化学反应时,反应物就需要
吸收能量,才能转化为生成物。关于键能与物质的能量之间的关系关于键能与物质的能量之间的关系化学键的断裂和形成是化学反应中能量变化的主要
原因——化学键的断裂要吸收能量,化学键的形成
要放出能量。
知道一个化学反应是吸收能量还是放出能量,决定
于反应物的总能量与生成物的总能量的相对高低。
关于键能与物质的能量之间的关系化学键的断裂和形成是化学反应中能量变化的主要
原因——化学键的断裂要吸收能量,化学键的形成
要放出能量。
知道一个化学反应是吸收能量还是放出能量,决定
于反应物的总能量与生成物的总能量的相对高低。
通常来说:键能越大,物质越稳定。物质越稳定,
则所具有的能量越低。物质能量越高就说明越容易反应。就像水总
是从高的地方往低的地方流一样,物质能量
高了就不稳定容易反应趋向与能量比较低的
状态。
键能越小说明这个键容易被破坏,同样说明
容易发生化学反应,所以两者是一致的,都
容易发生化学反应。相反,键能越大,同样
说明破坏这个键所需要的能量很大,难以发
生化学反应。 表示如下:
Q1+E1=Q2+E2 Q代表从外界吸进来的能量(热量)。 E代表物质本身的能量 根据能量守恒。 Q1大于Q2则E2大于E1 表示如下:
Q1+E1=Q2+E2 Q代表从外界吸进来的能量(热量)。 E代表物质本身的能量 根据能量守恒。 Q1大于Q2则E2大于E1 键能越大,说明分子内的原子间结合更加牢固,
不容易被拆开,要拆开需要提供更大的能量;
从另一个角度说,该物质化学性质不活泼,本身
能量低,要使之发生化学反应,需要外界供其更
大的能量才会发生化学反应。信息:物质能量越低,物质越稳定
例:反应 C(石墨)== C(金刚石)是吸热反应
问题:石墨和金刚石哪一个更稳定?关于中和热信息:物质能量越低,物质越稳定
例:反应 C(石墨)== C(金刚石)是吸热反应
问题:石墨和金刚石哪一个更稳定?解答:E生成物总能量 >E反应物总能量 吸热反应
因此,金刚石的能量大于石墨的能量
所以,石墨更稳定关于中和热放热反应和吸热反应放热反应和吸热反应放热反应和吸热反应热量放出放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ 放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应;中和反应;大多数化合反应;金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O吸收热量所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O吸收热量所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。Ba(OH)2·8H2O+2NH4Cl == BaCl2 + 2NH3↑+10H2O放热反应和吸热反应热量放出Fe+2HCl==FeCl2+H2↑ HCl+NaOH==NaCl+H2O所有燃烧反应、中和反应、大多数化合反应、金属和酸的反应等。吸收热量△Ba(OH)2·8H2O+2NH4Cl == BaCl2 + 2NH3↑+10H2OC + CO2== 2COH2+CuO==Cu + H2OC+H2O(g)== CO+H2 △ △1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH2. 下列反应中既属于氧化还原反应同时
又是吸热反应的是:A.Ba(OH)2·8H2O与NH4Cl反应B.镁与稀盐酸 C.灼热的炭与CO2D.甲烷与O2反应随堂练习:1. 下列物质加入水中显著放热的是:A.生石灰 B.酒精C.固体NaCl D.固体NaOH2. 下列反应中既属于氧化还原反应同时
又是吸热反应的是:A.Ba(OH)2·8H2O与NH4Cl反应B.镁与稀盐酸 C.灼热的炭与CO2D.甲烷与O2反应随堂练习:3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小分析:反应物的状态,数量和生成物的数量
都相同,但由于气态水转化为液态要放出一
定数量的热量点燃点燃3. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小分析:反应物的状态,数量和生成物的数量
都相同,但由于气态水转化为液态要放出一
定数量的热量∴Q2>Q1点燃点燃4. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃4. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小两式数量相同,S由固态吸收热量转化为气态,
在氧化燃烧生成SO2。其放出热量的总和小于
由气态S直接燃烧所放出的热量点燃点燃5. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃5. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小固态C氧化为CO,释放出热量Q1,CO是气体
燃料,和O2反应生成CO2,又释放热量Q3,
两次释放热量的总和Q1+Q3,等于固态C氧化
为气态CO2释放的热量Q2,∴Q2>Q1点燃点燃6. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃状态相同,但数量后式仅是前式的一半,
释放的热量也应是前式的一半,Q2<Q16. 在同温、同压下,比较下列反应放出
热量Q1、Q2的大小点燃点燃 巩固练习: 巩固练习:BC 巩固练习: 巩固练习:CD 巩固练习: 巩固练习:C
