化学键(广东省汕头市金平区)
文档属性
| 名称 | 化学键(广东省汕头市金平区) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-03-26 00:00:00 | ||
图片预览






文档简介
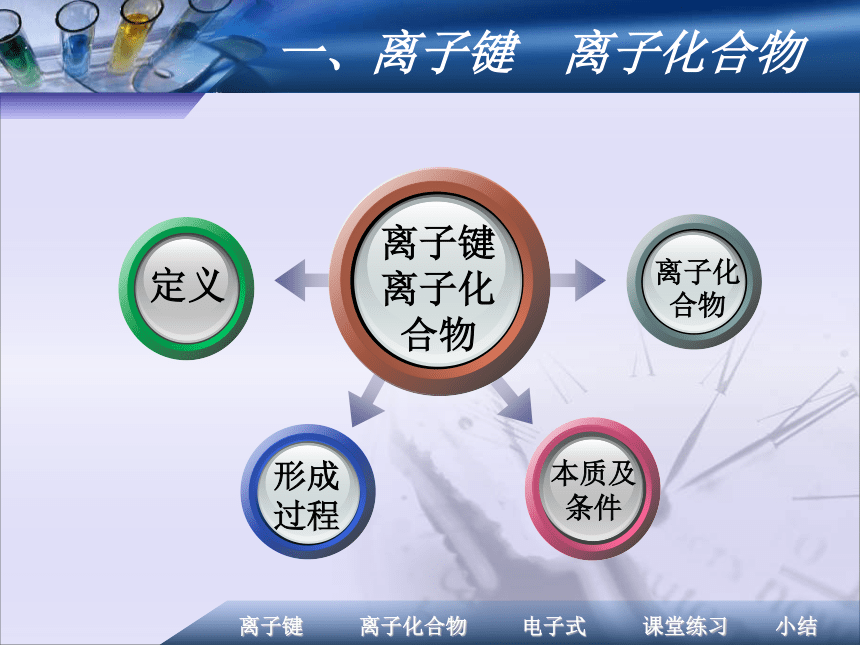
课件20张PPT。第三节 化学键 知识结构一、离子键 离子化合物离子键
离子化
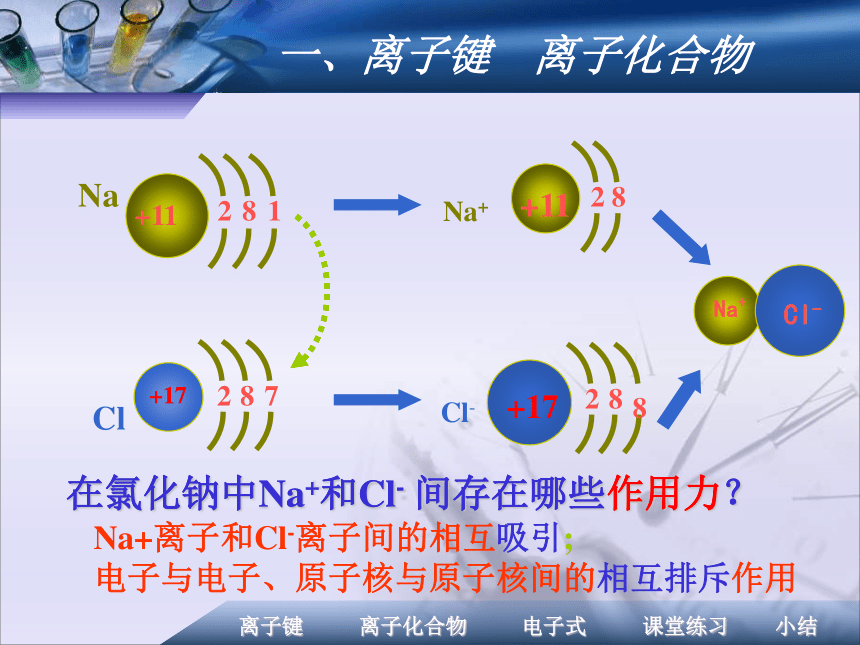
合物?钠和氯气剧烈反应生成氯化钠 小颗粒悬浮在气体中呈白烟状2Na+Cl2 = 2NaCl钠在氯气中剧烈燃烧,产生黄色火焰,瓶中充满白烟氯化钠的形成一、离子键 离子化合物在氯化钠中Na+和Cl- 间存在哪些作用力?Na+离子和Cl-离子间的相互吸引;
电子与电子、原子核与原子核间的相互排斥作用一、离子键 离子化合物在氯化钠中Na+和Cl- 间存在哪些作用力?1、定义:
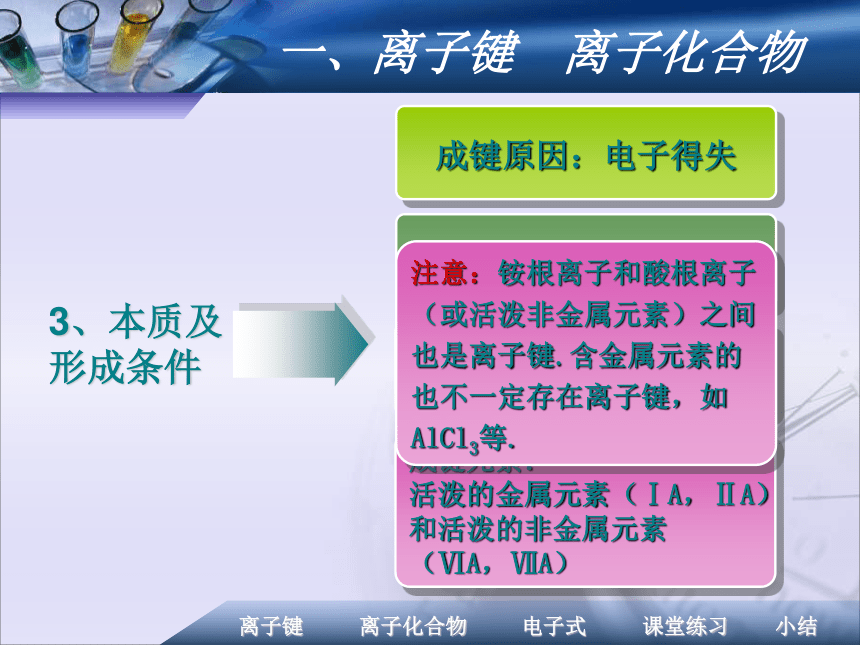
带相反电荷离子之间的相互作用 当阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。2、形成过程一、离子键 离子化合物3、本质及形成条件成键原因:电子得失成键元素:
活泼的金属元素(ⅠA,ⅡA)
和活泼的非金属元素
(ⅥA,ⅦA)成键粒子:阴阳离子成键本质:静电作用
(静电吸引和静电排斥)注意:铵根离子和酸根离子(或活泼非金属元素)之间也是离子键.含金属元素的也不一定存在离子键,如AlCl3等.
一、离子键 离子化合物4、离子化合物 — 含有离子键的化合物。 2、活泼的金属元素和酸根离子形成的盐
(如:NaNO3)3、铵根和酸根离子(或活泼非金属元素)形成的盐。
(如:NH4Cl , (NH4)2SO4 ) 1、活泼的金属元素(IA、IIA)和活泼的非金属元
素(VIA、VIIA)之间的化合物。(如:Na2O)4、金属阳离子与OH-(如 NaOH)思考 哪些物质中存在离子键呢?一、离子键 离子化合物⑴、原子的电子式:5、电子式电子式:在元素符号周围用小黑点 ·(或×)来
表示原子的最外层电子的式子。 一、离子键 离子化合物练习:用电子式表示:
1.氢原子 2.钙原子
3.氧原子 4.镁原子课堂练习一、离子键 离子化合物①阴离子的电子式⑵、离子的电子式:②阳离子的电子式即离子符号如NH4+:使每一个原子铺开,并都达到稳定结构要注明最外层电子数及电荷数一、离子键 离子化合物⑶、离子化合物: 由阳离子的电子式和阴离子的电子式组合而成.注意:相同的离子不能写在一起,一般对称
排列.一、离子键 离子化合物例:⑷、用电子式表示离子化合物的形成过程左侧写原子的电子式右侧写离子化合物的电子式注意:用弧形箭头表示电子转移的方向.一、离子键 离子化合物:O: [:Na:]+ [:S:]-2::::Ca2+[:Cl:]2- Na2+[:O:]2-::::::×××××讨论:下列电子式是否正确一、离子键 离子化合物课堂练习( A )
⑴.溴化钾的形成过程
⑵.氧化镁的形成过程
⑶.溴化钙的形成过程
2. 用电子式表示下列离子化合物的形成过程:课堂练习4、下列各数值表示有关元素的原子序数,能以离
子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和83、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物氯化钙中,两个氯原子间也存在
离子键CC课堂练习活泼金属原子活泼非金属原子电子式离子化合物离子晶体小结www.themegallery.comThank You !
离子化
合物?钠和氯气剧烈反应生成氯化钠 小颗粒悬浮在气体中呈白烟状2Na+Cl2 = 2NaCl钠在氯气中剧烈燃烧,产生黄色火焰,瓶中充满白烟氯化钠的形成一、离子键 离子化合物在氯化钠中Na+和Cl- 间存在哪些作用力?Na+离子和Cl-离子间的相互吸引;
电子与电子、原子核与原子核间的相互排斥作用一、离子键 离子化合物在氯化钠中Na+和Cl- 间存在哪些作用力?1、定义:
带相反电荷离子之间的相互作用 当阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。2、形成过程一、离子键 离子化合物3、本质及形成条件成键原因:电子得失成键元素:
活泼的金属元素(ⅠA,ⅡA)
和活泼的非金属元素
(ⅥA,ⅦA)成键粒子:阴阳离子成键本质:静电作用
(静电吸引和静电排斥)注意:铵根离子和酸根离子(或活泼非金属元素)之间也是离子键.含金属元素的也不一定存在离子键,如AlCl3等.
一、离子键 离子化合物4、离子化合物 — 含有离子键的化合物。 2、活泼的金属元素和酸根离子形成的盐
(如:NaNO3)3、铵根和酸根离子(或活泼非金属元素)形成的盐。
(如:NH4Cl , (NH4)2SO4 ) 1、活泼的金属元素(IA、IIA)和活泼的非金属元
素(VIA、VIIA)之间的化合物。(如:Na2O)4、金属阳离子与OH-(如 NaOH)思考 哪些物质中存在离子键呢?一、离子键 离子化合物⑴、原子的电子式:5、电子式电子式:在元素符号周围用小黑点 ·(或×)来
表示原子的最外层电子的式子。 一、离子键 离子化合物练习:用电子式表示:
1.氢原子 2.钙原子
3.氧原子 4.镁原子课堂练习一、离子键 离子化合物①阴离子的电子式⑵、离子的电子式:②阳离子的电子式即离子符号如NH4+:使每一个原子铺开,并都达到稳定结构要注明最外层电子数及电荷数一、离子键 离子化合物⑶、离子化合物: 由阳离子的电子式和阴离子的电子式组合而成.注意:相同的离子不能写在一起,一般对称
排列.一、离子键 离子化合物例:⑷、用电子式表示离子化合物的形成过程左侧写原子的电子式右侧写离子化合物的电子式注意:用弧形箭头表示电子转移的方向.一、离子键 离子化合物:O: [:Na:]+ [:S:]-2::::Ca2+[:Cl:]2- Na2+[:O:]2-::::::×××××讨论:下列电子式是否正确一、离子键 离子化合物课堂练习( A )
⑴.溴化钾的形成过程
⑵.氧化镁的形成过程
⑶.溴化钙的形成过程
2. 用电子式表示下列离子化合物的形成过程:课堂练习4、下列各数值表示有关元素的原子序数,能以离
子键相互结合成稳定化合物的是( )
A、10和19 B、6和16 C、11和17 D、14和83、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系能量降低
D、在离子化合物氯化钙中,两个氯原子间也存在
离子键CC课堂练习活泼金属原子活泼非金属原子电子式离子化合物离子晶体小结www.themegallery.comThank You !
