专题2单元1复习
图片预览






文档简介
课件17张PPT。 第一单元
化学反应速率和化学反应限度复习课化学反应速率单位时间内,反应物浓度的减少或者生成物浓度的增加
优化15页,5min第二题
计算对于反应aA+bB=cC+dD 有
V(A):V(B):V(C):V(D)=a:b:c:d
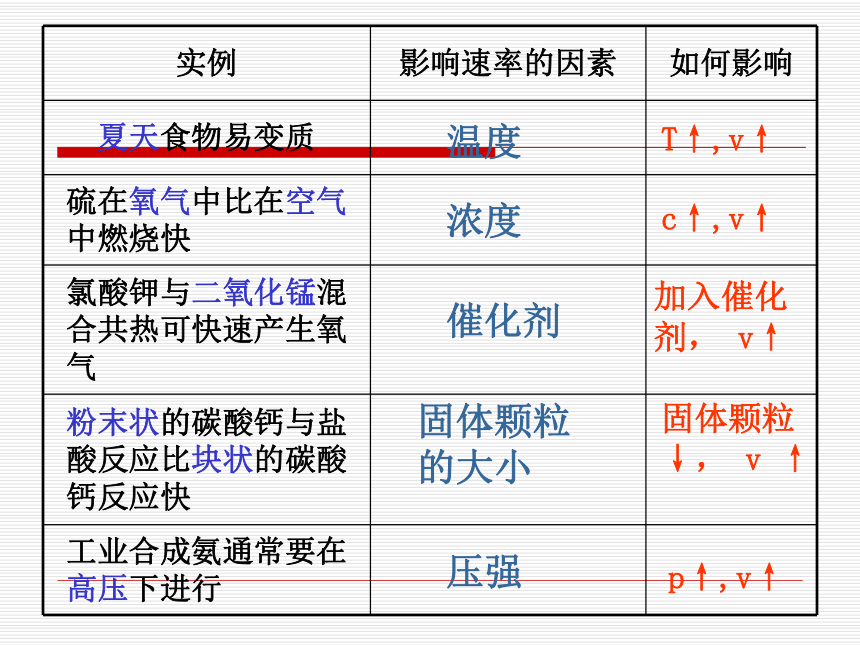
优化16页,第六题温度浓度催化剂固体颗粒的大小压强T↑,v↑c↑,v↑加入催化剂, v↑固体颗粒↓, v ↑p↑,v↑可逆反应(1)在相同条件下同时向正、反两个方向进行的反应称可逆反应。3H2 + N2 2NH32SO2 + O2 2SO3下列说法是否正确:
1. 氢气在氧气中燃烧生成水,水在电解时生成氢气和氧气,H2+ O2 = H2O是可逆反应。
2. 硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3. 氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。可逆反应的概念及其特点①相同条件下,正反应和逆反应同时发生
②反应物、生成物共同存在
③可逆反应有一定的限度(反应不能进行到底)2.可逆反应特点1.下列为可逆反应的是 ( )
H2与O2点燃可化合成水,水电解可生成H2
和O2,因此H2与O2的反应是可逆反应。
B. 在催化剂的作用下,SO2与O2反应生成SO3的同时,SO3又有分解。
C. 合成氨的反应,在现有技术条件下,其转化率总
是达不到百分百。
D. 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应是可逆反应。练 习BC在一定条件下,向一固定容积的容器中投入2molNO2进行反应:2NO2 2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是 ( )
A. 2 mol NO、0.75 mol O2
B. 1 mol NO2、1.2 mol NO
C. 2 mol NO
D. 0.7 mol O2D1.化学平衡状态的定义 指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。2.化学平衡状态的特征动动态平衡: v(正) ≠0; v(逆) ≠0等定变v(正)= v(逆) ≠0c(B) 或 n(B) 或 ω(B) 一定条件改变→平衡改变逆化学平衡的研究对象是可逆反应 (1) v正 = v逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。3.化学平衡状态的标志13 3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成n molA,同时生成3n molB
A练习(2)反应混合物中各组成成分的含量保持不变(浓度标志): ① 各组成成分的质量、物质的量、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
15 3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
C. A、B、C的物质的量浓度保持不变
D. A、B、C的分子数之比为1 :3 :2
C练习4. 下列说法中可以充分说明反应:
P(气)+Q(气) R(气)+S(气) , 在恒温下已
达平衡状态的是 ( )
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化B练 习5.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是 ( )
A. 1个N≡N键断裂的同时,有3个H-H键形成
B. 1个N≡N键断裂的同时,有3个H-H键断裂
C. 1个N≡N键断裂的同时,有6个N-H键断裂
D. 1个N≡N键断裂的同时,有6个N-H键形成AC
优化15页,5min第二题
计算对于反应aA+bB=cC+dD 有
V(A):V(B):V(C):V(D)=a:b:c:d
优化16页,第六题温度浓度催化剂固体颗粒的大小压强T↑,v↑c↑,v↑加入催化剂, v↑固体颗粒↓, v ↑p↑,v↑可逆反应(1)在相同条件下同时向正、反两个方向进行的反应称可逆反应。3H2 + N2 2NH32SO2 + O2 2SO3下列说法是否正确:
1. 氢气在氧气中燃烧生成水,水在电解时生成氢气和氧气,H2+ O2 = H2O是可逆反应。
2. 硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3. 氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。可逆反应的概念及其特点①相同条件下,正反应和逆反应同时发生
②反应物、生成物共同存在
③可逆反应有一定的限度(反应不能进行到底)2.可逆反应特点1.下列为可逆反应的是 ( )
H2与O2点燃可化合成水,水电解可生成H2
和O2,因此H2与O2的反应是可逆反应。
B. 在催化剂的作用下,SO2与O2反应生成SO3的同时,SO3又有分解。
C. 合成氨的反应,在现有技术条件下,其转化率总
是达不到百分百。
D. 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应是可逆反应。练 习BC在一定条件下,向一固定容积的容器中投入2molNO2进行反应:2NO2 2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是 ( )
A. 2 mol NO、0.75 mol O2
B. 1 mol NO2、1.2 mol NO
C. 2 mol NO
D. 0.7 mol O2D1.化学平衡状态的定义 指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。2.化学平衡状态的特征动动态平衡: v(正) ≠0; v(逆) ≠0等定变v(正)= v(逆) ≠0c(B) 或 n(B) 或 ω(B) 一定条件改变→平衡改变逆化学平衡的研究对象是可逆反应 (1) v正 = v逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。3.化学平衡状态的标志13 3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成n molA,同时生成3n molB
A练习(2)反应混合物中各组成成分的含量保持不变(浓度标志): ① 各组成成分的质量、物质的量、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
15 3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
C. A、B、C的物质的量浓度保持不变
D. A、B、C的分子数之比为1 :3 :2
C练习4. 下列说法中可以充分说明反应:
P(气)+Q(气) R(气)+S(气) , 在恒温下已
达平衡状态的是 ( )
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化B练 习5.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是 ( )
A. 1个N≡N键断裂的同时,有3个H-H键形成
B. 1个N≡N键断裂的同时,有3个H-H键断裂
C. 1个N≡N键断裂的同时,有6个N-H键断裂
D. 1个N≡N键断裂的同时,有6个N-H键形成AC
