盐类的水解
图片预览






文档简介
课件20张PPT。盐类水解盐溶液的酸、碱性(有连接)问题:盐类的水溶液是否一定呈中性呢? > 7 < 7 = 7 碱性 酸性 中性一 盐类水解CH3COONa水溶液显碱性,说明 [OH-] > [H+]CH3COONa = CH3COO- + Na+H2O H+ + OH-1 定义:在溶液中盐电离出来的离子与水所电离出来的H+或OH-结合生成弱电解质的反应,叫盐类的水解。+CH3COOH2 实质:
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。弱2 实质:
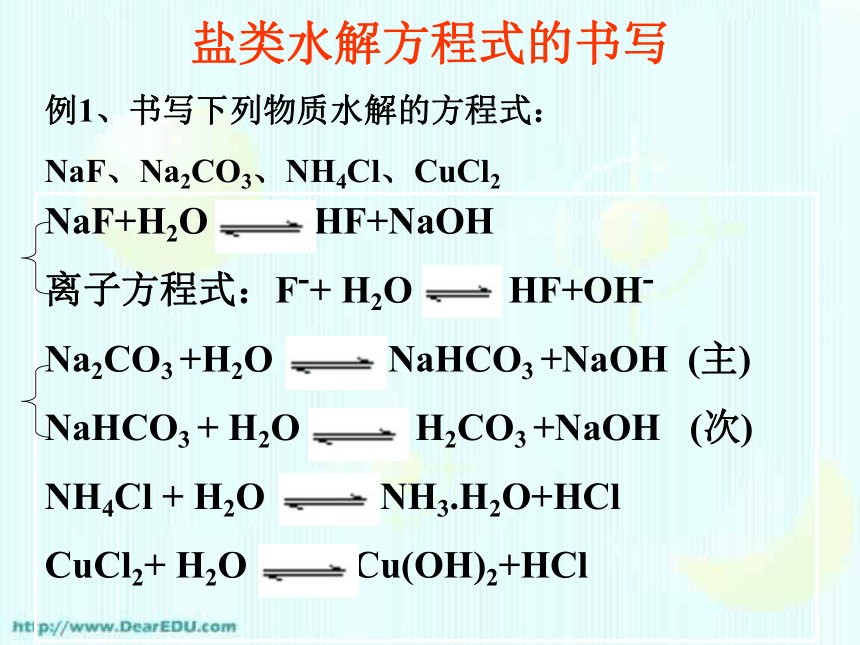
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。(1) 弱酸的酸根离子 弱酸H2O弱碱的阳离子 弱碱(2)表示方法:CH3COO-+H2O CH3COOH + OH-显碱性NH4+ +H2O NH3·H2O + H+显酸性盐类水解方程式的书写例1、书写下列物质水解的方程式:
NaF、Na2CO3、NH4Cl、CuCl2 NaF+H2O HF+NaOH
离子方程式:F-+ H2O HF+OH-
Na2CO3 +H2O NaHCO3 +NaOH (主)
NaHCO3 + H2O H2CO3 +NaOH (次)
NH4Cl + H2O NH3.H2O+HCl
CuCl2+ H2O Cu(OH)2+HCl
(3)酸 + 碱 盐 + 水 盐的水解反应是中和反应的逆反应,但一般不能进行到底。3 水解规律:(水解情况要根据盐的具体情况来判断)水解
谁弱谁水解
谁强显谁性
越弱越水解
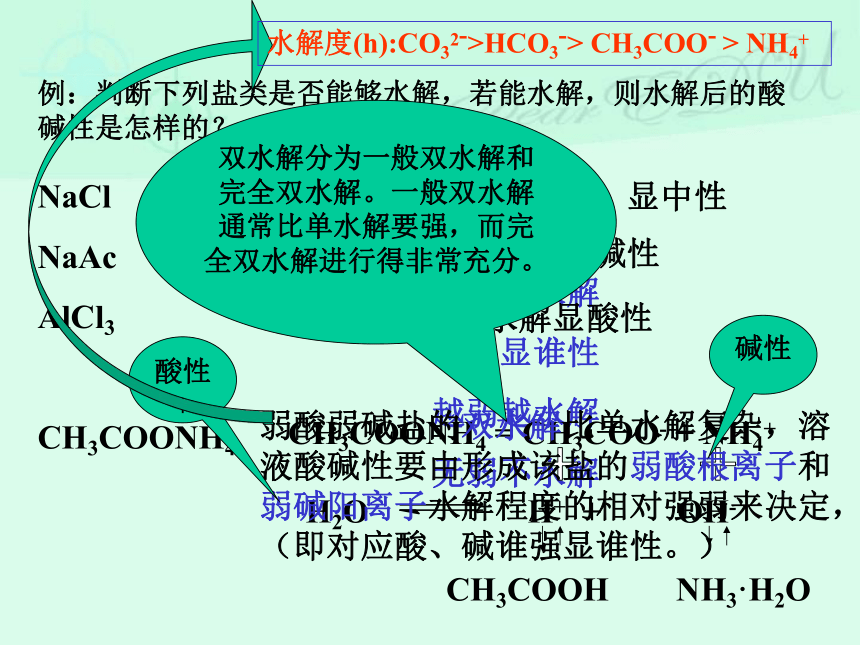
无弱不水解五言绝句中和水解度(h)=例:判断下列盐类是否能够水解,若能水解,则水解后的酸碱性是怎样的?NaCl K2SO4
NaAc Na2CO3
AlCl3
CH3COONH4水解
谁弱谁水解
谁强显谁性
越弱越水解
无弱不水解强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性弱酸弱碱盐的双水解比单水解复杂,溶液酸碱性要由形成该盐的弱酸根离子和弱碱阳离子水解程度的相对强弱来决定,(即对应酸、碱谁强显谁性。)碱性酸性+双水解分为一般双水解和完全双水解。一般双水解通常比单水解要强,而完全双水解进行得非常充分。水解度(h):CO32->HCO3-> CH3COO- > NH4+盐类水解方程式的书写规律 1、盐类水解(单水解、一般双水解)一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二步水解程度大得多(与电离类似),(相同物质的量浓度的正盐比对应酸式盐的水解程度大得多,故Na2CO3溶液碱性比NaHCO3强。)
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。(与多元弱碱的电离类似)
4、对于发生“完全双水解”的盐类,因水解彻底,故用“=”,同时有沉淀 和气体 产生。
5、多元弱酸的酸式氢根离子,水解和电离同步进行。多元弱酸的酸式氢根离子,
水解和电离程度的比较——
H2PO4-、HSO3-电离强于水解,显酸性;
HCO3-、 HPO42-、HS-水解强于电离,显碱性;
(注:此时溶液阳离子为强碱阳离子)
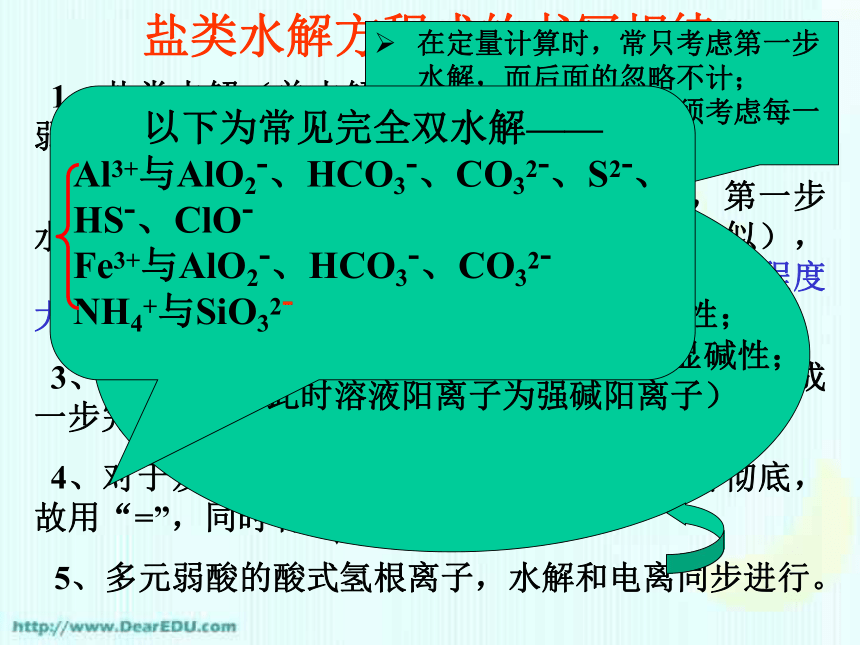
在定量计算时,常只考虑第一步水解,而后面的忽略不计;
在定性分析时,则必须考虑每一步水解。以下为常见完全双水解——
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-
影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。(与电离相似)
2、浓度:强酸弱碱盐、强碱弱酸盐的浓度越小,水解程度越大,加水稀释该盐,可以促进水解(与电离相似);*而事实上弱酸弱碱盐,水解程度与浓度无关(如无特别说明,不作考虑)
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 例2、书写下列物质水解的方程式: Al2S3、Mg3N2 Al2S3+3H2O 2Al(OH)3 +3H2S
Mg3N2+6H2O 3Mg(OH)2 +2NH3
以上为“完全双水解”,进行得非常充分,故用“=”连接,且打上了“ ”、“ ”符号。但并不是所有的弱酸弱碱盐水解都能进行“完全双水解”. 如:(NH4)2CO3 、NH4HCO3、 CH3COONH4
以下为常见完全双水解——
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-
Na2CO3(1mol/L)溶液的重要守恒关系—— Na2CO3 == 2Na+ + CO32-
1mol/L 2mol/L 1mol/L
CO32 - + H2O HCO3- + OH- (主)
平衡时: (1-a-b)mol/L amol/L (a+b) mol/L
HCO3- + H2O H2CO3 + OH- (次)
平衡时: amol/L bmol/L bmol/L
H2O H+ + OH-
平衡时: cmol/L cmol/L
[Na+] > [ CO32- ] > [ OH- ] > [ HCO3- ] > [ H+ ] (浓度关系)
[Na+ ]=2{[ CO32- ] + [ HCO3- ] +[ H2CO3 ] } (原子比例守恒)
[Na+ ]+[ H+ ]=2 [ CO32- ] + [ HCO3- ] + [ OH- ] (电荷守恒)
[OH- ]= [ HCO3- ] +2[ H2CO3 ] + [ H+ ] (由水电离的H+.OH-守恒)
NaHCO3 (1mol/L)溶液的重要守恒关系——NaHCO3 == Na+ + HCO3-
1mol/L 1mol/L 1mol/L
HCO3- + H2O H2CO3 + OH- (水解)
平衡时: (1-a-b)mol/L amol/L a mol/L
HCO3- CO32- + H+ (电离)
平衡时: (1-a-b) mol/L bmol/L bmol/L
H2O H+ + OH-
平衡时: cmol/L cmol/L
[Na+] > [HCO3-] > [OH-] > [H+] > [CO32-]
[Na+]= [HCO3-] + [CO32-] + [H2CO3]
[Na+]+[H+ ]=2 [ CO32- ] + [HCO3-] + [OH-]
[OH-]= [H2CO3] + [H+] -[CO32-]
水解强于电离
即(a>b)小结thank you盐类水解的应用 1、判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:
NaOH>NaClO>Na2CO3>NaHCO3>NaAc
>Na2SO4>(NH4)2SO4>NaHSO4
盐类水解的应用2、比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为mo/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b B巩固练习相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3① > ④> ②> ⑤> ③盐类水解的应用3、判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
如:Al3+、与HCO3-、CO32-,SiO32与NH4+-等,不能在溶液中大量共存。
4、配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 盐类水解的应用5、选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练:要制得较纯的FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S D盐类水解的应用6、化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈碱性。
7、某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在磨口玻璃塞的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 。盐类水解的应用8、溶液中,某些离子的除杂,需考虑盐的水解。
练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 A、D
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。弱2 实质:
盐组成中的离子与水作用生成弱电解质,促使水的电离平衡发生移动,使溶液显酸性、碱性或中性。(1) 弱酸的酸根离子 弱酸H2O弱碱的阳离子 弱碱(2)表示方法:CH3COO-+H2O CH3COOH + OH-显碱性NH4+ +H2O NH3·H2O + H+显酸性盐类水解方程式的书写例1、书写下列物质水解的方程式:
NaF、Na2CO3、NH4Cl、CuCl2 NaF+H2O HF+NaOH
离子方程式:F-+ H2O HF+OH-
Na2CO3 +H2O NaHCO3 +NaOH (主)
NaHCO3 + H2O H2CO3 +NaOH (次)
NH4Cl + H2O NH3.H2O+HCl
CuCl2+ H2O Cu(OH)2+HCl
(3)酸 + 碱 盐 + 水 盐的水解反应是中和反应的逆反应,但一般不能进行到底。3 水解规律:(水解情况要根据盐的具体情况来判断)水解
谁弱谁水解
谁强显谁性
越弱越水解
无弱不水解五言绝句中和水解度(h)=例:判断下列盐类是否能够水解,若能水解,则水解后的酸碱性是怎样的?NaCl K2SO4
NaAc Na2CO3
AlCl3
CH3COONH4水解
谁弱谁水解
谁强显谁性
越弱越水解
无弱不水解强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性弱酸弱碱盐的双水解比单水解复杂,溶液酸碱性要由形成该盐的弱酸根离子和弱碱阳离子水解程度的相对强弱来决定,(即对应酸、碱谁强显谁性。)碱性酸性+双水解分为一般双水解和完全双水解。一般双水解通常比单水解要强,而完全双水解进行得非常充分。水解度(h):CO32->HCO3-> CH3COO- > NH4+盐类水解方程式的书写规律 1、盐类水解(单水解、一般双水解)一般是比较微弱的,通常用“ ”表示,同时无沉淀和气体产生。
2、多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二步水解程度大得多(与电离类似),(相同物质的量浓度的正盐比对应酸式盐的水解程度大得多,故Na2CO3溶液碱性比NaHCO3强。)
3、多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。(与多元弱碱的电离类似)
4、对于发生“完全双水解”的盐类,因水解彻底,故用“=”,同时有沉淀 和气体 产生。
5、多元弱酸的酸式氢根离子,水解和电离同步进行。多元弱酸的酸式氢根离子,
水解和电离程度的比较——
H2PO4-、HSO3-电离强于水解,显酸性;
HCO3-、 HPO42-、HS-水解强于电离,显碱性;
(注:此时溶液阳离子为强碱阳离子)
在定量计算时,常只考虑第一步水解,而后面的忽略不计;
在定性分析时,则必须考虑每一步水解。以下为常见完全双水解——
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-
影响盐类水解的因素影响盐类水解的主要因素是盐本身的性质。另外还受外在因素影响:
1、温度:盐的水解反应是吸热反应,升高温度水解程度增大。(与电离相似)
2、浓度:强酸弱碱盐、强碱弱酸盐的浓度越小,水解程度越大,加水稀释该盐,可以促进水解(与电离相似);*而事实上弱酸弱碱盐,水解程度与浓度无关(如无特别说明,不作考虑)
3、溶液的酸、碱性:盐类水解后,溶液会呈不同的酸、碱性,因此控制溶液的酸、碱性,可以促进或抑制盐的水解,故在盐溶液中加入酸或碱都能影响盐的水解。 例2、书写下列物质水解的方程式: Al2S3、Mg3N2 Al2S3+3H2O 2Al(OH)3 +3H2S
Mg3N2+6H2O 3Mg(OH)2 +2NH3
以上为“完全双水解”,进行得非常充分,故用“=”连接,且打上了“ ”、“ ”符号。但并不是所有的弱酸弱碱盐水解都能进行“完全双水解”. 如:(NH4)2CO3 、NH4HCO3、 CH3COONH4
以下为常见完全双水解——
Al3+与AlO2-、HCO3-、CO32-、S2-、HS-、ClO-
Fe3+与AlO2-、HCO3-、CO32-
NH4+与SiO32-
Na2CO3(1mol/L)溶液的重要守恒关系—— Na2CO3 == 2Na+ + CO32-
1mol/L 2mol/L 1mol/L
CO32 - + H2O HCO3- + OH- (主)
平衡时: (1-a-b)mol/L amol/L (a+b) mol/L
HCO3- + H2O H2CO3 + OH- (次)
平衡时: amol/L bmol/L bmol/L
H2O H+ + OH-
平衡时: cmol/L cmol/L
[Na+] > [ CO32- ] > [ OH- ] > [ HCO3- ] > [ H+ ] (浓度关系)
[Na+ ]=2{[ CO32- ] + [ HCO3- ] +[ H2CO3 ] } (原子比例守恒)
[Na+ ]+[ H+ ]=2 [ CO32- ] + [ HCO3- ] + [ OH- ] (电荷守恒)
[OH- ]= [ HCO3- ] +2[ H2CO3 ] + [ H+ ] (由水电离的H+.OH-守恒)
NaHCO3 (1mol/L)溶液的重要守恒关系——NaHCO3 == Na+ + HCO3-
1mol/L 1mol/L 1mol/L
HCO3- + H2O H2CO3 + OH- (水解)
平衡时: (1-a-b)mol/L amol/L a mol/L
HCO3- CO32- + H+ (电离)
平衡时: (1-a-b) mol/L bmol/L bmol/L
H2O H+ + OH-
平衡时: cmol/L cmol/L
[Na+] > [HCO3-] > [OH-] > [H+] > [CO32-]
[Na+]= [HCO3-] + [CO32-] + [H2CO3]
[Na+]+[H+ ]=2 [ CO32- ] + [HCO3-] + [OH-]
[OH-]= [H2CO3] + [H+] -[CO32-]
水解强于电离
即(a>b)小结thank you盐类水解的应用 1、判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。
如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、NaOH 、(NH4)2SO4、NaHSO4等溶液,PH值由大到小的顺序为:
NaOH>NaClO>Na2CO3>NaHCO3>NaAc
>Na2SO4>(NH4)2SO4>NaHSO4
盐类水解的应用2、比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。
练:25℃时,在浓度均为1mo/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中[NH4+]分别为a、b、c(单位为mo/L),则下列判断正确的是( )
A.a=b=c B.c>a>b
C.b>a>c D.a>c>b B巩固练习相同浓度的下列溶液中,[CO32-]的大小关系依次为( )
①Na2CO3 ②NaHCO3 ③H2CO3
④(NH4)2CO3 ⑤NH4HCO3① > ④> ②> ⑤> ③盐类水解的应用3、判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生完全双水解,则不能在溶液中大量共存。
如:Al3+、与HCO3-、CO32-,SiO32与NH4+-等,不能在溶液中大量共存。
4、配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴对应的强酸,来抑制盐的水解。 盐类水解的应用5、选择制备盐的途径时,需考虑盐的水解。如制备Al2S3时,因无法在溶液中制取,会完全水解,只能由干法直接反应制取。
加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入HCl气体,以抑制FeCl3的水解,才能得到其固体。
练:要制得较纯的FeS沉淀,在FeCl2溶液中加入的试剂是( )
A.Na2S B.NaHS C.H2S D.(NH4)2S D盐类水解的应用6、化肥的合理使用,有时需考虑盐的水解。
如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用。因草木灰(有效成分K2CO3)水解呈碱性。
7、某些试剂的实验室存放,需要考虑盐的水解。
如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在磨口玻璃塞的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 。盐类水解的应用8、溶液中,某些离子的除杂,需考虑盐的水解。
练:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠
C. 碳酸钠 D. 碳酸镁 A、D
