新课标苏教版2009届高三化学第一轮复习----认识有机化合物3(浙江省衢州市常山县)
文档属性
| 名称 | 新课标苏教版2009届高三化学第一轮复习----认识有机化合物3(浙江省衢州市常山县) |

|
|
| 格式 | rar | ||
| 文件大小 | 283.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-04-03 00:00:00 | ||
图片预览










文档简介
课件32张PPT。第三讲 研究有机化合物的一般步骤和方法 认识有机化合物专题浙江常山三衢中学 郑亚龙2009年化学科课标及考试说明了解测定有机化合物的元素含量、相对分子质量一般方法,
能根据其确定有机化合物的分子式。
知道确定有机化合物结构的常用方法。 链接08高考(2008·宁夏)已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空:(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与足量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
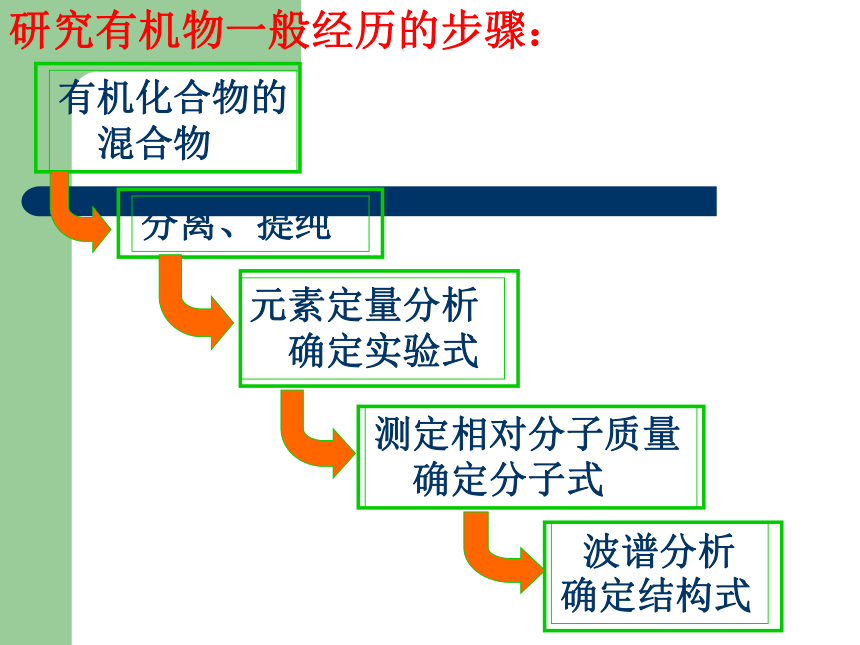
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。怎样获得一种纯净的有机产品呢?1)来源:
(天然或人工合成)→有机物粗产品2)粗产品→分离提纯思考研究有机物一般经历的步骤:资料 工业酒精:主要含约10~15 %的水、甲醇等杂质
沸点:
甲醇(沸点65℃)
95.6%的乙醇和4.4%水的共沸混合物(沸点78.15℃)
纯水沸点(100 ℃)
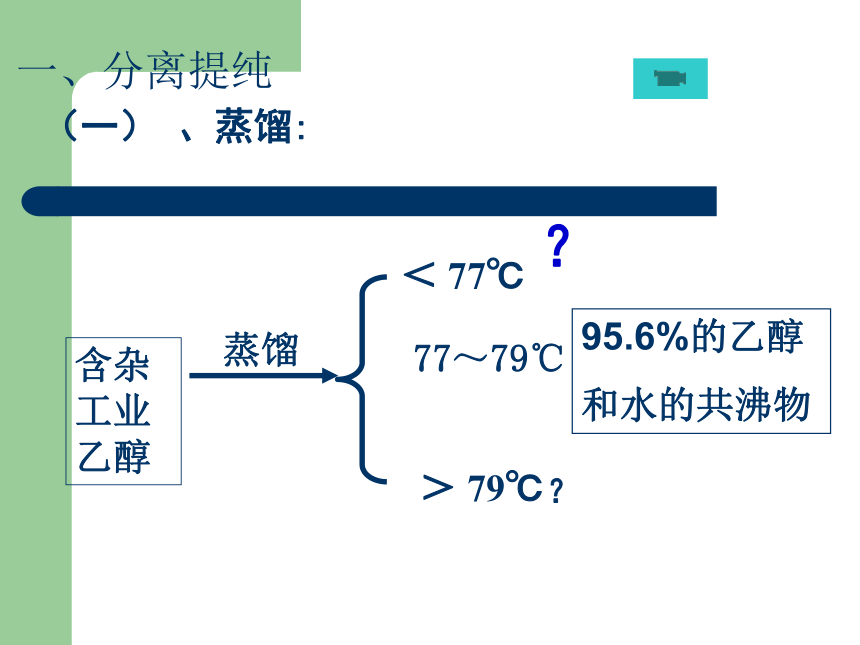
无水乙醇:99.5%乙醇和0.5%水
如何分离和提纯出95.6%的乙醇?一、分离提纯 (一) 、蒸馏:含杂工业乙醇95.6%的乙醇
和水的共沸物蒸馏< 77℃ 77~79℃> 79℃??蒸馏烧瓶冷凝管温度计尾接管冷水热水装置酒精灯锥形瓶 石棉网原理:
利用混合物中各种成分的沸点不同而使其分离。
适用条件:
液态、热稳定性较强有机物含少量杂质;
且与杂质沸点相差较大(30℃左右)
石油的蒸馏、制蒸馏水(1)在蒸馏烧瓶中放入少量沸石,防止液体暴沸;(2)温度计水银球的位置应与支管口处;
(3)蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于1/3;
(4)冷凝管中冷却水下进上出;
(5)使用前要检查装置的气密性!蒸馏操作应注意的问题:(二) 重结晶1、定义:将晶体用溶剂(蒸馏水)溶解,经过滤、蒸发冷却等步骤,再次析出晶体,得到更加纯净的晶体的方法。1) 杂质在溶剂中溶解度很小或大,易除去。
2)被提纯的物质的溶解度受温度影响较大,
升温时溶解度增大,降温时溶解度减小。2、要求:3、步骤:KNO3、NaCl混合液中提纯KNO3
粗苯甲酸的重结晶重结晶1、原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
2、主要仪器:分液漏斗3、操作过程:三、萃取洗涤、验漏振荡萃取分液4、萃取剂选取:(两不一大)
(1)萃取剂与原溶剂互不相溶;
(2)萃取剂与溶质不反应
(3)溶质在萃取剂中的溶解度比原溶剂要大得多;
5、常见的有机萃取剂: 四氯化碳、苯
6、萃取实验过程中要注意的问题:
(1)分液漏斗在洗涤干净以后,要检查其上口和玻璃塞处是否漏液体,只有不漏的才能使用;
(2)进行分液时,分液漏斗颈的尖端要靠在烧杯的内壁上。当分液漏斗内的下层液体恰好流尽时,要立即关闭分液漏斗的活塞,防止上层液体流出。
(3)要将上层液体从分液漏斗的上口倒出;
限用物理方法除去以下物质中的杂质 :固体:
①氯化银中的氯化钠;
将固体溶解、过滤,剩余的固体即是氯化银。
②硝酸钾中的氯化钠;
在热水中加入硝酸钾和氯化钠混合物至溶液饱和,降温析出晶体。
③氯化钠中的碘。
将氯化钠和碘的混合物加热至不再有紫色蒸气出液体:
①硝酸中的水;
在硝酸中加入Mg(NO3)2,蒸馏。
②提纯石油中的汽油、柴油;
将石油分馏。
③溴水中的水;
在混合液中加入苯,萃取分液。
④氢氧化铁胶体中的氯化铁;
将混合液放入半透膜中,把半透膜袋浸泡在流水中。
⑤蛋白质溶液中的水;
向混合液中加入硫酸钠固体,静置,过滤。
⑥氯化钠溶液中的水。
在蒸发皿中蒸发。限用物理方法除去以下物质中的杂质 :气体:
①空气中提取氮气;
将空气液化,低温分馏。
②氯气中的氯化氢。
将混合气通入 水中洗气。
限用物理方法除去以下物质中的杂质 :饱和食盐归纳总结:固体、液体、气体分离方法和适用范围。 结晶和重结晶法:根据混合物中各组分在某种
溶剂中的溶解度随温度变化不同的性质分
离提纯物质。
升华法:分离易升华和不升华固体混合物。
分馏法:根据几种互溶的液体沸点的差异较大
蒸馏分离。
萃取法:根据物质在两种互不相溶的溶剂中的
溶解度不同分离。
结晶和重结晶法:
升华法:
分馏法:
萃取法:
渗析法:分离胶体和溶液。
盐析法:根据混合物中某物质在加入某些盐后
溶解度改变而分离。
气体液化法:根据混合气体的沸点不同液化分离。
洗气法:根据不同气体在某种液体中的溶解程度
不同分离。
渗析法
盐析法
气体液化法
洗气法
请选出与以下方法相对应的仪器和用品:
玻璃棒、漏斗、漏斗架、滤纸、蒸发皿、石棉网、半透膜、接受器、冷凝管溶解过滤 蒸发浓缩 结晶(重结晶)法
蒸馏法 萃取分液法 升华法 渗析法在日常生活和工业生产分离提纯许多物质时,还要用到化学反应,在选择化学试剂时应遵守哪些原则?1.不增加新杂质,后续试剂应除去过量的前一试剂。
2.不减少欲被提纯的物质。
3.杂质与试剂生成的物质易与被提纯的物质易分离(状态类型不同)。 不增 易分不减溶解过滤:铁架台(带铁圈)、烧杯、漏斗、滤纸、 玻璃棒。蒸发浓缩:铁架台(带铁圈)、酒精灯、(泥三角)、 蒸发皿、玻璃棒。结晶(重结晶)法:烧杯、玻璃棒、蒸发皿、酒精灯、 漏斗、药匙、铁架台(带铁圈)蒸馏法:铁架台(带铁圈、铁夹)、酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器。萃取分液法:烧杯、漏斗架、分液漏斗。升华法:铁架台(带铁圈)、酒精灯、石棉网、 烧杯、圆底烧瓶。渗析法:半透膜、烧杯、玻璃棒。 [练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水???[练习3] 下列实验操作中错误的是 ( )
A、萃取时,萃取剂要求密度比水大
B、蒸馏时,应使温度计水银球应与蒸烧瓶支管口相平
C、过滤时,可直接将待过滤的悬浊液倒入漏斗中
D、蒸发时,待蒸发皿内出现大量晶体时,即应停止加热[练习4] 1,5-二硝基萘 和1,8-二硝基萘
中,后者可溶于质量分数大于98%的浓硫酸,而前者不能。简述如何将这两种异构体的混合物分离? AC萃取、分液[练习5]下列各组混合物的分离或提纯方法不正确的是 ( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用重结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和甲醇的混合物
D.用萃取和分液的方法可以分离碘和水的混合物A
能根据其确定有机化合物的分子式。
知道确定有机化合物结构的常用方法。 链接08高考(2008·宁夏)已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。请填空:(1)0.01molA在空气中充分燃烧需消耗氧气1.01L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1molA与足量的碳酸氢钠溶液反应可以放出3mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的的反应条件下,A与足量的乙醇反应生成B(C12H20O7),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是 ,该反应的化学方程式是 ;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ,② 。怎样获得一种纯净的有机产品呢?1)来源:
(天然或人工合成)→有机物粗产品2)粗产品→分离提纯思考研究有机物一般经历的步骤:资料 工业酒精:主要含约10~15 %的水、甲醇等杂质
沸点:
甲醇(沸点65℃)
95.6%的乙醇和4.4%水的共沸混合物(沸点78.15℃)
纯水沸点(100 ℃)
无水乙醇:99.5%乙醇和0.5%水
如何分离和提纯出95.6%的乙醇?一、分离提纯 (一) 、蒸馏:含杂工业乙醇95.6%的乙醇
和水的共沸物蒸馏< 77℃ 77~79℃> 79℃??蒸馏烧瓶冷凝管温度计尾接管冷水热水装置酒精灯锥形瓶 石棉网原理:
利用混合物中各种成分的沸点不同而使其分离。
适用条件:
液态、热稳定性较强有机物含少量杂质;
且与杂质沸点相差较大(30℃左右)
石油的蒸馏、制蒸馏水(1)在蒸馏烧瓶中放入少量沸石,防止液体暴沸;(2)温度计水银球的位置应与支管口处;
(3)蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于1/3;
(4)冷凝管中冷却水下进上出;
(5)使用前要检查装置的气密性!蒸馏操作应注意的问题:(二) 重结晶1、定义:将晶体用溶剂(蒸馏水)溶解,经过滤、蒸发冷却等步骤,再次析出晶体,得到更加纯净的晶体的方法。1) 杂质在溶剂中溶解度很小或大,易除去。
2)被提纯的物质的溶解度受温度影响较大,
升温时溶解度增大,降温时溶解度减小。2、要求:3、步骤:KNO3、NaCl混合液中提纯KNO3
粗苯甲酸的重结晶重结晶1、原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
2、主要仪器:分液漏斗3、操作过程:三、萃取洗涤、验漏振荡萃取分液4、萃取剂选取:(两不一大)
(1)萃取剂与原溶剂互不相溶;
(2)萃取剂与溶质不反应
(3)溶质在萃取剂中的溶解度比原溶剂要大得多;
5、常见的有机萃取剂: 四氯化碳、苯
6、萃取实验过程中要注意的问题:
(1)分液漏斗在洗涤干净以后,要检查其上口和玻璃塞处是否漏液体,只有不漏的才能使用;
(2)进行分液时,分液漏斗颈的尖端要靠在烧杯的内壁上。当分液漏斗内的下层液体恰好流尽时,要立即关闭分液漏斗的活塞,防止上层液体流出。
(3)要将上层液体从分液漏斗的上口倒出;
限用物理方法除去以下物质中的杂质 :固体:
①氯化银中的氯化钠;
将固体溶解、过滤,剩余的固体即是氯化银。
②硝酸钾中的氯化钠;
在热水中加入硝酸钾和氯化钠混合物至溶液饱和,降温析出晶体。
③氯化钠中的碘。
将氯化钠和碘的混合物加热至不再有紫色蒸气出液体:
①硝酸中的水;
在硝酸中加入Mg(NO3)2,蒸馏。
②提纯石油中的汽油、柴油;
将石油分馏。
③溴水中的水;
在混合液中加入苯,萃取分液。
④氢氧化铁胶体中的氯化铁;
将混合液放入半透膜中,把半透膜袋浸泡在流水中。
⑤蛋白质溶液中的水;
向混合液中加入硫酸钠固体,静置,过滤。
⑥氯化钠溶液中的水。
在蒸发皿中蒸发。限用物理方法除去以下物质中的杂质 :气体:
①空气中提取氮气;
将空气液化,低温分馏。
②氯气中的氯化氢。
将混合气通入 水中洗气。
限用物理方法除去以下物质中的杂质 :饱和食盐归纳总结:固体、液体、气体分离方法和适用范围。 结晶和重结晶法:根据混合物中各组分在某种
溶剂中的溶解度随温度变化不同的性质分
离提纯物质。
升华法:分离易升华和不升华固体混合物。
分馏法:根据几种互溶的液体沸点的差异较大
蒸馏分离。
萃取法:根据物质在两种互不相溶的溶剂中的
溶解度不同分离。
结晶和重结晶法:
升华法:
分馏法:
萃取法:
渗析法:分离胶体和溶液。
盐析法:根据混合物中某物质在加入某些盐后
溶解度改变而分离。
气体液化法:根据混合气体的沸点不同液化分离。
洗气法:根据不同气体在某种液体中的溶解程度
不同分离。
渗析法
盐析法
气体液化法
洗气法
请选出与以下方法相对应的仪器和用品:
玻璃棒、漏斗、漏斗架、滤纸、蒸发皿、石棉网、半透膜、接受器、冷凝管溶解过滤 蒸发浓缩 结晶(重结晶)法
蒸馏法 萃取分液法 升华法 渗析法在日常生活和工业生产分离提纯许多物质时,还要用到化学反应,在选择化学试剂时应遵守哪些原则?1.不增加新杂质,后续试剂应除去过量的前一试剂。
2.不减少欲被提纯的物质。
3.杂质与试剂生成的物质易与被提纯的物质易分离(状态类型不同)。 不增 易分不减溶解过滤:铁架台(带铁圈)、烧杯、漏斗、滤纸、 玻璃棒。蒸发浓缩:铁架台(带铁圈)、酒精灯、(泥三角)、 蒸发皿、玻璃棒。结晶(重结晶)法:烧杯、玻璃棒、蒸发皿、酒精灯、 漏斗、药匙、铁架台(带铁圈)蒸馏法:铁架台(带铁圈、铁夹)、酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器。萃取分液法:烧杯、漏斗架、分液漏斗。升华法:铁架台(带铁圈)、酒精灯、石棉网、 烧杯、圆底烧瓶。渗析法:半透膜、烧杯、玻璃棒。 [练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是
A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水???[练习3] 下列实验操作中错误的是 ( )
A、萃取时,萃取剂要求密度比水大
B、蒸馏时,应使温度计水银球应与蒸烧瓶支管口相平
C、过滤时,可直接将待过滤的悬浊液倒入漏斗中
D、蒸发时,待蒸发皿内出现大量晶体时,即应停止加热[练习4] 1,5-二硝基萘 和1,8-二硝基萘
中,后者可溶于质量分数大于98%的浓硫酸,而前者不能。简述如何将这两种异构体的混合物分离? AC萃取、分液[练习5]下列各组混合物的分离或提纯方法不正确的是 ( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用重结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和甲醇的混合物
D.用萃取和分液的方法可以分离碘和水的混合物A
