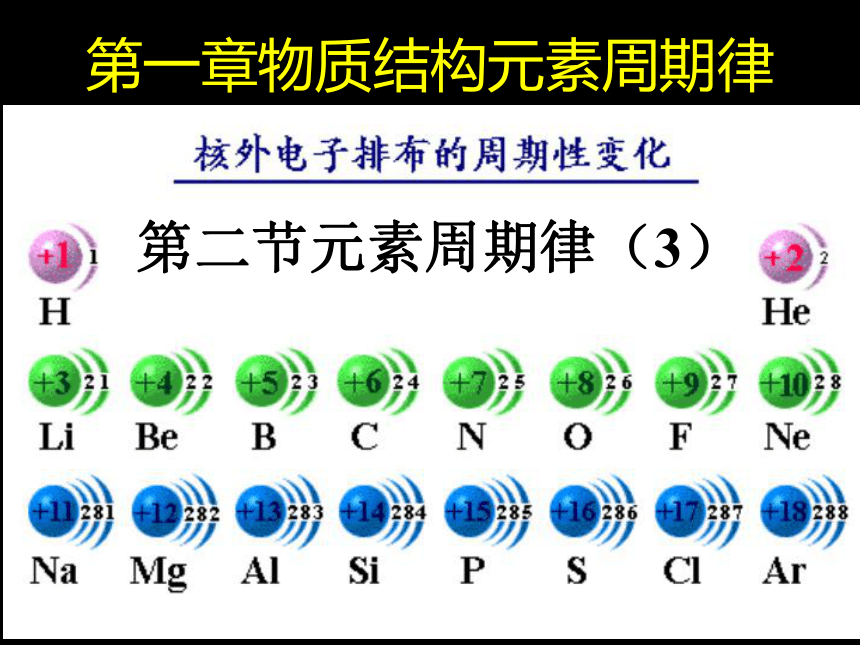
元素周期律(3)
图片预览


文档简介
课件10张PPT。第二节元素周期律(3)第一章物质结构元素周期律学习目标:
1、了解元素的位、构、性的关系,并能灵活运用。
2、了解元素周期表和元素周期律应用的广泛性和重要性。
3、了解元素的化合价与元素在周期表中的位置之间的关系和应用。
重点和难点:
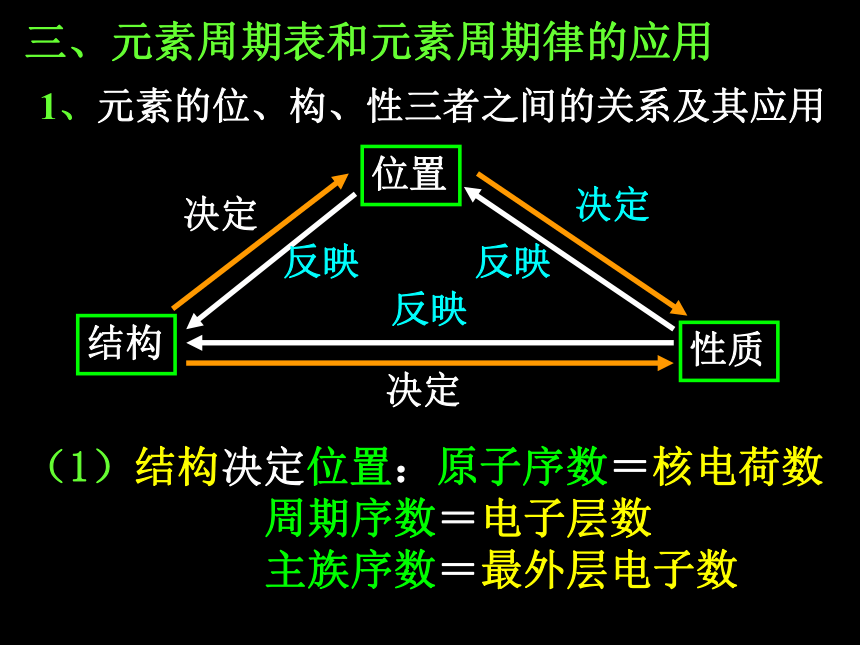
元素的位、构、性的关系和应用。三、元素周期表和元素周期律的应用 1、元素的位、构、性三者之间的关系及其应用结构位置性质(1)结构决定位置:原子序数=核电荷数
周期序数=电子层数
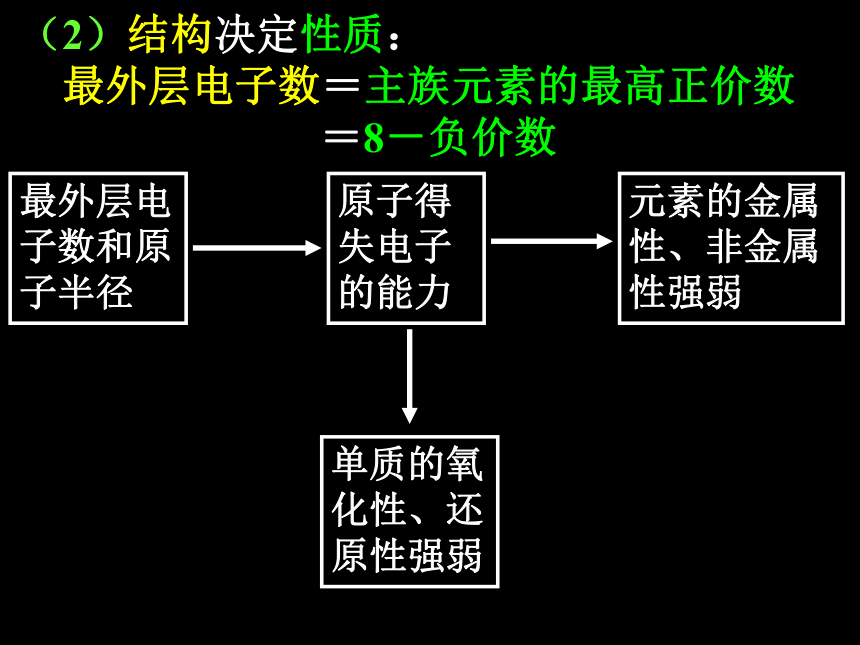
主族序数=最外层电子数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱(2)结构决定性质:
最外层电子数=主族元素的最高正价数
=8-负价数(3)位置反映性质:
同周期:从左到右,递变性 (4)同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图: 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强 ①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第6周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第2周期第ⅦA族(右上角)。 ②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。 2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数 (2)最低负价数=主族序数 - 8
=最外层电子数 - 8元素周期律小结: (1)元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。 (2)可预测或推测元素的原子结构和性质 (3)在科学研究和生产上也有广泛的应用
见课本P.18 (4)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,有力地论证了事物变化的量变引起质变的规律性。 3、元素周期律的应用和意义
1、了解元素的位、构、性的关系,并能灵活运用。
2、了解元素周期表和元素周期律应用的广泛性和重要性。
3、了解元素的化合价与元素在周期表中的位置之间的关系和应用。
重点和难点:
元素的位、构、性的关系和应用。三、元素周期表和元素周期律的应用 1、元素的位、构、性三者之间的关系及其应用结构位置性质(1)结构决定位置:原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱(2)结构决定性质:
最外层电子数=主族元素的最高正价数
=8-负价数(3)位置反映性质:
同周期:从左到右,递变性 (4)同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:
分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图: 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强 ①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第6周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第2周期第ⅦA族(右上角)。 ②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。 2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数 (2)最低负价数=主族序数 - 8
=最外层电子数 - 8元素周期律小结: (1)元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。 (2)可预测或推测元素的原子结构和性质 (3)在科学研究和生产上也有广泛的应用
见课本P.18 (4)在哲学方面,元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,有力地论证了事物变化的量变引起质变的规律性。 3、元素周期律的应用和意义
