浙江省求知中学2008-2009学年下学期高二第一次月考--化学(请选择....)
文档属性
| 名称 | 浙江省求知中学2008-2009学年下学期高二第一次月考--化学(请选择....) |

|
|
| 格式 | rar | ||
| 文件大小 | 151.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-04-04 00:00:00 | ||
图片预览



文档简介
浙江省求知中学2008-2009学年下学期高二第一次月考
化学
(试卷满分:100分;考试时间:90分钟)
相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 Al:27 S:32 Cu:64
第一卷 选择题
一、选择题(本题共有27小题,每小题2分,共54分,每小题只有一个选项符合题意)
1.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
2. 燃烧2 g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则乙醇燃烧的热化学方程式书写正确的是
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -23Q KJ/mol
B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q /23 KJ / mol
C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -QKJ /mol
D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = +23Q KJ/mol
3.下列说法正确的是:
A. 食物在常温下腐败是自发进行 B. 凡是放热反应都是自发的
C. 自发反应都是熵增大的反应. D. 电解池的反应是属于自发反应
4.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
5.用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是 A.NaCl溶液??????? ? B.HCl溶液 C.稀NaOH溶液???? D.AgNO3溶液
6.把足量铝条放入盛有一定体积的稀盐酸的试管中,使反应速率降低且不影响氢气产生量的做
法可以是
A.加入少量的CuCl2溶液 B.加入少量KNO3溶液
C.加入少量的K2CO3溶液 D.加少量Na2SO4溶液
7.下列说法不正确的是
A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4 OH- B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C.铸铁输油管道应埋在干燥致密不透气的土壤中 D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化,不容易生锈
8.某同学按右图所示的装置进行电解实验。下列说法正确的是 A.电解过程中,铜电极上有H2产生 B.电解过程中,铜电极不断溶解 C.电解过程中,石墨电极上始终有铜析出 D.整个电解过程中,H+的浓度不断增大 9.根据热化学方程式(在101kPa时)∶
S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中不正确的是
A.S的燃烧热为297.23kJ/mol
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(g) + O2(g) = SO2(g) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的总能量大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的总能量
10.在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.3.6mol B.3.2mol C.2.8mol D.1.6mol
11.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H+ +2e- = H2↑ B.Fe2+ + 2e- = Fe
C.2H2O + O2 + 4e- = 4OH- D.Fe3+ + e- = Fe2+
12.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:
Zn + 2MnO2 + 2 H2O = Zn(OH)2 + 2MnOOH
在此电池放电时,正极(碳棒)上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
13.加入正催化剂使反应速率加快,下列叙述不正确的是
A. 使反应体系的活化能降低。 B. 使反应体系的活化分子总数增多。
C. 使反应体系的活化分子百分数降低。 D. 使反应体系的活化分子百分数增大。
14.用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24 L气体(标准状况)。
下列有关说法正确的是
A.阴极生成的铜为5.6g B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液呈碱性
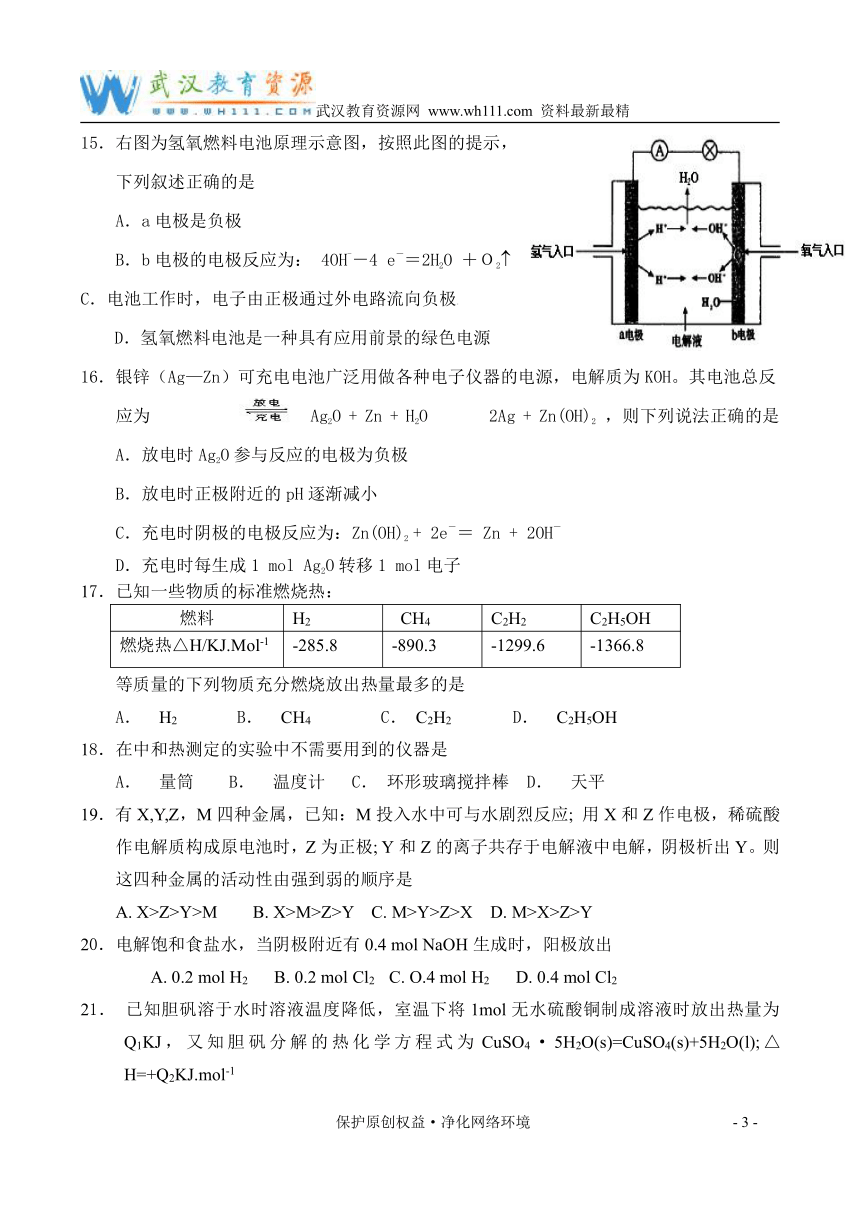
15.右图为氢氧燃料电池原理示意图,按照此图的提示,
下列叙述正确的是
A.a电极是负极
B.b电极的电极反应为: 4OH--4 e-=2H2O +O2( C.电池工作时,电子由正极通过外电路流向负极学
D.氢氧燃料电池是一种具有应用前景的绿色电源
16.银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为 Ag2O + Zn + H2O 2Ag + Zn(OH)2 ,则下列说法正确的是
A.放电时Ag2O参与反应的电极为负极
B.放电时正极附近的pH逐渐减小
C.充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH-
D.充电时每生成1 mol Ag2O转移1 mol电子
17.已知一些物质的标准燃烧热:
燃料
H2
CH4
C2H2
C2H5OH
燃烧热△H/KJ.Mol-1
-285.8
-890.3
-1299.6
-1366.8
等质量的下列物质充分燃烧放出热量最多的是
A. H2 B. CH4 C. C2H2 D. C2H5OH
18.在中和热测定的实验中不需要用到的仪器是
A. 量筒 B. 温度计 C. 环形玻璃搅拌棒 D. 天平
19.有X,Y,Z,M四种金属,已知:M投入水中可与水剧烈反应; 用X和Z作电极,稀硫酸作电解质构成原电池时,Z为正极; Y和Z的离子共存于电解液中电解,阴极析出Y。则这四种金属的活动性由强到弱的顺序是
A. X>Z>Y>M B. X>M>Z>Y C. M>Y>Z>X D. M>X>Z>Y
20.电解饱和食盐水,当阴极附近有0.4 mol NaOH生成时,阳极放出
A. 0.2 mol H2 B. 0.2 mol Cl2 C. O.4 mol H2 D. 0.4 mol Cl2
21. 已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1KJ,又知胆矾分解的热化学方程式为CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2KJ.mol-1
则Q1,Q2的关系为
A. Q1 < Q2 B.Q1 > Q2 C.Q1 = Q2 D. 无法确定
22.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是:
Cd+2OH-→Cd(OH)2+2e-, 2NiO(OH)+2H2O+2e-→2Ni(OH)2+2OH-
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断减小
D.电池充电时,电池的负极和电源的正极连接
23.在2L的密闭容器内充入2molN2和3molH2,在一定的条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用N2表示的反应速率是[单位:mol/(L?min)]
A.0.05 B.0.1 C.0.125 D.0.25
24.下列反应中,熵显著增加的是
A. 2H2(g) + O2(g)= 2H2O(g) B. CaCO3 + 2HCl= CaCl2 + CO2↑+ H2O
C. C(s) + O2(g) = CO2(g) D.H2(g) + I2(g)= 2HI(g)
25. 某反应:A==B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程
△H、△S的判断正确的是
A.△H<0、△S<0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H>0、△S>0
26.某一学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示装置,则电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和 NaCl
B. a为负极,b为正极;NaClO和 NaCl
C. a为阳极,b为阴极;HClO和 NaCl
D. a为阴极,b为阳极;HClO和 NaCl
27.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为:
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
第二卷 非选择题
二、填空题(本题有6小题,每空2分,共46分)
28.(10分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
⑴图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH是_______________(用E1、E2表示)。
⑵已知热化学方程式:H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为_________________。
⑶对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子数百分数增多,反应速率加快,你认为最可能的原因是________________________。
29.(4分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
实验
序号
A
B
烧杯中的液体
灵敏电流计指
针是否偏转
1
Zn
Cu
稀硫酸
有
2
Zn
Zn
稀硫酸
无
3
Zn
Cu
苯
无
4
Cu
C
氯化钠溶液
有
5
Mg
Al
氢氧化钠溶液
有
分析上述数据,回答下列问题:
(1)实验5中电子由B极?流向A极?,表明负极是? 电极(填“镁”或“铝”)
(2)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极 B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
30.(10分)右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。电极f的名称是 。
(2)滤纸B上发生的总反应方程式为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、 d两点短路,则电极e上的电极反应式为:
电解槽中盛放的电镀液可以是 (只要求电解质溶液)。
31.(6分)科学家P.Tatapudi等人首先使用在酸性条件下电解纯水的方法制得臭氧。臭氧在_____极周围的水中产生,其电极反应式为_________________:在另一极附近的氧气则生成过氧化氢,其电极反应式为________________.
32.(8分)如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铜两个电极,已知原电池停止工作时,Fe没有都有剩余.试写出可能的电极反应式,并指出正、负电极.
(1)Fe片:____________????????????????????????????????? _、
______________?????????????????????????? _(可不填满,也可补充,下同);
(2)Cu片:____________________????????????????????????? _、____________________??????????????????????????? _.
33.(8分)已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
⑴甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
序号
A溶液
B溶液
①
2 mL 0.1 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
②
2 mL 0.2 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
③
2 mL 0.2 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
少量MnSO4(催化剂)
该实验探究的是________________ 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是__________(用实验序号填空)。
⑵乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________________。
求知中学08学年下学期第一次月考试题
高二化学答题卷
二、填空题(共6 题,每空2分,共计46 分)
28. (1) ; ; ;
(2) (3)
29.(1)___________ (2)__________
30.(1)
(2)
(3)
31. _______________
32.(1)Fe片:____________????????????????????????????????? _、
______________?????????????????????????? _ (可不填满,也可补充,下同);
(2)Cu片:____________________????????????????????????? _、
____________________??????????????????????????? _.
33. (1)
(2) ______________ _.
求知中学08学年下学期第一次月考试题
高二化学参考答案
一、选择题(本题共有27小题,每小题2分,共54分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项
A
A
A
B
C
D
A
B
C
B
C
D
C
B
题号
15
16
17
18
19
20
21
22
23
24
25
26
27
选项
A
C
A
D
D
B
A
D
A
B
D
B
D
二、填空题(本题有6小题,每空2分,共46分)
28.⑴放热 需要 E2-E1
⑵409.0 kJ/mol
⑶ 虚线(Ⅱ)表示反应中使用了催化剂
化学
(试卷满分:100分;考试时间:90分钟)
相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 Al:27 S:32 Cu:64
第一卷 选择题
一、选择题(本题共有27小题,每小题2分,共54分,每小题只有一个选项符合题意)
1.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
2. 燃烧2 g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则乙醇燃烧的热化学方程式书写正确的是
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -23Q KJ/mol
B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q /23 KJ / mol
C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -QKJ /mol
D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = +23Q KJ/mol
3.下列说法正确的是:
A. 食物在常温下腐败是自发进行 B. 凡是放热反应都是自发的
C. 自发反应都是熵增大的反应. D. 电解池的反应是属于自发反应
4.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
5.用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是 A.NaCl溶液??????? ? B.HCl溶液 C.稀NaOH溶液???? D.AgNO3溶液
6.把足量铝条放入盛有一定体积的稀盐酸的试管中,使反应速率降低且不影响氢气产生量的做
法可以是
A.加入少量的CuCl2溶液 B.加入少量KNO3溶液
C.加入少量的K2CO3溶液 D.加少量Na2SO4溶液
7.下列说法不正确的是
A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4 OH- B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C.铸铁输油管道应埋在干燥致密不透气的土壤中 D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化,不容易生锈
8.某同学按右图所示的装置进行电解实验。下列说法正确的是 A.电解过程中,铜电极上有H2产生 B.电解过程中,铜电极不断溶解 C.电解过程中,石墨电极上始终有铜析出 D.整个电解过程中,H+的浓度不断增大 9.根据热化学方程式(在101kPa时)∶
S(s) + O2(g) = SO2(g) ΔH = -297.23kJ/mol
分析下列说法中不正确的是
A.S的燃烧热为297.23kJ/mol
B.S(g) + O2(g) = SO2(g) 放出的热量大于297.23kJ
C.S(g) + O2(g) = SO2(g) 放出的热量小于297.23kJ
D.形成1mol SO2的化学键释放的总能量大于断裂1mol S(s) 和1mol O2(g) 的化学键所吸收的总能量
10.在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.3.6mol B.3.2mol C.2.8mol D.1.6mol
11.钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H+ +2e- = H2↑ B.Fe2+ + 2e- = Fe
C.2H2O + O2 + 4e- = 4OH- D.Fe3+ + e- = Fe2+
12.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:
Zn + 2MnO2 + 2 H2O = Zn(OH)2 + 2MnOOH
在此电池放电时,正极(碳棒)上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
13.加入正催化剂使反应速率加快,下列叙述不正确的是
A. 使反应体系的活化能降低。 B. 使反应体系的活化分子总数增多。
C. 使反应体系的活化分子百分数降低。 D. 使反应体系的活化分子百分数增大。
14.用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24 L气体(标准状况)。
下列有关说法正确的是
A.阴极生成的铜为5.6g B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液呈碱性
15.右图为氢氧燃料电池原理示意图,按照此图的提示,
下列叙述正确的是
A.a电极是负极
B.b电极的电极反应为: 4OH--4 e-=2H2O +O2( C.电池工作时,电子由正极通过外电路流向负极学
D.氢氧燃料电池是一种具有应用前景的绿色电源
16.银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为 Ag2O + Zn + H2O 2Ag + Zn(OH)2 ,则下列说法正确的是
A.放电时Ag2O参与反应的电极为负极
B.放电时正极附近的pH逐渐减小
C.充电时阴极的电极反应为:Zn(OH)2 + 2e-= Zn + 2OH-
D.充电时每生成1 mol Ag2O转移1 mol电子
17.已知一些物质的标准燃烧热:
燃料
H2
CH4
C2H2
C2H5OH
燃烧热△H/KJ.Mol-1
-285.8
-890.3
-1299.6
-1366.8
等质量的下列物质充分燃烧放出热量最多的是
A. H2 B. CH4 C. C2H2 D. C2H5OH
18.在中和热测定的实验中不需要用到的仪器是
A. 量筒 B. 温度计 C. 环形玻璃搅拌棒 D. 天平
19.有X,Y,Z,M四种金属,已知:M投入水中可与水剧烈反应; 用X和Z作电极,稀硫酸作电解质构成原电池时,Z为正极; Y和Z的离子共存于电解液中电解,阴极析出Y。则这四种金属的活动性由强到弱的顺序是
A. X>Z>Y>M B. X>M>Z>Y C. M>Y>Z>X D. M>X>Z>Y
20.电解饱和食盐水,当阴极附近有0.4 mol NaOH生成时,阳极放出
A. 0.2 mol H2 B. 0.2 mol Cl2 C. O.4 mol H2 D. 0.4 mol Cl2
21. 已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1KJ,又知胆矾分解的热化学方程式为CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2KJ.mol-1
则Q1,Q2的关系为
A. Q1 < Q2 B.Q1 > Q2 C.Q1 = Q2 D. 无法确定
22.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是:
Cd+2OH-→Cd(OH)2+2e-, 2NiO(OH)+2H2O+2e-→2Ni(OH)2+2OH-
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断减小
D.电池充电时,电池的负极和电源的正极连接
23.在2L的密闭容器内充入2molN2和3molH2,在一定的条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用N2表示的反应速率是[单位:mol/(L?min)]
A.0.05 B.0.1 C.0.125 D.0.25
24.下列反应中,熵显著增加的是
A. 2H2(g) + O2(g)= 2H2O(g) B. CaCO3 + 2HCl= CaCl2 + CO2↑+ H2O
C. C(s) + O2(g) = CO2(g) D.H2(g) + I2(g)= 2HI(g)
25. 某反应:A==B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程
△H、△S的判断正确的是
A.△H<0、△S<0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H>0、△S>0
26.某一学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和NaCl溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示装置,则电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和 NaCl
B. a为负极,b为正极;NaClO和 NaCl
C. a为阳极,b为阴极;HClO和 NaCl
D. a为阴极,b为阳极;HClO和 NaCl
27.把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为:
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
第二卷 非选择题
二、填空题(本题有6小题,每空2分,共46分)
28.(10分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
⑴图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH是_______________(用E1、E2表示)。
⑵已知热化学方程式:H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为_________________。
⑶对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子数百分数增多,反应速率加快,你认为最可能的原因是________________________。
29.(4分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
实验
序号
A
B
烧杯中的液体
灵敏电流计指
针是否偏转
1
Zn
Cu
稀硫酸
有
2
Zn
Zn
稀硫酸
无
3
Zn
Cu
苯
无
4
Cu
C
氯化钠溶液
有
5
Mg
Al
氢氧化钠溶液
有
分析上述数据,回答下列问题:
(1)实验5中电子由B极?流向A极?,表明负极是? 电极(填“镁”或“铝”)
(2)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极 B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
30.(10分)右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。电极f的名称是 。
(2)滤纸B上发生的总反应方程式为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、 d两点短路,则电极e上的电极反应式为:
电解槽中盛放的电镀液可以是 (只要求电解质溶液)。
31.(6分)科学家P.Tatapudi等人首先使用在酸性条件下电解纯水的方法制得臭氧。臭氧在_____极周围的水中产生,其电极反应式为_________________:在另一极附近的氧气则生成过氧化氢,其电极反应式为________________.
32.(8分)如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铜两个电极,已知原电池停止工作时,Fe没有都有剩余.试写出可能的电极反应式,并指出正、负电极.
(1)Fe片:____________????????????????????????????????? _、
______________?????????????????????????? _(可不填满,也可补充,下同);
(2)Cu片:____________________????????????????????????? _、____________________??????????????????????????? _.
33.(8分)已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
⑴甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
序号
A溶液
B溶液
①
2 mL 0.1 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
②
2 mL 0.2 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
③
2 mL 0.2 mol/L
H2C2O4溶液
4 mL 0.01 mol/L
KMnO4溶液
少量MnSO4(催化剂)
该实验探究的是________________ 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是__________(用实验序号填空)。
⑵乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究__________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________________。
求知中学08学年下学期第一次月考试题
高二化学答题卷
二、填空题(共6 题,每空2分,共计46 分)
28. (1) ; ; ;
(2) (3)
29.(1)___________ (2)__________
30.(1)
(2)
(3)
31. _______________
32.(1)Fe片:____________????????????????????????????????? _、
______________?????????????????????????? _ (可不填满,也可补充,下同);
(2)Cu片:____________________????????????????????????? _、
____________________??????????????????????????? _.
33. (1)
(2) ______________ _.
求知中学08学年下学期第一次月考试题
高二化学参考答案
一、选择题(本题共有27小题,每小题2分,共54分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项
A
A
A
B
C
D
A
B
C
B
C
D
C
B
题号
15
16
17
18
19
20
21
22
23
24
25
26
27
选项
A
C
A
D
D
B
A
D
A
B
D
B
D
二、填空题(本题有6小题,每空2分,共46分)
28.⑴放热 需要 E2-E1
⑵409.0 kJ/mol
⑶ 虚线(Ⅱ)表示反应中使用了催化剂
同课章节目录
