沉淀溶解平衡(浙江省台州市)
图片预览








文档简介
课件21张PPT。吉林省吉林市官马溶洞 山东淄博博山溶洞 陕西商洛地区柞水县柞水溶洞 专题3 溶液中的离子反应第四单元
沉淀溶解平衡 思考: 在学习初中化学时,我们曾根据物质的溶解度将物质分为易溶、可溶、微溶、难溶等。如氯化银、硫酸钡就属于难溶物。那么,它们在水中是否完全不能溶解?请查阅有关资料加以说明。 (2)取上层清液2 mL,加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。 难溶≠不溶 1.请按如下步骤进行实验
(1)将少量PbI2(难溶于水)固体加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。饱和AgCl溶液思考:
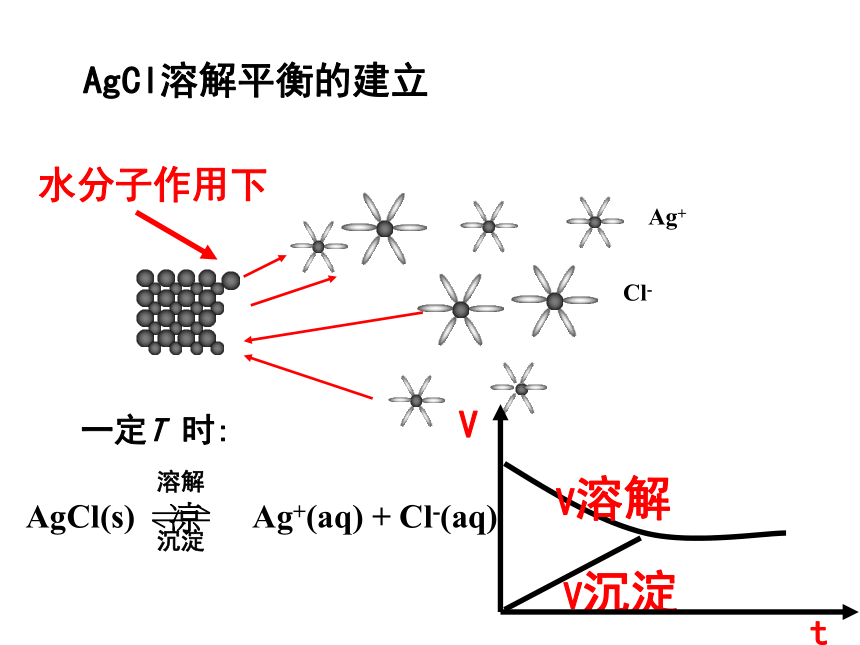
得到什么启示? 2 . 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变 溶解
AgCl(s) ? Ag+(aq) + Cl-(aq)
沉淀 AgCl溶解平衡的建立一定T 时:水分子作用下一、沉淀溶解平衡1、概念:在一定的温度下,当沉淀溶解的速率和沉淀生成速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。2、表示方法:AgCl(s)≒ Ag+ (aq) +Cl-(aq)3、意义:不表示 电离平衡,属于化学平衡。
4、特点:逆、等、动、定、变练习:分别书写下列物质的电离方程式和
沉淀溶解平衡方程式内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:(绝大多数难溶盐的溶解是吸热过程。)③同离子效应:二 影响沉淀溶解平衡的因素:讨论:对于平衡AgCl(S)≒ Ag+(aq) + Cl-(aq)
若改变条件,对其有何影响→ ↑ ↑→ 不变 不变不移动 不变 不变← ↓ ↑→ ↓ ↑← ↑ ↓ 三、溶度积常数(简称溶度积)3、意义: Ksp的大小反映了物质在水中的溶解
能力。一般来说,Ksp越大,其溶解能力越强。 在一定条件下,难溶性物质的饱和溶液中,存在溶解平衡,其平衡常数叫做溶度积常数或简称溶度积.1、定义Ksp= cm(An+) cn(Bm-) 写出难溶物BaCO3、Ag2CrO4、
Mg(OH)2在水中的沉淀溶解平衡
的方程式和溶度积的表达式。 练一练四、溶度积的应用: 例1:已知室温下PbI2的溶度积为7.1x10-9,求饱和溶液中Pb2+和I-的浓度;在c(I-)=0.1mol/l的溶液中, Pb2+的浓度最大可达到多少?Ksp =c (Pb2+)c2(I-)a.已知溶度积求离子浓度:例2:已知298K时AgCl在水中溶解了1.92×10-3g·L-1达饱和,计算其Ksp。解:AgCl的摩尔质量= 143.5 g · mol-1
c = 1.92×10-3g/l / 143.5 g · mol-1
= 1.34 ×10-5 mol·L-1
Ksp = c2 = 1.8×10-10b.已知离子浓度求溶度积:例3:已知298K时,MgCO3的Ksp=6.82x10-6,溶液中C(Mg2+)=0.0001mol/L,
C(CO32-)=0.0001mol/L,此时Mg2+和CO32-能否共存?c.利用溶度积判断离子共存:离子积Q c称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度,所以其数值不定。Qc= cm(An+) cn(Bm-) 溶度积规则①Qc > Ksp时,析出沉淀。②Qc= Ksp时,饱和溶液,沉淀溶解平衡状态。③Qc < Ksp时,溶液未饱和。 以上规则称为溶度积规则。控制离子浓度的大小,可以使沉淀的溶解平衡向所需要的方向移动。离子积Qc和溶度积Ksp的关系:小结一、沉淀溶解平衡概念及特点二、影响沉淀溶解平衡的因素 三、溶度积Ksp表达式及应用1.判断物质溶解能力2.求难溶物饱和溶液中离子的浓度或溶解度
(1)将少量PbI2(难溶于水)固体加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。饱和AgCl溶液思考:
得到什么启示? 2 . 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变 溶解
AgCl(s) ? Ag+(aq) + Cl-(aq)
沉淀 AgCl溶解平衡的建立一定T 时:水分子作用下一、沉淀溶解平衡1、概念:在一定的温度下,当沉淀溶解的速率和沉淀生成速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。2、表示方法:AgCl(s)≒ Ag+ (aq) +Cl-(aq)3、意义:不表示 电离平衡,属于化学平衡。
4、特点:逆、等、动、定、变练习:分别书写下列物质的电离方程式和
沉淀溶解平衡方程式内因:难溶物本身的性质外因:①浓度:加水稀释,平衡向溶解方向移动②温度:(绝大多数难溶盐的溶解是吸热过程。)③同离子效应:二 影响沉淀溶解平衡的因素:讨论:对于平衡AgCl(S)≒ Ag+(aq) + Cl-(aq)
若改变条件,对其有何影响→ ↑ ↑→ 不变 不变不移动 不变 不变← ↓ ↑→ ↓ ↑← ↑ ↓ 三、溶度积常数(简称溶度积)3、意义: Ksp的大小反映了物质在水中的溶解
能力。一般来说,Ksp越大,其溶解能力越强。 在一定条件下,难溶性物质的饱和溶液中,存在溶解平衡,其平衡常数叫做溶度积常数或简称溶度积.1、定义Ksp= cm(An+) cn(Bm-) 写出难溶物BaCO3、Ag2CrO4、
Mg(OH)2在水中的沉淀溶解平衡
的方程式和溶度积的表达式。 练一练四、溶度积的应用: 例1:已知室温下PbI2的溶度积为7.1x10-9,求饱和溶液中Pb2+和I-的浓度;在c(I-)=0.1mol/l的溶液中, Pb2+的浓度最大可达到多少?Ksp =c (Pb2+)c2(I-)a.已知溶度积求离子浓度:例2:已知298K时AgCl在水中溶解了1.92×10-3g·L-1达饱和,计算其Ksp。解:AgCl的摩尔质量= 143.5 g · mol-1
c = 1.92×10-3g/l / 143.5 g · mol-1
= 1.34 ×10-5 mol·L-1
Ksp = c2 = 1.8×10-10b.已知离子浓度求溶度积:例3:已知298K时,MgCO3的Ksp=6.82x10-6,溶液中C(Mg2+)=0.0001mol/L,
C(CO32-)=0.0001mol/L,此时Mg2+和CO32-能否共存?c.利用溶度积判断离子共存:离子积Q c称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度,所以其数值不定。Qc= cm(An+) cn(Bm-) 溶度积规则①Qc > Ksp时,析出沉淀。②Qc= Ksp时,饱和溶液,沉淀溶解平衡状态。③Qc < Ksp时,溶液未饱和。 以上规则称为溶度积规则。控制离子浓度的大小,可以使沉淀的溶解平衡向所需要的方向移动。离子积Qc和溶度积Ksp的关系:小结一、沉淀溶解平衡概念及特点二、影响沉淀溶解平衡的因素 三、溶度积Ksp表达式及应用1.判断物质溶解能力2.求难溶物饱和溶液中离子的浓度或溶解度
