化学平衡的移动
图片预览







文档简介
课件33张PPT。1.浓度:
增大反应物浓度,可以加快正反应速率
2.压强:(对于有气体参加的反应)
增大压强,可以加快反应速率
3. 温度:升高温度,可以加快正逆反应速率
4.催化剂:
使用正催化剂,可以同等程度的加快正逆反应速率知识回顾影响化学反应速率的因素(3)动:动态平衡(v正= v逆 ≠ 0)(1)等:v正= v逆 ≠0(2)定:反应混合物中各组分的含量保持
不变,各组分的浓度保持一定。(4)变:条件改变,原平衡可能被破坏,
在新的条件下建立新的平衡。化学平衡状态的特征知识回顾外界条件改变,使反应速率发生变化
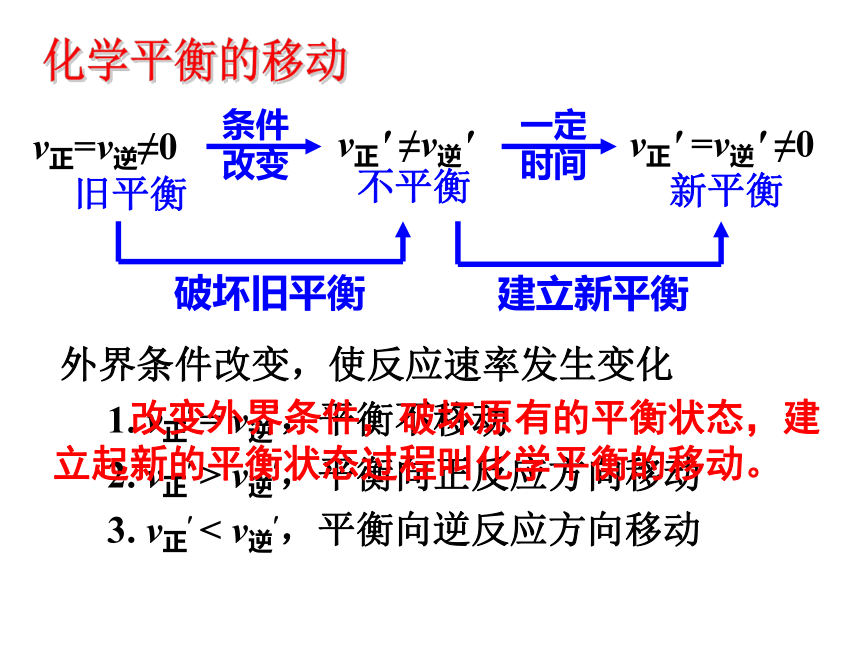
1. v正? = v逆?,平衡不移动
2. v正? > v逆?,平衡向正反应方向移动
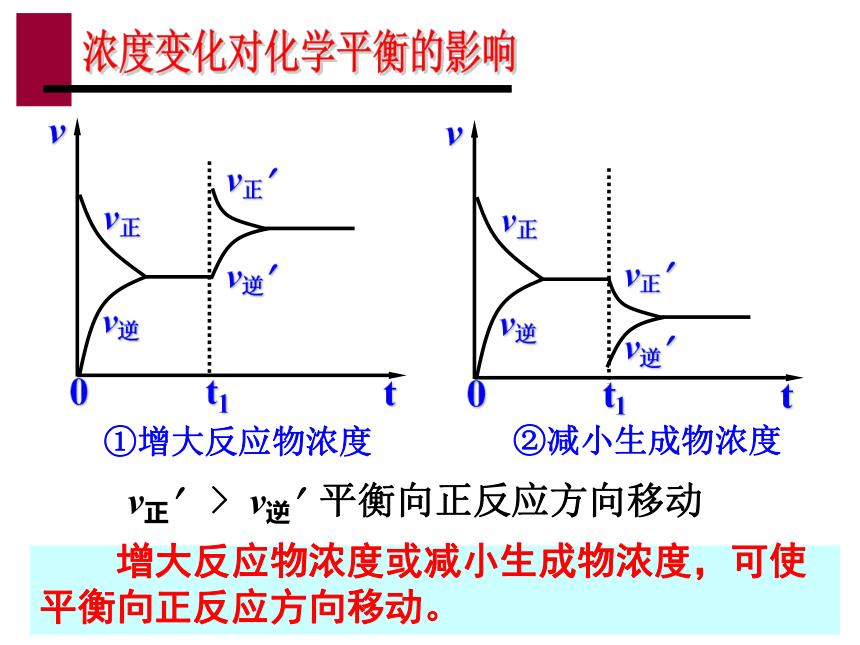
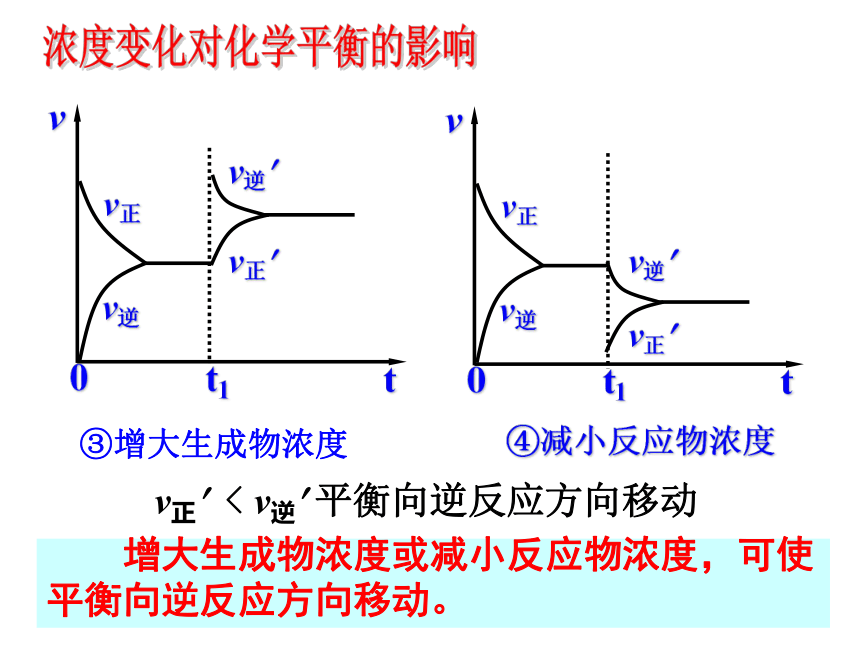
3. v正? < v逆?,平衡向逆反应方向移动 改变外界条件,破坏原有的平衡状态,建立起新的平衡状态过程叫化学平衡的移动。化学平衡的移动①增大反应物浓度②减小生成物浓度 增大反应物浓度或减小生成物浓度,可使平衡向正反应方向移动。v正? > v逆? 平衡向正反应方向移动③增大生成物浓度④减小反应物浓度 增大生成物浓度或减小反应物浓度,可使平衡向逆反应方向移动。v正? < v逆? 平衡向逆反应方向移动浓度变化对化学平衡的影响其它条件不变的情况下
①增大反应物浓度, v正>v逆
平衡向正方向移动
②减小生成物浓度, v正>v逆
平衡向正方向移动
③增大生成物浓度, v正<v逆
平衡向逆方向移动
④减小反应物浓度, v正<v逆
平衡向逆方向移动浓度变化对化学平衡的影响1.工业上制取硫酸的过程中,有一重要的反应:
在实际生产过程中,常用过量的空气与成本较高的SO2作用,为什么?动动脑动动手 增大成本较低的反应物的浓度,提高成本较高的原料的转化率。2.在定温定容的容器中发生 N2+3H2 2NH3当反应达到平衡后,下列措施将会对化学平衡产生什么影响?(填正向移动或逆向移动或不移动)
(1)向容器中充氮气
(2)向容器中充氢气
(3)向容器中充氨气
(4)向容器中充氦气
(5)向容器中充入氯化氢气体正向移动正向移动逆向移动不移动正向移动如某温度下,可逆反应
mA(g) + nB(g) pC(g) + qD(g)
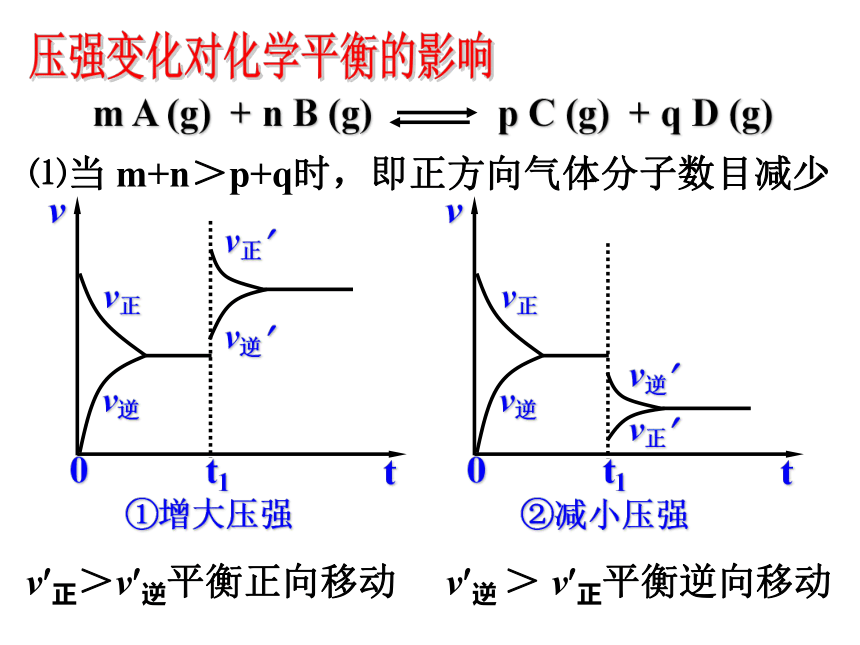
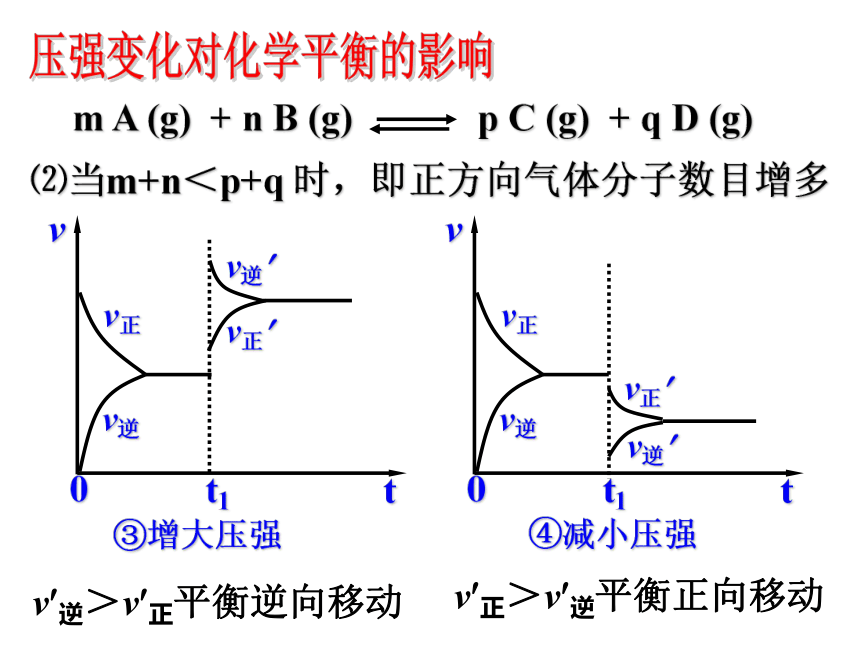
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下: K’<K ,V正>V逆,反应向正方向进行K’=K ,V正=V逆,反应处于平衡状态K’>K ,V正<V逆,反应向逆方向进行则:1.增大压强,对于有气体参加和气体生成的化学反应来讲,由于缩小了体积,气体的浓度增大,提高了反应速率。2.若两边都有气体,则改变压强同时改变正逆反应速率,当反应前后分子数目不同时,速率改变倍数不一样,分子数目多的一侧速率改变倍数大。 当反应前后分子数目相同时,改变的倍数相同。①增大压强②减小压强⑴当 m+n>p+q时,即正方向气体分子数目减少v?逆 > v?正平衡逆向移动v?正>v?逆平衡正向移动压强变化对化学平衡的影响⑵当m+n<p+q 时,即正方向气体分子数目增多③增大压强④减小压强v?逆>v?正平衡逆向移动v?正>v?逆平衡正向移动压强变化对化学平衡的影响(3) 当 m + n = p + q 时,即气体分子数目不变⑤增大压强⑥减小压强v?正=v?逆平衡不移动压强变化对化学平衡的影响1.增大压强,化学平衡向着气体分子数目减少的方向移动;
2.减小压强,化学平衡向着气体分子数目增多的方向移动。
3.对于反应前后气体分子数目不变的反应改变压强平衡不移动。压强变化时,必须引起混合气体的浓度发生改变,导致速率变化时,才可能使平衡移动。压强变化对化学平衡的影响友情提示 在定温、容积可变的容器中充入1molN2 和3molH2,发生反应N2+3H2 2NH3,当反应达到平衡后,下列措施将会对化学平衡产生什么影响?(填正向移动或逆向移动或不移动)
(1)压缩容器的容积
(2)定压向容器中充入氦气
(3)定容容器中充入氦气正向移动逆向移动不移动动动脑动动手 温度的改变对正逆反应速率都会产生影响,但影响的程度不同,吸热反应比放热反应影响的程度大。 升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。 降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。①升高温度v吸 > v放 平衡向吸热反应方向移动升高温度平衡向吸热反应方向移动温度变化对化学平衡的影响②降低温度v放>v吸 平衡向放热反应方向移动降低温度平衡向放热反应方向移动 在其他条件不变时,温度升高,化学平衡向吸热反应的方向移动,温度降低,化学平衡向放热的方向移动。温度变化对化学平衡的影响 催化剂同等程度的改变正、逆反应速率。
使用催化剂,对化学平衡无影响。
正催化剂能缩短平衡到达的时间。影响化学平衡的条件归纳小结化学平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。①“减弱”不是“消除”。
②适用单个条件的改变(多个条件改变要具体问题具体分析)。
③适用于任何动态平衡体系(如:溶解平衡、电离平衡等)。友情提示课本P52页合成氨条件的选择问题1:合成氨反应的特点?a.可逆反应
b.正反应放热
c.正反应是气体分子数目减小的反应想一想问题2:工业合成氨要考虑什么问题?主要:经济效益 (即单位时间内提高合成氨的产量)问题3:从化学反应速率和化学平衡的角度分析合成氨的合适条件。高 压
低 温
无 影 响高 压
高 温
使 用问题4:工业上如何选择合成氨的合适条件?使用催化剂:加快化学反应速率,提高生产效率,提高经济效益;
选择合适的温度:500℃左右,该温度是合成氨催化剂活性最大的温度;
选择合适的压强: 1.3×107~3×107Pa,该压强下进行生产,对动力、材料、设备等的要求较合适;
循环操作过程合成氨的适宜条件1. 判断下列现象能否用勒夏特列原理解释:
A.新制氯水时间长后,颜色变浅
B.用饱和食盐水除Cl2中的HCl比用水好
C.可用浓氨水和碱石灰快速制取NH3
D.打开啤酒瓶盖,有大量气泡产生
E.加催化剂,使N2和H2在一定条件下转化为NH3动动脑动动手2. 在一密闭容器中反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积扩大一倍,达到新平衡时,A物质的量浓度是原来的60%,则在达到平衡过程中( )
A.反应向逆反应方向移动
B.正反应速率大于逆反应速率
C.物质B的质量分数逐渐增大
D.物质A的转化率增大 3. 在高温下,反应2HBr(g) H2 (g) + Br2 (g) (正反应为吸热反应)达到平衡,要使混气颜色加深,可采取的方法是( )
A.减压
B.缩小体积
C.升温
D.增大H2浓度4. 在一定温度下将CO(g)和H2O(g)各1 mol放在密闭容器中反应CO+H2O CO 2+H2达平衡后测得CO2为0.6 mol,再通入0.4mol H2O(g),达到新平衡后CO2的物质的量是( )
A.0.6mol
B.1 mol
C.在0.6 ~ 1 mol之间
D.大于1 mol图像题解题方法:1. 看图:
一看面(纵坐标与横坐标)的含义
二看线(线的走向与变化趋势)
三看点(起点、拐点、终点)
四看辅助线(如等温线、等压线等)
五看量的变化(转化率、浓度、温度、压强等)2.技巧:
“先拐先平,数值大”:在含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
“定一议二”:在含量与温度、压强变化关系图像中,先确定一个量不变,再讨论另外两个量的关系。即定温看压强或定压看温度的变化,由曲线上交点的高低,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向、反应的热效应、反应两边气体体积的大小等。 7. 可逆反应aA(g)+ bB(g) cC(g)+dD(g);在一定条件下达平衡状态时,A的转化率与温度压强的关系如图所示。则在下列空格处填写“>”、“<”或“=”。
(1)a+b___c+d; (2) △H___0。 任看一条曲线,可知温度升高,A的转化率变大,说明升高温度使平衡正向移动,故正反应为吸热反应。
再垂直于横坐标画一直线,可知:温度相同时压强越大,A的转化率越小,说明增大压强使平衡逆向移动。<>
增大反应物浓度,可以加快正反应速率
2.压强:(对于有气体参加的反应)
增大压强,可以加快反应速率
3. 温度:升高温度,可以加快正逆反应速率
4.催化剂:
使用正催化剂,可以同等程度的加快正逆反应速率知识回顾影响化学反应速率的因素(3)动:动态平衡(v正= v逆 ≠ 0)(1)等:v正= v逆 ≠0(2)定:反应混合物中各组分的含量保持
不变,各组分的浓度保持一定。(4)变:条件改变,原平衡可能被破坏,
在新的条件下建立新的平衡。化学平衡状态的特征知识回顾外界条件改变,使反应速率发生变化
1. v正? = v逆?,平衡不移动
2. v正? > v逆?,平衡向正反应方向移动
3. v正? < v逆?,平衡向逆反应方向移动 改变外界条件,破坏原有的平衡状态,建立起新的平衡状态过程叫化学平衡的移动。化学平衡的移动①增大反应物浓度②减小生成物浓度 增大反应物浓度或减小生成物浓度,可使平衡向正反应方向移动。v正? > v逆? 平衡向正反应方向移动③增大生成物浓度④减小反应物浓度 增大生成物浓度或减小反应物浓度,可使平衡向逆反应方向移动。v正? < v逆? 平衡向逆反应方向移动浓度变化对化学平衡的影响其它条件不变的情况下
①增大反应物浓度, v正>v逆
平衡向正方向移动
②减小生成物浓度, v正>v逆
平衡向正方向移动
③增大生成物浓度, v正<v逆
平衡向逆方向移动
④减小反应物浓度, v正<v逆
平衡向逆方向移动浓度变化对化学平衡的影响1.工业上制取硫酸的过程中,有一重要的反应:
在实际生产过程中,常用过量的空气与成本较高的SO2作用,为什么?动动脑动动手 增大成本较低的反应物的浓度,提高成本较高的原料的转化率。2.在定温定容的容器中发生 N2+3H2 2NH3当反应达到平衡后,下列措施将会对化学平衡产生什么影响?(填正向移动或逆向移动或不移动)
(1)向容器中充氮气
(2)向容器中充氢气
(3)向容器中充氨气
(4)向容器中充氦气
(5)向容器中充入氯化氢气体正向移动正向移动逆向移动不移动正向移动如某温度下,可逆反应
mA(g) + nB(g) pC(g) + qD(g)
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下: K’<K ,V正>V逆,反应向正方向进行K’=K ,V正=V逆,反应处于平衡状态K’>K ,V正<V逆,反应向逆方向进行则:1.增大压强,对于有气体参加和气体生成的化学反应来讲,由于缩小了体积,气体的浓度增大,提高了反应速率。2.若两边都有气体,则改变压强同时改变正逆反应速率,当反应前后分子数目不同时,速率改变倍数不一样,分子数目多的一侧速率改变倍数大。 当反应前后分子数目相同时,改变的倍数相同。①增大压强②减小压强⑴当 m+n>p+q时,即正方向气体分子数目减少v?逆 > v?正平衡逆向移动v?正>v?逆平衡正向移动压强变化对化学平衡的影响⑵当m+n<p+q 时,即正方向气体分子数目增多③增大压强④减小压强v?逆>v?正平衡逆向移动v?正>v?逆平衡正向移动压强变化对化学平衡的影响(3) 当 m + n = p + q 时,即气体分子数目不变⑤增大压强⑥减小压强v?正=v?逆平衡不移动压强变化对化学平衡的影响1.增大压强,化学平衡向着气体分子数目减少的方向移动;
2.减小压强,化学平衡向着气体分子数目增多的方向移动。
3.对于反应前后气体分子数目不变的反应改变压强平衡不移动。压强变化时,必须引起混合气体的浓度发生改变,导致速率变化时,才可能使平衡移动。压强变化对化学平衡的影响友情提示 在定温、容积可变的容器中充入1molN2 和3molH2,发生反应N2+3H2 2NH3,当反应达到平衡后,下列措施将会对化学平衡产生什么影响?(填正向移动或逆向移动或不移动)
(1)压缩容器的容积
(2)定压向容器中充入氦气
(3)定容容器中充入氦气正向移动逆向移动不移动动动脑动动手 温度的改变对正逆反应速率都会产生影响,但影响的程度不同,吸热反应比放热反应影响的程度大。 升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。 降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。①升高温度v吸 > v放 平衡向吸热反应方向移动升高温度平衡向吸热反应方向移动温度变化对化学平衡的影响②降低温度v放>v吸 平衡向放热反应方向移动降低温度平衡向放热反应方向移动 在其他条件不变时,温度升高,化学平衡向吸热反应的方向移动,温度降低,化学平衡向放热的方向移动。温度变化对化学平衡的影响 催化剂同等程度的改变正、逆反应速率。
使用催化剂,对化学平衡无影响。
正催化剂能缩短平衡到达的时间。影响化学平衡的条件归纳小结化学平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。①“减弱”不是“消除”。
②适用单个条件的改变(多个条件改变要具体问题具体分析)。
③适用于任何动态平衡体系(如:溶解平衡、电离平衡等)。友情提示课本P52页合成氨条件的选择问题1:合成氨反应的特点?a.可逆反应
b.正反应放热
c.正反应是气体分子数目减小的反应想一想问题2:工业合成氨要考虑什么问题?主要:经济效益 (即单位时间内提高合成氨的产量)问题3:从化学反应速率和化学平衡的角度分析合成氨的合适条件。高 压
低 温
无 影 响高 压
高 温
使 用问题4:工业上如何选择合成氨的合适条件?使用催化剂:加快化学反应速率,提高生产效率,提高经济效益;
选择合适的温度:500℃左右,该温度是合成氨催化剂活性最大的温度;
选择合适的压强: 1.3×107~3×107Pa,该压强下进行生产,对动力、材料、设备等的要求较合适;
循环操作过程合成氨的适宜条件1. 判断下列现象能否用勒夏特列原理解释:
A.新制氯水时间长后,颜色变浅
B.用饱和食盐水除Cl2中的HCl比用水好
C.可用浓氨水和碱石灰快速制取NH3
D.打开啤酒瓶盖,有大量气泡产生
E.加催化剂,使N2和H2在一定条件下转化为NH3动动脑动动手2. 在一密闭容器中反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积扩大一倍,达到新平衡时,A物质的量浓度是原来的60%,则在达到平衡过程中( )
A.反应向逆反应方向移动
B.正反应速率大于逆反应速率
C.物质B的质量分数逐渐增大
D.物质A的转化率增大 3. 在高温下,反应2HBr(g) H2 (g) + Br2 (g) (正反应为吸热反应)达到平衡,要使混气颜色加深,可采取的方法是( )
A.减压
B.缩小体积
C.升温
D.增大H2浓度4. 在一定温度下将CO(g)和H2O(g)各1 mol放在密闭容器中反应CO+H2O CO 2+H2达平衡后测得CO2为0.6 mol,再通入0.4mol H2O(g),达到新平衡后CO2的物质的量是( )
A.0.6mol
B.1 mol
C.在0.6 ~ 1 mol之间
D.大于1 mol图像题解题方法:1. 看图:
一看面(纵坐标与横坐标)的含义
二看线(线的走向与变化趋势)
三看点(起点、拐点、终点)
四看辅助线(如等温线、等压线等)
五看量的变化(转化率、浓度、温度、压强等)2.技巧:
“先拐先平,数值大”:在含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。
“定一议二”:在含量与温度、压强变化关系图像中,先确定一个量不变,再讨论另外两个量的关系。即定温看压强或定压看温度的变化,由曲线上交点的高低,结合平衡移动原理和指定的可逆反应,确定平衡的移动方向、反应的热效应、反应两边气体体积的大小等。 7. 可逆反应aA(g)+ bB(g) cC(g)+dD(g);在一定条件下达平衡状态时,A的转化率与温度压强的关系如图所示。则在下列空格处填写“>”、“<”或“=”。
(1)a+b___c+d; (2) △H___0。 任看一条曲线,可知温度升高,A的转化率变大,说明升高温度使平衡正向移动,故正反应为吸热反应。
再垂直于横坐标画一直线,可知:温度相同时压强越大,A的转化率越小,说明增大压强使平衡逆向移动。<>
