化学平衡状态
图片预览











文档简介
课件37张PPT。思考:化学反应中,反应物能全部转
化为生成物吗?举例说明。
有些化学反应能进行完全,如镁的燃烧,钠与水的反应;有些化学反不能进行完全,如合成氨,二氧化硫的催化氧化等。化学平衡状态1、可逆反应定义:在相同条件下同时向正、反两个方向进行的反应称可逆反应。交流 · 研讨下列说法是否正确:
1、氢气在氧气中燃烧生成水,水在电解时生成氢气和氧气,H2+O2=H2O是可逆反应。
2、硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3、氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。1、可逆反应可逆反应的特点:
(1)不能进行到底,有一定限度
(2)正反两个方向的反应在同时进行
(3)一定条件下,正逆反应达平衡1、可逆反应人们利用可逆反应进行化工生产时要同时考虑两个因素:
反应进行的速和反应进行的限度。
化学反应限度决定原料利用率和产品的产率,因此,研究可逆反应,提高化学反应的限度具有重要意义。1、可逆反应2体积SO2
1体积O2
500℃, 101KPa,V2O5SO2—6%
O2—3%
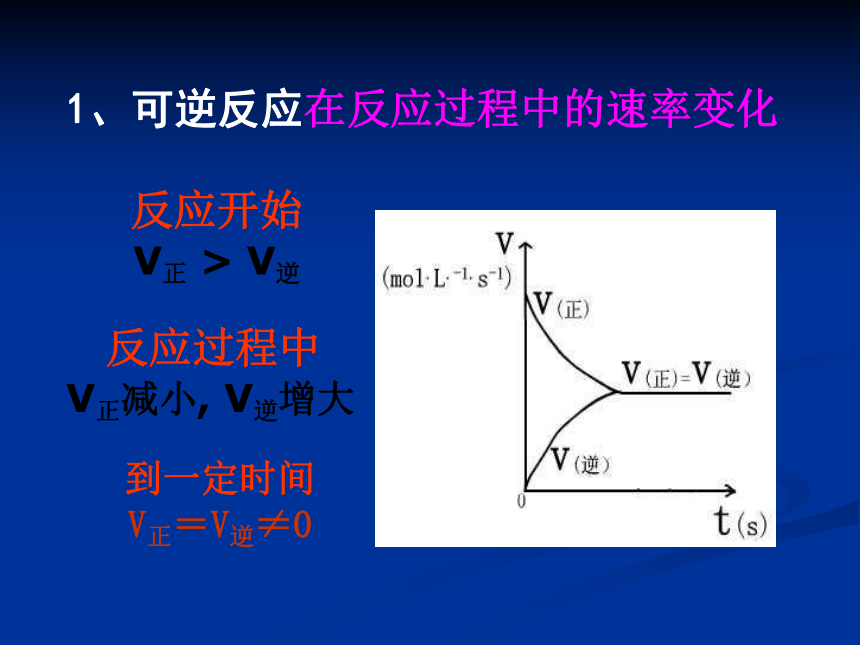
SO3—91%如前如前?反应停止了吗反应开始
V正 > V逆到一定时间
V正=V逆≠0反应过程中
V正减小, V逆增大1、可逆反应在反应过程中的速率变化2、化学平衡定义:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡。要点:对象——可逆反应
条件——一定条件下,V正=V逆
特征——各成份的浓度不再变化特点动—化学平衡是一种动态平衡
V正=V逆≠0; 定—反应混合物中各组成的浓度
保持不变; 变—当外界条件(C、P、T)改变
时,V正≠V逆 ,平衡发生改变 2、化学平衡① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。化学平衡状态的标志:(1)等速标志,υ正 = υ逆 (本质特征)(2)恒浓标志,反应混合物中各组成成分的浓度保持不变(外部表现):①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。 ③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。(2)恒浓标志,反应混合物中各组成成分的浓度保持不变(外部表现):重要题型判断可逆反应达到平衡状态?能够说明N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度
比恰为1:3:2⑥ 某时间内断裂3molH-H键的同时,断裂6molN-H键
⑦容器内质量不随时间的变化
而变化④t min内生成1molNH3同时消耗0.5molN2
⑤t min内,生成1molN2同时消耗3molH2
⑧容器内压强不随时间的变化
而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再
发生变化判断化学平衡状态的方法是指在一定条件下(恒温、恒容或恒温、恒压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的含量相同的平衡状态。等效平衡只改变起始时加入物质的物质的量,如果根据反应方程式中的计量数换算成等号同一边的物质的物质的量,只要对应物质的物质的量相等就可达到同一平衡状态。 [规律] 在恒温恒容(T,V)下,若反应前后气体物质的总体积不相等:此时,混合物中各物质的质量(物质的量)百分含量与已知的平衡状态相同,物质的量、浓度、甚至总压强、总物质的量也相同。 只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的百分含量与已知的平衡状态相同。但各组分的物质的量及浓度不一定相同。 在恒温恒容(T,V)下,若反应前后气体物质的总体积相等:只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的百分含量与已知的平衡状态相同。但各组分的物质的量不一定相同。 在恒温恒压(T,P)下:1、当可逆反应2SO2+O2 2SO3达平衡时, 通入18O2, 再次平衡时, 18O存在于( )
A.SO3 O2 B.SO2 SO3
C. SO2 O2 D.SO2 O2 SO3D练习2、在密闭容器中进行如下反应X2(g)+Y2 (g)?2Z(g) 已知X2﹑Y2﹑Z的起始浓度分别为0.1mol/L﹑0.3mol/L﹑0.2mol/L。 在一定的条件下,当达到平衡时,各物质的浓度有可能是A.Z为0.3mol/L B.Y2为0.35mol/L C.X2为0.2mol/L D.Z为0.4mol/L答:AB3、N2+3H2 2NH3反应达到平衡时,下列说法正确的是( )
A、N2和H2不再化合了
B、N2、H2、NH3的浓度相等
C、平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了
D、N2、H2、NH3的浓度保持不变D4、在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志是( )
A.A生成的速率与C分解的速率相等
B.A、B、C的浓度不再变化
C.单位时间生成n molA同时消耗3n molB
D.A、B、C的分子数之比为1:3:2BC5、 可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正 (N2)= v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)C6、 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 (g) + O2 (g) 2SO3 (g) 并达到平衡,反应过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )。
A.等于p% B.大于p%
C.小于p% D.无法判断B
V L P%
V L>P%
压甲乙起始状态 平衡状态 反应过程分析:7、在一个固定体积的密闭容器中,加入2molA和1molB,发生反:2A(g)+B(g) 3C(g) + D(g) 达到平衡时,C的浓度为Wmol/L 。若维持容器体积和温度不变,按下列几种配比 作为起始物质,达到平衡后,C的物质的量浓 度:_______________大于 Wmol/L、_________等于Wmol/L、_______小于Wmol/L。 A、B、C、F、ID、GE、HA.4molA+1molB B.2molA+2molB
C.4molA+2molB D.3molC+1molD
E.2molA+1molB+3molC+1molD F.3molC+1molD+1molB G.1molA+0.5molB+1.5molC+0.5molD H. 3molC+2molD
I.4molC+1molD 2 L2 L1 L 4molA+2molB 平衡状态1 平衡状态2加压8、在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2 (g) +Br2 (g) 2HBr (g),已知加入1mol H2和2mol Br2时,达到平衡后生成a mol HBr(见下表“已知”项)。在同温同压下,且保持平衡时各组成成分的百分含量不变,对下列编号⑴和⑵的状态,填写表中的空白:00.52a2 L 2 L1 L 1 L1 L已知甲乙丙(1)起始状态 平衡状态 加
压
化为生成物吗?举例说明。
有些化学反应能进行完全,如镁的燃烧,钠与水的反应;有些化学反不能进行完全,如合成氨,二氧化硫的催化氧化等。化学平衡状态1、可逆反应定义:在相同条件下同时向正、反两个方向进行的反应称可逆反应。交流 · 研讨下列说法是否正确:
1、氢气在氧气中燃烧生成水,水在电解时生成氢气和氧气,H2+O2=H2O是可逆反应。
2、硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3、氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。1、可逆反应可逆反应的特点:
(1)不能进行到底,有一定限度
(2)正反两个方向的反应在同时进行
(3)一定条件下,正逆反应达平衡1、可逆反应人们利用可逆反应进行化工生产时要同时考虑两个因素:
反应进行的速和反应进行的限度。
化学反应限度决定原料利用率和产品的产率,因此,研究可逆反应,提高化学反应的限度具有重要意义。1、可逆反应2体积SO2
1体积O2
500℃, 101KPa,V2O5SO2—6%
O2—3%
SO3—91%如前如前?反应停止了吗反应开始
V正 > V逆到一定时间
V正=V逆≠0反应过程中
V正减小, V逆增大1、可逆反应在反应过程中的速率变化2、化学平衡定义:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡。要点:对象——可逆反应
条件——一定条件下,V正=V逆
特征——各成份的浓度不再变化特点动—化学平衡是一种动态平衡
V正=V逆≠0; 定—反应混合物中各组成的浓度
保持不变; 变—当外界条件(C、P、T)改变
时,V正≠V逆 ,平衡发生改变 2、化学平衡① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。化学平衡状态的标志:(1)等速标志,υ正 = υ逆 (本质特征)(2)恒浓标志,反应混合物中各组成成分的浓度保持不变(外部表现):①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。 ③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。(2)恒浓标志,反应混合物中各组成成分的浓度保持不变(外部表现):重要题型判断可逆反应达到平衡状态?能够说明N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度
比恰为1:3:2⑥ 某时间内断裂3molH-H键的同时,断裂6molN-H键
⑦容器内质量不随时间的变化
而变化④t min内生成1molNH3同时消耗0.5molN2
⑤t min内,生成1molN2同时消耗3molH2
⑧容器内压强不随时间的变化
而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再
发生变化判断化学平衡状态的方法是指在一定条件下(恒温、恒容或恒温、恒压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的含量相同的平衡状态。等效平衡只改变起始时加入物质的物质的量,如果根据反应方程式中的计量数换算成等号同一边的物质的物质的量,只要对应物质的物质的量相等就可达到同一平衡状态。 [规律] 在恒温恒容(T,V)下,若反应前后气体物质的总体积不相等:此时,混合物中各物质的质量(物质的量)百分含量与已知的平衡状态相同,物质的量、浓度、甚至总压强、总物质的量也相同。 只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的百分含量与已知的平衡状态相同。但各组分的物质的量及浓度不一定相同。 在恒温恒容(T,V)下,若反应前后气体物质的总体积相等:只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的百分含量与已知的平衡状态相同。但各组分的物质的量不一定相同。 在恒温恒压(T,P)下:1、当可逆反应2SO2+O2 2SO3达平衡时, 通入18O2, 再次平衡时, 18O存在于( )
A.SO3 O2 B.SO2 SO3
C. SO2 O2 D.SO2 O2 SO3D练习2、在密闭容器中进行如下反应X2(g)+Y2 (g)?2Z(g) 已知X2﹑Y2﹑Z的起始浓度分别为0.1mol/L﹑0.3mol/L﹑0.2mol/L。 在一定的条件下,当达到平衡时,各物质的浓度有可能是A.Z为0.3mol/L B.Y2为0.35mol/L C.X2为0.2mol/L D.Z为0.4mol/L答:AB3、N2+3H2 2NH3反应达到平衡时,下列说法正确的是( )
A、N2和H2不再化合了
B、N2、H2、NH3的浓度相等
C、平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了
D、N2、H2、NH3的浓度保持不变D4、在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志是( )
A.A生成的速率与C分解的速率相等
B.A、B、C的浓度不再变化
C.单位时间生成n molA同时消耗3n molB
D.A、B、C的分子数之比为1:3:2BC5、 可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正 (N2)= v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)C6、 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 (g) + O2 (g) 2SO3 (g) 并达到平衡,反应过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )。
A.等于p% B.大于p%
C.小于p% D.无法判断B
V L P%
V L>P%
C.4molA+2molB D.3molC+1molD
E.2molA+1molB+3molC+1molD F.3molC+1molD+1molB G.1molA+0.5molB+1.5molC+0.5molD H. 3molC+2molD
I.4molC+1molD 2 L2 L1 L 4molA+2molB 平衡状态1 平衡状态2加压8、在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2 (g) +Br2 (g) 2HBr (g),已知加入1mol H2和2mol Br2时,达到平衡后生成a mol HBr(见下表“已知”项)。在同温同压下,且保持平衡时各组成成分的百分含量不变,对下列编号⑴和⑵的状态,填写表中的空白:00.52a2 L 2 L1 L 1 L1 L已知甲乙丙(1)起始状态 平衡状态 加
压
