弱电解质的电离平衡
图片预览






文档简介
课件24张PPT。化
合
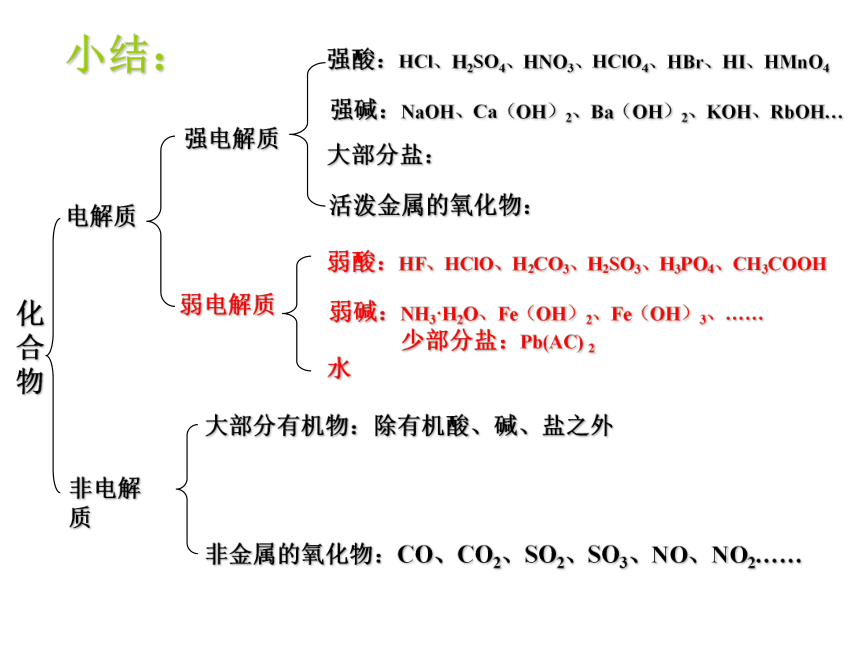
物电解质非电解质强电解质弱电解质强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI、HMnO4强碱:NaOH、Ca(OH)2、Ba(OH)2、KOH、RbOH…大部分盐:活泼金属的氧化物:弱酸:HF、HClO、H2CO3、H2SO3、H3PO4、CH3COOH弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
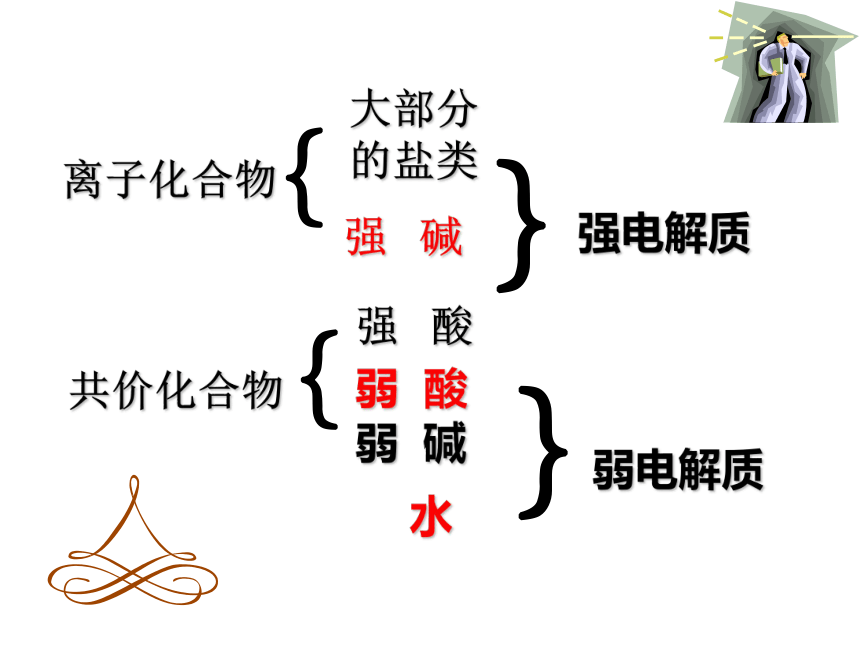
少部分盐:Pb(AC) 2水大部分有机物:除有机酸、碱、盐之外非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……小结:强、弱电解质的比较:离子化合物大部分
的盐类强 碱{共价化合物{强 酸弱 酸弱 碱 水}}弱电解质强电解质下列物质属于强电解质的是 (? )
A.H2CO3??? B.CH4
C.NaHCO3? D.NaHSO4下列说法正确的是 (? )
A.强电解质一定是离子化合物,弱电解质一定是共价化合物
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.CO2的水溶液导电能力很弱,所以CO2是弱电解质
D.属于共价化合物的电解质在熔化状态下一般不导电开动脑筋哦!CDD下列关于强、弱电解质的叙述正确的是( )
A、强电解质都是离子化合物,弱电解质都是共价化合物
B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C、强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
D、强电解质溶液中无溶质分子,弱电解质溶液中分子和其电离产生的离子同时存在D把0.05molNaOH固体分别加入100mL下列液体中,溶液的导电性变化不大的是( ) A.自来水
B.0.5mol/LNH4Cl溶液
C.0.5mol/L 醋酸
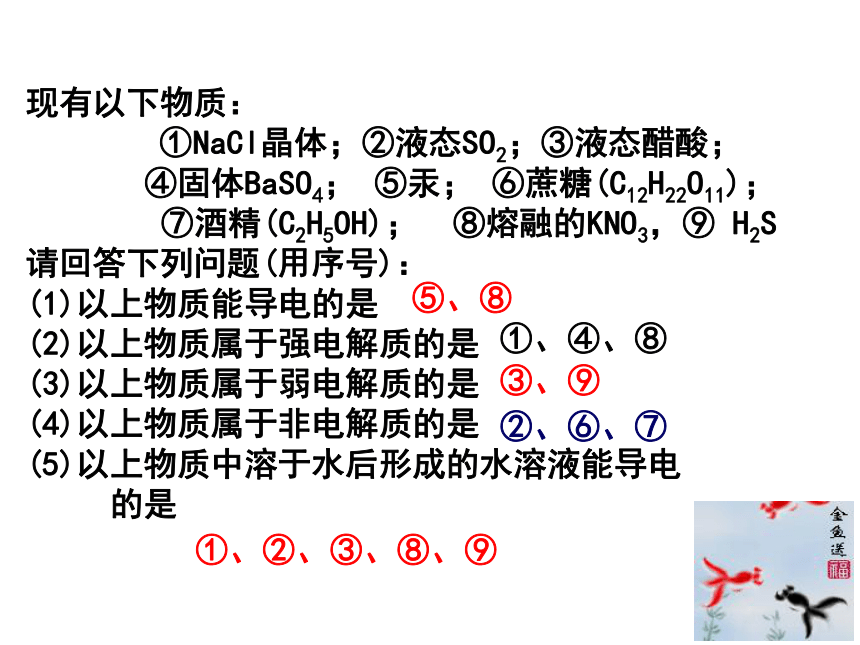
D.0.5mol/L盐酸 BD现有以下物质:
①NaCl晶体;②液态SO2;③液态醋酸;
④固体BaSO4; ⑤汞; ⑥蔗糖(C12H22O11);
⑦酒精(C2H5OH); ⑧熔融的KNO3,⑨ H2S
请回答下列问题(用序号):
(1)以上物质能导电的是
(2)以上物质属于强电解质的是
(3)以上物质属于弱电解质的是
(4)以上物质属于非电解质的是
(5)以上物质中溶于水后形成的水溶液能导电
的是⑤、⑧①、④、⑧③、⑨②、⑥、⑦①、②、③、⑧、⑨ 思考与讨论: 1)电离开始后,V(电离 )和 V(分子化)怎 样变化?各离子及分子浓度如何变化? 2)当电离达到最大程度时, V(电离)和 V(分子化)是什么关系?溶液中各分子与离子浓度是否变化?一、弱电解质的电离平衡1.定义: 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。2.特征电离平衡是一种动态平衡 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 条件改变时,电离平衡发生移动。 V电离=V分子化≠0弱电解质的电离是可逆过程逆等动定变3.图像表示已电离的醋酸浓度
醋酸初始浓度×100%1.8×10-51.8×10-50.995790.098660.421﹪1.34 ﹪ CH3COOH CH3COO - + H+P61交流与讨论
(1) 电离平衡常数表达式(K)对于一元弱酸 HA H++A-,平衡时对于一元弱碱 MOH M++OH-,平衡时 (2) 意义:大强二、电离平衡常数(K)一定条件下,不同的弱电解质K值越大,电离程度越 ,相应酸 (或碱)的酸(或碱)性越 。(3)影响电离平衡常数大小的因素 电离平衡常数与稀溶液的浓度 ,
与温度 ,一般来说随温度升高,
电离平衡常数有关无关增大(弱电解质的电离过程是吸热的过程)三、电离度α ×100%×100%(1) 表达式(2)意义: 表示在一定条件下,弱电解质分子电离程度的大小(3)电离度的影响因素
其它条件一定,一般而言:
温度越高弱电解质的电离度 ,
浓度越大弱电解质的电离度 。
越大越小四、影响电离平衡的因素
(1)温度
电离过程是吸热过程,温度升高,平衡向电离方向移动。K与电离度均增大.
(2)浓度
同一弱电解质,增大溶液的浓度,电离平衡向电离方向移动,但电离度变小.
稀释溶液时,电离平衡向电离方向移动,电离度也增大。(3)同离子效应
同离子效应(即在弱电解质溶液中加入同弱电解质具有相同离子的强电解质,使电离平衡向逆方向移动)
(4)化学反应
在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离平衡向电离方向移动。练习:250C时,0.1mol/L的乙酸溶液达到平衡,改变下列条件,请填表:左减小减小增大减小不变右减小减小增大增大不变左增大增大减小减小不变右增大减小减小增大不变右增大增大增大减小不变右增大增大增大增大增大右左左右右思考与讨论:NH3 + H2O NH3· H2O NH4 + +OH -B (2006·全国)0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+ 对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol/L盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向
移动A、HF B、K2SO4下列物质溶于水后,溶质存在电离平衡的有( )C、HNO3 D、Ca(OH)2AEE、NH3·H2O F、BaSO4D 练习
(1).1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率______________________,
最终收集到的氢气的物质的量____________________。
(2).pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率 _____________________,
最终收集到的氢气的物质的量 ____________________。硫酸>盐酸>醋酸硫酸>盐酸=醋酸三者相等醋酸>硫酸=盐酸
合
物电解质非电解质强电解质弱电解质强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI、HMnO4强碱:NaOH、Ca(OH)2、Ba(OH)2、KOH、RbOH…大部分盐:活泼金属的氧化物:弱酸:HF、HClO、H2CO3、H2SO3、H3PO4、CH3COOH弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
少部分盐:Pb(AC) 2水大部分有机物:除有机酸、碱、盐之外非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……小结:强、弱电解质的比较:离子化合物大部分
的盐类强 碱{共价化合物{强 酸弱 酸弱 碱 水}}弱电解质强电解质下列物质属于强电解质的是 (? )
A.H2CO3??? B.CH4
C.NaHCO3? D.NaHSO4下列说法正确的是 (? )
A.强电解质一定是离子化合物,弱电解质一定是共价化合物
B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物
C.CO2的水溶液导电能力很弱,所以CO2是弱电解质
D.属于共价化合物的电解质在熔化状态下一般不导电开动脑筋哦!CDD下列关于强、弱电解质的叙述正确的是( )
A、强电解质都是离子化合物,弱电解质都是共价化合物
B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C、强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
D、强电解质溶液中无溶质分子,弱电解质溶液中分子和其电离产生的离子同时存在D把0.05molNaOH固体分别加入100mL下列液体中,溶液的导电性变化不大的是( ) A.自来水
B.0.5mol/LNH4Cl溶液
C.0.5mol/L 醋酸
D.0.5mol/L盐酸 BD现有以下物质:
①NaCl晶体;②液态SO2;③液态醋酸;
④固体BaSO4; ⑤汞; ⑥蔗糖(C12H22O11);
⑦酒精(C2H5OH); ⑧熔融的KNO3,⑨ H2S
请回答下列问题(用序号):
(1)以上物质能导电的是
(2)以上物质属于强电解质的是
(3)以上物质属于弱电解质的是
(4)以上物质属于非电解质的是
(5)以上物质中溶于水后形成的水溶液能导电
的是⑤、⑧①、④、⑧③、⑨②、⑥、⑦①、②、③、⑧、⑨ 思考与讨论: 1)电离开始后,V(电离 )和 V(分子化)怎 样变化?各离子及分子浓度如何变化? 2)当电离达到最大程度时, V(电离)和 V(分子化)是什么关系?溶液中各分子与离子浓度是否变化?一、弱电解质的电离平衡1.定义: 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。2.特征电离平衡是一种动态平衡 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 条件改变时,电离平衡发生移动。 V电离=V分子化≠0弱电解质的电离是可逆过程逆等动定变3.图像表示已电离的醋酸浓度
醋酸初始浓度×100%1.8×10-51.8×10-50.995790.098660.421﹪1.34 ﹪ CH3COOH CH3COO - + H+P61交流与讨论
(1) 电离平衡常数表达式(K)对于一元弱酸 HA H++A-,平衡时对于一元弱碱 MOH M++OH-,平衡时 (2) 意义:大强二、电离平衡常数(K)一定条件下,不同的弱电解质K值越大,电离程度越 ,相应酸 (或碱)的酸(或碱)性越 。(3)影响电离平衡常数大小的因素 电离平衡常数与稀溶液的浓度 ,
与温度 ,一般来说随温度升高,
电离平衡常数有关无关增大(弱电解质的电离过程是吸热的过程)三、电离度α ×100%×100%(1) 表达式(2)意义: 表示在一定条件下,弱电解质分子电离程度的大小(3)电离度的影响因素
其它条件一定,一般而言:
温度越高弱电解质的电离度 ,
浓度越大弱电解质的电离度 。
越大越小四、影响电离平衡的因素
(1)温度
电离过程是吸热过程,温度升高,平衡向电离方向移动。K与电离度均增大.
(2)浓度
同一弱电解质,增大溶液的浓度,电离平衡向电离方向移动,但电离度变小.
稀释溶液时,电离平衡向电离方向移动,电离度也增大。(3)同离子效应
同离子效应(即在弱电解质溶液中加入同弱电解质具有相同离子的强电解质,使电离平衡向逆方向移动)
(4)化学反应
在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离平衡向电离方向移动。练习:250C时,0.1mol/L的乙酸溶液达到平衡,改变下列条件,请填表:左减小减小增大减小不变右减小减小增大增大不变左增大增大减小减小不变右增大减小减小增大不变右增大增大增大减小不变右增大增大增大增大增大右左左右右思考与讨论:NH3 + H2O NH3· H2O NH4 + +OH -B (2006·全国)0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+ 对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol/L盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向
移动A、HF B、K2SO4下列物质溶于水后,溶质存在电离平衡的有( )C、HNO3 D、Ca(OH)2AEE、NH3·H2O F、BaSO4D 练习
(1).1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率______________________,
最终收集到的氢气的物质的量____________________。
(2).pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率 _____________________,
最终收集到的氢气的物质的量 ____________________。硫酸>盐酸>醋酸硫酸>盐酸=醋酸三者相等醋酸>硫酸=盐酸
