专题一《化学反应与能量变化》测试题
图片预览



文档简介
高二化学单元测验
专题一《化学反应与能量变化》
本卷可能用到的原子量:H-1 C-12 N-14 O-8 S-32 I-127 Na-23 Cl-35.5
一、单项选择题(本题包括8小题,每小题2分,共16分。每小题只是一个选项符合题意)
1、下列关于铜电极的叙述不正确的是( )
A、铜锌原电池中铜是正极 B、用电解法精炼铜时粗铜作阳极
C、在镀件上镀铜时可用铜作阳极 D、电解稀H2SO4制H2、O2时铜做阳极
2、为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
3、下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
4、在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是 ( )
A ×100% B ×100%
C ×100% D ×100%
5、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A、甲 B、乙 C、丙 D、丁
6、家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A、4Fe(OH)2+2H2O+O2=4Fe(OH)3 B、2Fe+2H2O+O2=2Fe(OH)2↓
C、2H2O+O2+4e―=4OH- D、Fe-3e―=Fe3+
7、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
8、已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.下图为直流电源,为浸透饱和氯化钠溶液和酚酞试液的滤纸,为电镀槽.接通电路后发现上的c点显红色.为实现铁上镀锌,接通后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生氧化反应
10、2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在
200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法不正确的是
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
11、在水中加入等物质的量的Ag+、、Pb2+、Na+、、SO42-、、NO3-、、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量之比为( )
A. 35.5 :108 B.16 :207 C. 8 :1 D. 108 :35.5
12、甲、乙两个电解池均以Pt为电极且互相串联,甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液。通电一段时间后,测得甲池中电极质量增加2.16克,乙池中电极上析出0.24克金属,则乙池中溶质可能是( )
A.CuSO4 B.MgSO4 C.Mg(NO3)2 D.Na2SO4
13、用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
A. AgNO3 B. Na2SO4 C.CuCl2 D.H2SO4
14.根据以下3个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H = ―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H = ―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H = ―Q3 kJ/mol
Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
15、将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A B C D
16、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol·L-1的NaCl溶液和300mL 0.2mol·L-1的AgNO3溶液,当产生0.56L(标况)Cl2时,停止电解,取出电极,将两杯溶液混合,混合液的pH为(混合后溶液体积为500mL)。
A、1.4 B、5.6 C、7 D、12.6
答 题 卷
一、二题答案(共48分)
三、(本题包括3小题共13分)
17.(3分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
Na2S2O3·5H2O CaCl2·6H2O Na2SO4·10H2O Na2HPO4·12H2O
熔点(℃) 40.50 29.92 32.38 35.1
熔化热(kJ/mol) 49.7 37.3 77 100.1
(1)上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
_________________________;______________________________。
(2)实际应用时最常采用的(由来源和成本考虑)应该是________________________。
18、(5分)工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH) 3沉淀生成,③过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极_______________________,阴极_____________________。
(2)写出Cr2O72-转变成Cr3+的离子反应__________________________________________
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
________________________________________________________________________
(4)能否将Fe电极改成石墨电极?为什么?
________________________________________________________________________
19、(5分)碘缺乏症遍及全球,多发于山区,为控制该病的发生,我国政府规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题。
(1)可用盐酸酸化的碘化钾淀粉溶液检验食盐中的碘酸钾,反应的化学方程式
为___________________________________,现象是_____________________。
(2)碘元素位于周期第____周期______主族。其最高价氧化物的水化物酸性比HClO4 (填强或弱),其氢化物的还原性比HCl______(填强或弱)。
四、(本题包括3小题共34分)
20、(14分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a极是____ 极, b极是____ 极,
电极反应式分别为_______________ ,_____________ 。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,此时能量转化率为___________ 。[2H2(g)+O2(g) =2H2O(l) ΔH=-572kJ/mol]
(3)若这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5小时,应消耗标准状况下H2的体积为___________
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式为____________________________。此时电池内总的反应方程式为_________________________________________________。
21.(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
⑴Z2Y的化学式是 ,⑵Z2Y2与X2Y反应的化学方程式是 。
⑶如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
电极反应式是: ;
C(Ⅱ)的电极反应式是 。
⑷铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
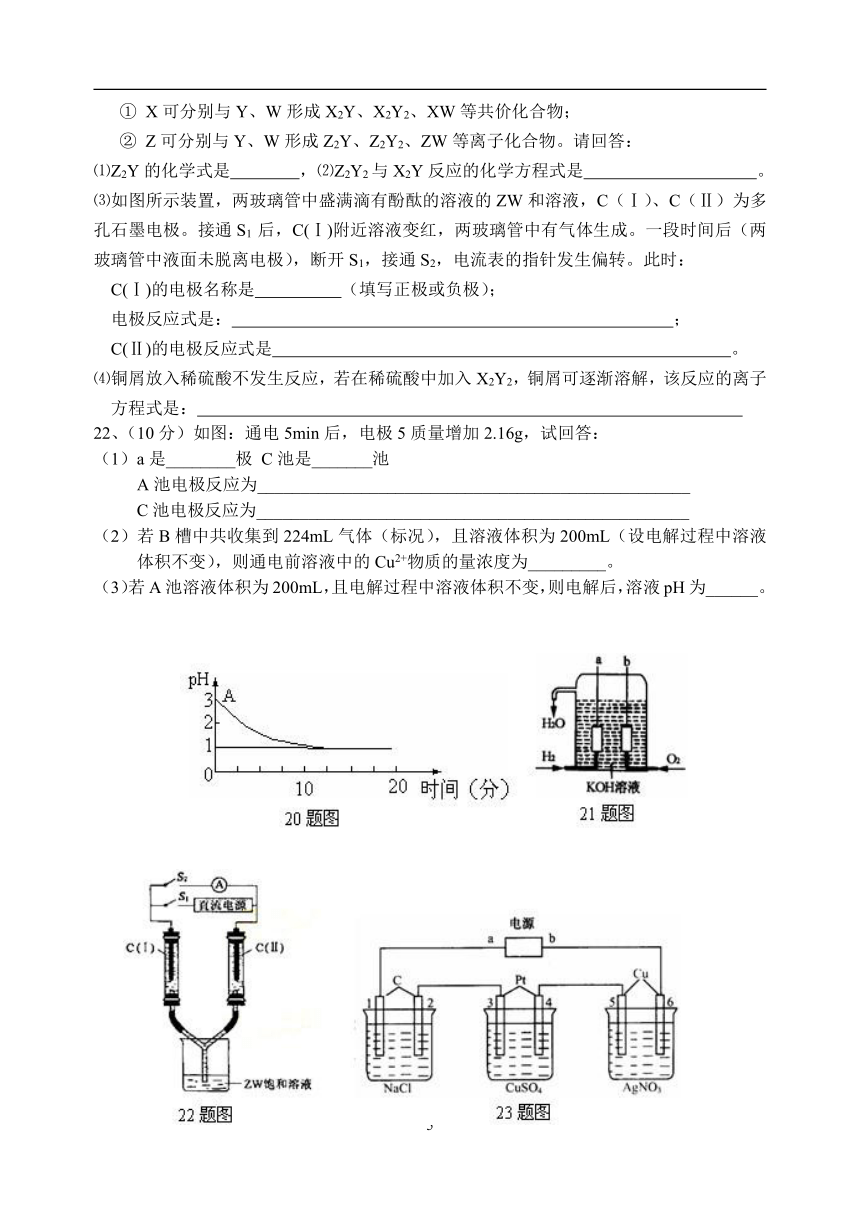
22、(10分)如图:通电5min后,电极5质量增加2.16g,试回答:
(1)a是________极 C池是_______池
A池电极反应为__________________________________________________
C池电极反应为__________________________________________________
(2)若B槽中共收集到224mL气体(标况),且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中的Cu2+物质的量浓度为_________。
(3)若A池溶液体积为200mL,且电解过程中溶液体积不变,则电解后,溶液pH为______。
五、(本题包括3小题共25分)
23、(4分)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阴极燃气,空气与CO2的混合气为阳极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:阴极反应式:2CO+2CO32-+4e-=4CO2
则阳极反应式为______________________ ;
总反应式为___________________________ ;
24、(11分)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,正极 。若不能后面两空不填。
③若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液。 _________________________________
④有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性。
25.(10分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁
(1)a极材料为_______,电极反应式为_______________________。
(2)电解液d可以是_______ ,则白色沉淀在电极上生成;电解液d也可以是______,则白色沉淀在两极间的溶液中生成。
A.纯水B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是______________ _,在加苯之前对d溶液进行加热煮沸处理,目的是______________________________________________________ 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是__________。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为_____________________________。
苏教版选修4专题1《化学反应与能量》检测试题答案
1、D 2、D 3、D 4、C 5、C 6、D 7、C 8、A
9、BD 10、D 11、D 12、BC 13、D 14、A 15、D 16、C
17、(1)Na2SO4·10H2O Na2HPO4·12H2O (2)Na2SO4·10H2O
18、(1)阳极:金属电极溶解 Fe-2e-Fe2+,阴极:生成气体 2H++2e-H2↑
(2)6Fe2++Cr2O72-+14H+ 6Fe3++2Cr3++7H2O
(3)由于阴极H+放电,破坏了水的电离平衡,H2OH++OH-,逐渐增大并向阳极移动,与Fe3+、Cr3+形成Fe(OH)3、 Cr(OH)3沉淀。(4)不能用碳电极代替Fe电极。因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
19、(1)5KI+KIO3+6HCl=6KCl+3I2+3H2O。溶液变为蓝色。
(2)根据电解总反应KI+3H2O KIO3+3H2↑
可得:KIO3 ~ 6e-
216 6
5.35 x x=0.15mol
I=
(3)碘元素位于第五周期第VIIA族,HIO4的酸性比HClO4弱,HI的还原性HCl强。
20、(1)CuCl2溶液中Cu2+的水解:Cu2++2H2OCu(OH)2+2H+,使溶液呈酸性 (2)电解时,Cu2+可在阴极析出,随着[Cu2+]的降低,Cu2+的水解平衡向左移,导致溶液中的[H+]下降,溶液的pH值会升高(但不会超过7) (3)溶液的pH值下降 pH计 因电解产生的氯气有一部分溶解在溶液中,使溶液中的气离子浓度增大,而且这种影响是实验过程中溶液pH值变化的主要因素,所以,随着电解过程的进行,溶液的pH值降低。
21、(1)负 正 2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-
(2)64.7% (3)0.325L
(4)CH4+10OH--8e-=CO32-+7H2O CH4+2O2+2OH-=CO32-+3H2O
22、解析:由已知① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。分析X为氢、Y为氧、Z为钠、W为氯。可知⑴、⑵答案。由上图装置,接通S1后构成电解池,C(Ⅰ)附近溶液变红,说明溶液呈碱性,电极反应为:2H++2e-=H2↑;C(Ⅱ)的电极反应为:2Cl—-2e—== Cl2↑。一段时间后,断开S1,接通S2,电流表的指针发生偏转,是构成原电池。C(Ⅰ)有氢气,发生氧化反应,作负极;C(Ⅱ)有氯气,发生还原反应,作正极。
答案:⑴ Na2O ⑵ 2Na2O2 +2H2O == 4NaOH + O2↑
⑶ 负极 H2-2e- = 2H+ Cl2 + 2e—== 2Cl—
⑷ Cu + H2O2 + 2H+ == Cu2+ + 2H2O
23、(1)负 电解
A:阳极:2Cl-—2e-Cl2↑ 阴极:2H++2eH2↑
C:阳极:Cu-2e-Cu2+ 阴极:Ag++e-Ag
(2)0.025mol·L-1 (3)13
24、O2+2CO2+4e-=2CO32-,2CO+O2=2CO2
25、形成原电池加速铝导线的腐蚀能,Cu-2 e-= Cu2+,2Fe3+ +2 e-=2Fe2+,电解池,阳极铜,阴极碳棒,稀硫酸作电解液,用M、N作电极,盐酸作电解液构成原电池,观察产生气泡情况
26、(1)a极材料为 Fe ,电极反应式Fe-2e-=Fe2+ 。
(2)电解液d可以是 C ;电解液d也可以是B 。
(3)隔绝空气,防止生成的氢氧化亚铁被氧化;排净溶液中溶解的氧气,防止生成的氢氧化亚铁在溶液中被氧化 。
(4)BC 。
(5)白色沉淀变成灰绿色,最后变为红褐色。
9题图
PAGE
1
专题一《化学反应与能量变化》
本卷可能用到的原子量:H-1 C-12 N-14 O-8 S-32 I-127 Na-23 Cl-35.5
一、单项选择题(本题包括8小题,每小题2分,共16分。每小题只是一个选项符合题意)
1、下列关于铜电极的叙述不正确的是( )
A、铜锌原电池中铜是正极 B、用电解法精炼铜时粗铜作阳极
C、在镀件上镀铜时可用铜作阳极 D、电解稀H2SO4制H2、O2时铜做阳极
2、为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
3、下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
4、在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是 ( )
A ×100% B ×100%
C ×100% D ×100%
5、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A、甲 B、乙 C、丙 D、丁
6、家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A、4Fe(OH)2+2H2O+O2=4Fe(OH)3 B、2Fe+2H2O+O2=2Fe(OH)2↓
C、2H2O+O2+4e―=4OH- D、Fe-3e―=Fe3+
7、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
8、已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.下图为直流电源,为浸透饱和氯化钠溶液和酚酞试液的滤纸,为电镀槽.接通电路后发现上的c点显红色.为实现铁上镀锌,接通后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生氧化反应
10、2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在
200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法不正确的是
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
11、在水中加入等物质的量的Ag+、、Pb2+、Na+、、SO42-、、NO3-、、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量之比为( )
A. 35.5 :108 B.16 :207 C. 8 :1 D. 108 :35.5
12、甲、乙两个电解池均以Pt为电极且互相串联,甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液。通电一段时间后,测得甲池中电极质量增加2.16克,乙池中电极上析出0.24克金属,则乙池中溶质可能是( )
A.CuSO4 B.MgSO4 C.Mg(NO3)2 D.Na2SO4
13、用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )
A. AgNO3 B. Na2SO4 C.CuCl2 D.H2SO4
14.根据以下3个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H = ―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H = ―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H = ―Q3 kJ/mol
Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
15、将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A B C D
16、用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol·L-1的NaCl溶液和300mL 0.2mol·L-1的AgNO3溶液,当产生0.56L(标况)Cl2时,停止电解,取出电极,将两杯溶液混合,混合液的pH为(混合后溶液体积为500mL)。
A、1.4 B、5.6 C、7 D、12.6
答 题 卷
一、二题答案(共48分)
三、(本题包括3小题共13分)
17.(3分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
Na2S2O3·5H2O CaCl2·6H2O Na2SO4·10H2O Na2HPO4·12H2O
熔点(℃) 40.50 29.92 32.38 35.1
熔化热(kJ/mol) 49.7 37.3 77 100.1
(1)上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
_________________________;______________________________。
(2)实际应用时最常采用的(由来源和成本考虑)应该是________________________。
18、(5分)工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH) 3沉淀生成,③过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极_______________________,阴极_____________________。
(2)写出Cr2O72-转变成Cr3+的离子反应__________________________________________
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
________________________________________________________________________
(4)能否将Fe电极改成石墨电极?为什么?
________________________________________________________________________
19、(5分)碘缺乏症遍及全球,多发于山区,为控制该病的发生,我国政府规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题。
(1)可用盐酸酸化的碘化钾淀粉溶液检验食盐中的碘酸钾,反应的化学方程式
为___________________________________,现象是_____________________。
(2)碘元素位于周期第____周期______主族。其最高价氧化物的水化物酸性比HClO4 (填强或弱),其氢化物的还原性比HCl______(填强或弱)。
四、(本题包括3小题共34分)
20、(14分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(1)a极是____ 极, b极是____ 极,
电极反应式分别为_______________ ,_____________ 。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,此时能量转化率为___________ 。[2H2(g)+O2(g) =2H2O(l) ΔH=-572kJ/mol]
(3)若这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5小时,应消耗标准状况下H2的体积为___________
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式为____________________________。此时电池内总的反应方程式为_________________________________________________。
21.(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
⑴Z2Y的化学式是 ,⑵Z2Y2与X2Y反应的化学方程式是 。
⑶如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);
电极反应式是: ;
C(Ⅱ)的电极反应式是 。
⑷铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:
22、(10分)如图:通电5min后,电极5质量增加2.16g,试回答:
(1)a是________极 C池是_______池
A池电极反应为__________________________________________________
C池电极反应为__________________________________________________
(2)若B槽中共收集到224mL气体(标况),且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中的Cu2+物质的量浓度为_________。
(3)若A池溶液体积为200mL,且电解过程中溶液体积不变,则电解后,溶液pH为______。
五、(本题包括3小题共25分)
23、(4分)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阴极燃气,空气与CO2的混合气为阳极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:阴极反应式:2CO+2CO32-+4e-=4CO2
则阳极反应式为______________________ ;
总反应式为___________________________ ;
24、(11分)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________。
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,正极 。若不能后面两空不填。
③若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液。 _________________________________
④有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性。
25.(10分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁
(1)a极材料为_______,电极反应式为_______________________。
(2)电解液d可以是_______ ,则白色沉淀在电极上生成;电解液d也可以是______,则白色沉淀在两极间的溶液中生成。
A.纯水B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是______________ _,在加苯之前对d溶液进行加热煮沸处理,目的是______________________________________________________ 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是__________。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为_____________________________。
苏教版选修4专题1《化学反应与能量》检测试题答案
1、D 2、D 3、D 4、C 5、C 6、D 7、C 8、A
9、BD 10、D 11、D 12、BC 13、D 14、A 15、D 16、C
17、(1)Na2SO4·10H2O Na2HPO4·12H2O (2)Na2SO4·10H2O
18、(1)阳极:金属电极溶解 Fe-2e-Fe2+,阴极:生成气体 2H++2e-H2↑
(2)6Fe2++Cr2O72-+14H+ 6Fe3++2Cr3++7H2O
(3)由于阴极H+放电,破坏了水的电离平衡,H2OH++OH-,逐渐增大并向阳极移动,与Fe3+、Cr3+形成Fe(OH)3、 Cr(OH)3沉淀。(4)不能用碳电极代替Fe电极。因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
19、(1)5KI+KIO3+6HCl=6KCl+3I2+3H2O。溶液变为蓝色。
(2)根据电解总反应KI+3H2O KIO3+3H2↑
可得:KIO3 ~ 6e-
216 6
5.35 x x=0.15mol
I=
(3)碘元素位于第五周期第VIIA族,HIO4的酸性比HClO4弱,HI的还原性HCl强。
20、(1)CuCl2溶液中Cu2+的水解:Cu2++2H2OCu(OH)2+2H+,使溶液呈酸性 (2)电解时,Cu2+可在阴极析出,随着[Cu2+]的降低,Cu2+的水解平衡向左移,导致溶液中的[H+]下降,溶液的pH值会升高(但不会超过7) (3)溶液的pH值下降 pH计 因电解产生的氯气有一部分溶解在溶液中,使溶液中的气离子浓度增大,而且这种影响是实验过程中溶液pH值变化的主要因素,所以,随着电解过程的进行,溶液的pH值降低。
21、(1)负 正 2H2+4OH--4e-=4H2O O2+2H2O+4e-=4OH-
(2)64.7% (3)0.325L
(4)CH4+10OH--8e-=CO32-+7H2O CH4+2O2+2OH-=CO32-+3H2O
22、解析:由已知① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。分析X为氢、Y为氧、Z为钠、W为氯。可知⑴、⑵答案。由上图装置,接通S1后构成电解池,C(Ⅰ)附近溶液变红,说明溶液呈碱性,电极反应为:2H++2e-=H2↑;C(Ⅱ)的电极反应为:2Cl—-2e—== Cl2↑。一段时间后,断开S1,接通S2,电流表的指针发生偏转,是构成原电池。C(Ⅰ)有氢气,发生氧化反应,作负极;C(Ⅱ)有氯气,发生还原反应,作正极。
答案:⑴ Na2O ⑵ 2Na2O2 +2H2O == 4NaOH + O2↑
⑶ 负极 H2-2e- = 2H+ Cl2 + 2e—== 2Cl—
⑷ Cu + H2O2 + 2H+ == Cu2+ + 2H2O
23、(1)负 电解
A:阳极:2Cl-—2e-Cl2↑ 阴极:2H++2eH2↑
C:阳极:Cu-2e-Cu2+ 阴极:Ag++e-Ag
(2)0.025mol·L-1 (3)13
24、O2+2CO2+4e-=2CO32-,2CO+O2=2CO2
25、形成原电池加速铝导线的腐蚀能,Cu-2 e-= Cu2+,2Fe3+ +2 e-=2Fe2+,电解池,阳极铜,阴极碳棒,稀硫酸作电解液,用M、N作电极,盐酸作电解液构成原电池,观察产生气泡情况
26、(1)a极材料为 Fe ,电极反应式Fe-2e-=Fe2+ 。
(2)电解液d可以是 C ;电解液d也可以是B 。
(3)隔绝空气,防止生成的氢氧化亚铁被氧化;排净溶液中溶解的氧气,防止生成的氢氧化亚铁在溶液中被氧化 。
(4)BC 。
(5)白色沉淀变成灰绿色,最后变为红褐色。
9题图
PAGE
1
