电化学的复习快
图片预览




文档简介
课件22张PPT。电化学 专题复习江苏省赣榆高级中学
【学习目标】
1、掌握原电池、电解池的概念及原理,了解铜的电解精炼、镀铜、氯碱工业反应原理
2、学会电极的判断,学会正确书写电极反应及总反应方程式,掌握常见离子放电的规律;
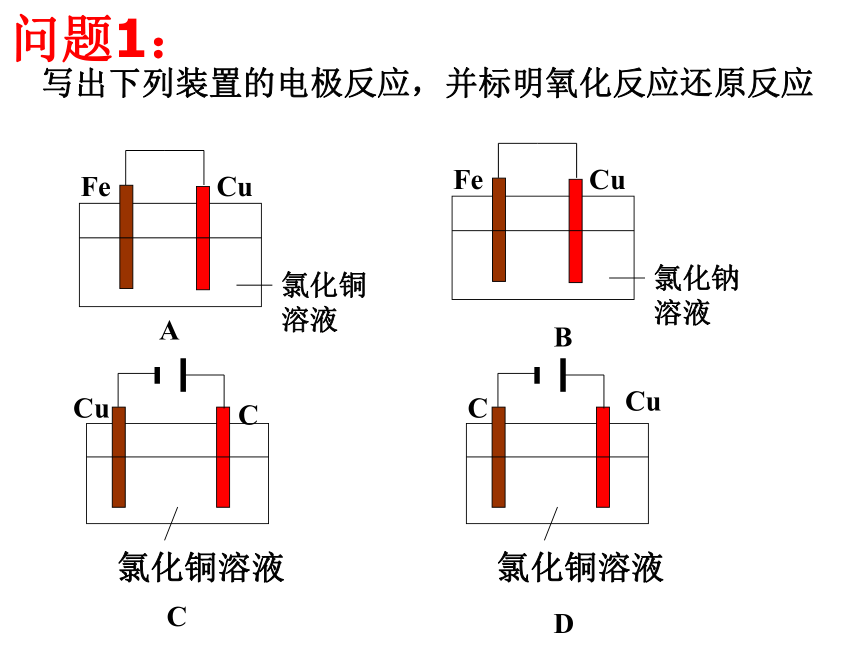
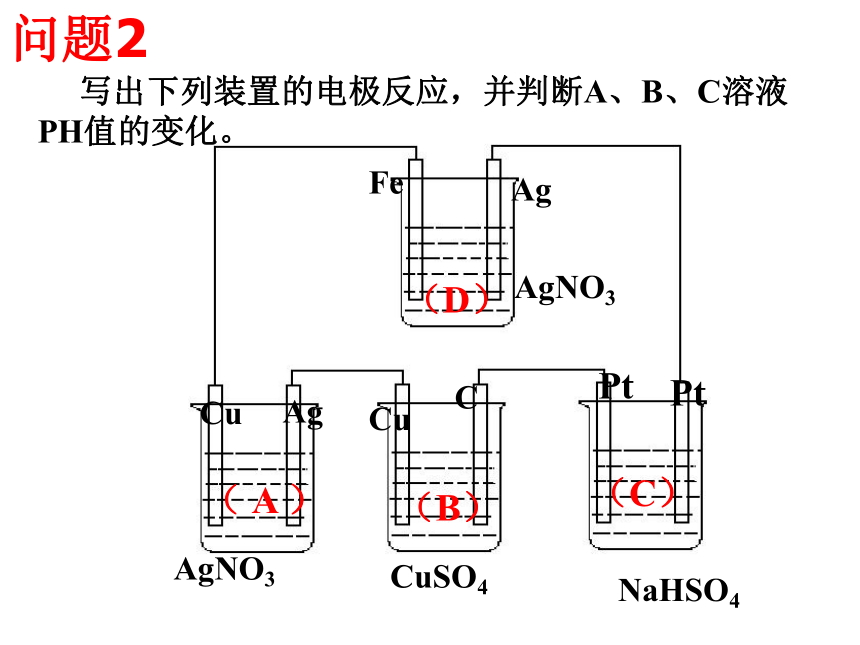
3、能运用得失电子守恒法解决电化学的相关计算。 【复习重点】原电池、电解原理及应用;电极反应方程式书写 【专题难点】电极反应及总反应方程式正确书写 写出下列装置的电极反应,并标明氧化反应还原反应ABDC问题1: 写出下列装置的电极反应,并判断A、B、C溶液PH值的变化。问题21、池型的判断有外加电源一定为电解池,无外加电源一定为原电池;多池组合时,一般含活泼金属的池为原电池,其余都是在原电池带动下的电解池。小结:一、原电池与电解池的比较及判断:3、电解池放电顺序的判断阳极放电: 1)惰性电极:则溶液中阴离子放电。
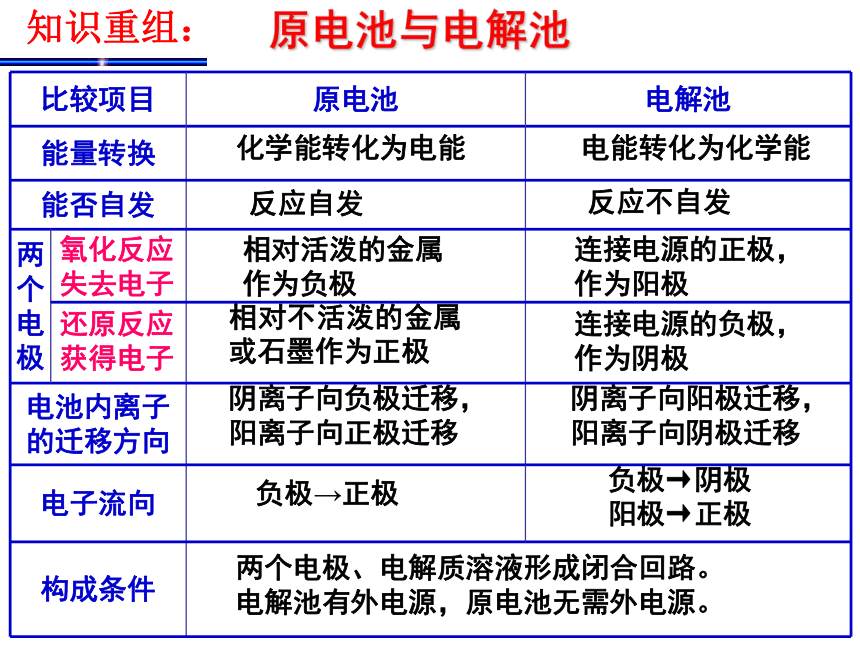
2)非惰性电极:电极材料首先失电子。阴极放电:电极材料受保护,溶液中阳离子放电。2、电极的判断原电池,看电极材料,电解池看电源的正负极。4、判断溶液的pH变化:先分析原溶液的酸碱性,再看电极产物。(1)如果只产生氢气而没有氧气,只pH变大; (2)如果只产生氧气而没有氢气,只pH变小;(3)如果既产生氢气又产生氧气 ①若原溶液呈酸性则pH减小;②若原溶液呈碱性pH增大;③若原溶液呈中性pH不变。原电池与电解池 化学能转化为电能 电能转化为化学能反应不自发反应自发连接电源的正极,作为阳极相对活泼的金属
作为负极连接电源的负极,作为阴极相对不活泼的金属或石墨作为正极阴离子向阳极迁移,阳离子向阴极迁移阴离子向负极迁移,阳离子向正极迁移两个电极、电解质溶液形成闭合回路。
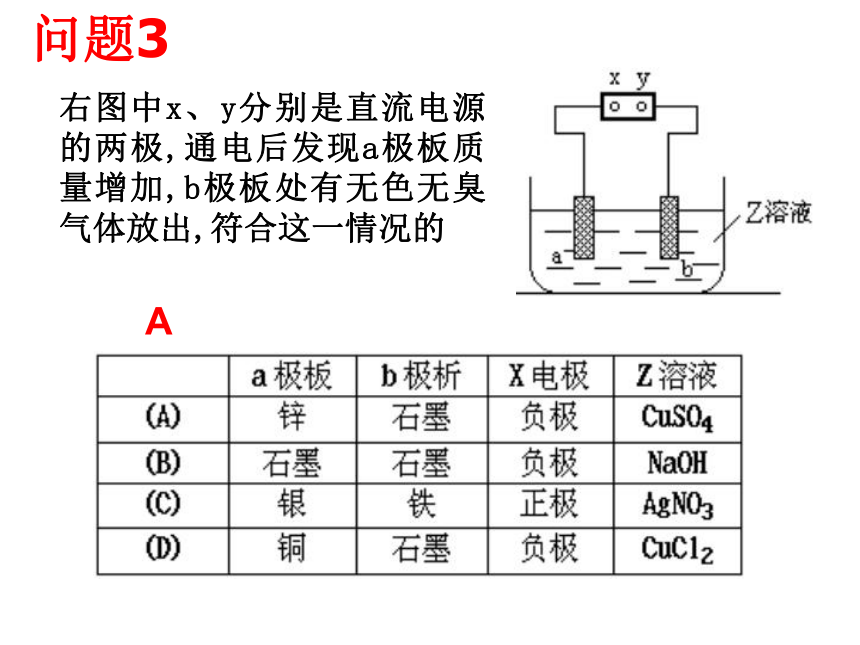
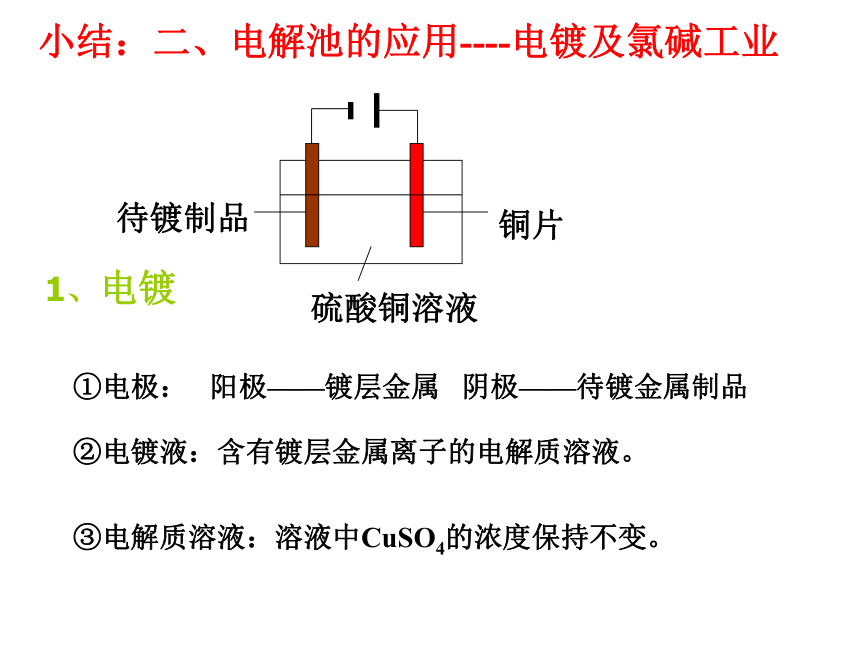
电解池有外电源,原电池无需外电源。知识重组:氧化反应失去电子还原反应获得电子负极→正极负极→阴极 阳极→正极 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的A 问题3①电极: 阳极——镀层金属 阴极——待镀金属制品 小结:二、电解池的应用----电镀及氯碱工业②电镀液:含有镀层金属离子的电解质溶液。③电解质溶液:溶液中CuSO4的浓度保持不变。1、电镀⒉氯碱工业原理下列图一、图二是铁钉在水中被腐蚀的实验 数天后数天后图一图二(1)上述两装置中铁钉发生变化的共性是:
(2)图一说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
(3)图二说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为: 发生了原电池 反应中性或弱碱吸氧负极:Fe -2e- = Fe2+ ; 正极:2H2O +O2 +4e- =4OH- 负极:Fe -2e- = Fe2+ ;正极:2H+ +2e- = H2↑较强酸性析氢问题4小结:三、电解池及原电池的应用----金属的防护1)金属腐蚀快慢的判断①电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀> 有防腐蚀措施的腐蚀
②同一种金属的腐蚀:
强电解质>弱电解质>非电解质2)金属的防护方法①改变金属内部结构②覆盖保护层③电化学保护法外加电源的阴极保护法牺牲负极的正极保护法下列装置暴露空气中一段时间,铁的腐蚀由快到慢
慢顺序 .FeFeCFeZnA(海水)B(海水)C(海水)D(海水)F(天然水)E(海水)拓展练习汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总
反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)试写出放电时的正、负极反应式
正极:______________________________________
负极:______________________________________
(2)试写出充电时的阳、阴极反应式
阳极:______________________________________
阴极:______________________________________PbO2+4H++SO42- +2e- =PbSO4+2H2OPb+ SO42--2e- =PbSO4问题5PbSO4+2H2O-2e- =PbO2 + 4H++SO42- PbSO4 +2e- =Pb + SO42-小结:四、原电池电解池的应用----可充电电池阴极:正极:放电:原电池充电:电解池 负极:阳极:?
此电池放电时,负极发生反应的物质为
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
放电
2Ag + Zn(OH)2
Ag2O + Zn + H2O
银锌电池广泛用于电子仪器的电源,它的充电和放电过程可表示为:
D 拓展练习问题6用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1摩氢氧化铜后,恰好恢复到电解前的浓度和PH,则电解中转移的电子有 ( )
A 0.1摩 B 0.2摩
C 0.3摩 D 0.4摩D小结 五. 电化学的计算------得失电子守恒法1.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是?
?A、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
?
B 达标测试2.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn +Ag2O== ZnO+2Ag根据以上提供的资料,判断下列说法正确的是
A、锌为负极,Ag2O为 正极;
B、放电时正极附近溶液的PH值升高;
C、放电时负极附近溶液的PH值升高;
D、溶液中阴离子向正极方向移动,阳离子向负极方向移动。
AB 达标测试3、2009年3月,我国收藏家蔡铭超拍而不买圆明园流失的国宝:铜铸的鼠首、兔首以维护国家尊严,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这两件1760年铜铸的国宝在249年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
A、它们的表面都电镀上了一层耐腐蚀的黄金;
B、环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;
C、铜的金属活动性比氢小,因此不宜被氧化;
D、它们是含一定比例金、银、锡、锌的合金;( D )达标测试再见!
【学习目标】
1、掌握原电池、电解池的概念及原理,了解铜的电解精炼、镀铜、氯碱工业反应原理
2、学会电极的判断,学会正确书写电极反应及总反应方程式,掌握常见离子放电的规律;
3、能运用得失电子守恒法解决电化学的相关计算。 【复习重点】原电池、电解原理及应用;电极反应方程式书写 【专题难点】电极反应及总反应方程式正确书写 写出下列装置的电极反应,并标明氧化反应还原反应ABDC问题1: 写出下列装置的电极反应,并判断A、B、C溶液PH值的变化。问题21、池型的判断有外加电源一定为电解池,无外加电源一定为原电池;多池组合时,一般含活泼金属的池为原电池,其余都是在原电池带动下的电解池。小结:一、原电池与电解池的比较及判断:3、电解池放电顺序的判断阳极放电: 1)惰性电极:则溶液中阴离子放电。
2)非惰性电极:电极材料首先失电子。阴极放电:电极材料受保护,溶液中阳离子放电。2、电极的判断原电池,看电极材料,电解池看电源的正负极。4、判断溶液的pH变化:先分析原溶液的酸碱性,再看电极产物。(1)如果只产生氢气而没有氧气,只pH变大; (2)如果只产生氧气而没有氢气,只pH变小;(3)如果既产生氢气又产生氧气 ①若原溶液呈酸性则pH减小;②若原溶液呈碱性pH增大;③若原溶液呈中性pH不变。原电池与电解池 化学能转化为电能 电能转化为化学能反应不自发反应自发连接电源的正极,作为阳极相对活泼的金属
作为负极连接电源的负极,作为阴极相对不活泼的金属或石墨作为正极阴离子向阳极迁移,阳离子向阴极迁移阴离子向负极迁移,阳离子向正极迁移两个电极、电解质溶液形成闭合回路。
电解池有外电源,原电池无需外电源。知识重组:氧化反应失去电子还原反应获得电子负极→正极负极→阴极 阳极→正极 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的A 问题3①电极: 阳极——镀层金属 阴极——待镀金属制品 小结:二、电解池的应用----电镀及氯碱工业②电镀液:含有镀层金属离子的电解质溶液。③电解质溶液:溶液中CuSO4的浓度保持不变。1、电镀⒉氯碱工业原理下列图一、图二是铁钉在水中被腐蚀的实验 数天后数天后图一图二(1)上述两装置中铁钉发生变化的共性是:
(2)图一说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为:
(3)图二说明原溶液呈 性,铁钉发生 腐蚀,
电极反应为: 发生了原电池 反应中性或弱碱吸氧负极:Fe -2e- = Fe2+ ; 正极:2H2O +O2 +4e- =4OH- 负极:Fe -2e- = Fe2+ ;正极:2H+ +2e- = H2↑较强酸性析氢问题4小结:三、电解池及原电池的应用----金属的防护1)金属腐蚀快慢的判断①电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀> 有防腐蚀措施的腐蚀
②同一种金属的腐蚀:
强电解质>弱电解质>非电解质2)金属的防护方法①改变金属内部结构②覆盖保护层③电化学保护法外加电源的阴极保护法牺牲负极的正极保护法下列装置暴露空气中一段时间,铁的腐蚀由快到慢
慢顺序 .FeFeCFeZnA(海水)B(海水)C(海水)D(海水)F(天然水)E(海水)拓展练习汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总
反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)试写出放电时的正、负极反应式
正极:______________________________________
负极:______________________________________
(2)试写出充电时的阳、阴极反应式
阳极:______________________________________
阴极:______________________________________PbO2+4H++SO42- +2e- =PbSO4+2H2OPb+ SO42--2e- =PbSO4问题5PbSO4+2H2O-2e- =PbO2 + 4H++SO42- PbSO4 +2e- =Pb + SO42-小结:四、原电池电解池的应用----可充电电池阴极:正极:放电:原电池充电:电解池 负极:阳极:?
此电池放电时,负极发生反应的物质为
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
充电
放电
2Ag + Zn(OH)2
Ag2O + Zn + H2O
银锌电池广泛用于电子仪器的电源,它的充电和放电过程可表示为:
D 拓展练习问题6用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1摩氢氧化铜后,恰好恢复到电解前的浓度和PH,则电解中转移的电子有 ( )
A 0.1摩 B 0.2摩
C 0.3摩 D 0.4摩D小结 五. 电化学的计算------得失电子守恒法1.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是?
?A、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
?
B 达标测试2.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn +Ag2O== ZnO+2Ag根据以上提供的资料,判断下列说法正确的是
A、锌为负极,Ag2O为 正极;
B、放电时正极附近溶液的PH值升高;
C、放电时负极附近溶液的PH值升高;
D、溶液中阴离子向正极方向移动,阳离子向负极方向移动。
AB 达标测试3、2009年3月,我国收藏家蔡铭超拍而不买圆明园流失的国宝:铜铸的鼠首、兔首以维护国家尊严,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这两件1760年铜铸的国宝在249年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
A、它们的表面都电镀上了一层耐腐蚀的黄金;
B、环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;
C、铜的金属活动性比氢小,因此不宜被氧化;
D、它们是含一定比例金、银、锡、锌的合金;( D )达标测试再见!
