宿迁市2008-2009高三第二次化学调研
文档属性
| 名称 | 宿迁市2008-2009高三第二次化学调研 |

|
|
| 格式 | zip | ||
| 文件大小 | 479.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-04-19 00:00:00 | ||
图片预览


文档简介
2008~2009学年度江苏省宿迁中学宿迁市高三化学第二次统测模拟练习
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ca 40 Cu 64 Br 80 Ba 137
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.化学与科技、生活、社会密切相关,下列说法正确的是www.
A.08年10月以后,北京小汽车仍将按车牌号限时行弛,提倡公民坐公交车,这体现了世界能源危机,符合节约型社会的需要。
B.08年10月8日瑞典皇家科学院将今年诺贝尔化学奖授予华裔科学家钱永键(中国导弹之父钱学森的堂侄)、日本科学家下村修和美国科学家马丁·沙尔菲三人,这体现了科学无国界,国际间也要注重科技合作、科技继承与创新。
C.08年6月1日(农历二〇〇八年四月二十八),我国开始实施 “限塑令”,在商场购物,顾客所要塑料袋需付费使用,目的是刺激货币流通,应对08年世界性“金融危机”。
D.三聚氰胺(C3N6H6)俗称“伪蛋白”、“蛋白精”,加入到奶粉中,目的是提高含氮量,即提高蛋白质的含量,口感舒适,便于饮用。
2.下列离子方程式不正确的是
A.将0.1 mol/L HCl溶液数滴缓缓滴入1mol/L50mL Na2CO3溶液中,且不断搅拌
2H++CO32-=CO2↑+H2O
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入 HNO3再加入PbO2,则反应体系显紫红色
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
3.NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,1L液态水中含有的H+ 数目10-7NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.常温常压下,含有NA 个NO2分子的气体质量为4.6g
D.14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
4.向某硫酸铜的饱和溶液中加入含18O的无水硫酸铜粉末 g, 若保持溶液温度不变时, 其结果是
A.无水硫酸铜不再溶解, 粉末的质量不变, 仍为 g
B.溶液中进入含有18O的硫酸根离子, 且白色粉末变为蓝色晶体, 其质量大于 g
C.只发现白色粉末变为蓝色晶体,其质量大于 g
D.溶解平衡被破坏,达到平衡时,有部分含有 18O的硫酸根离子进入溶液,剩余的粉末质量小于 g
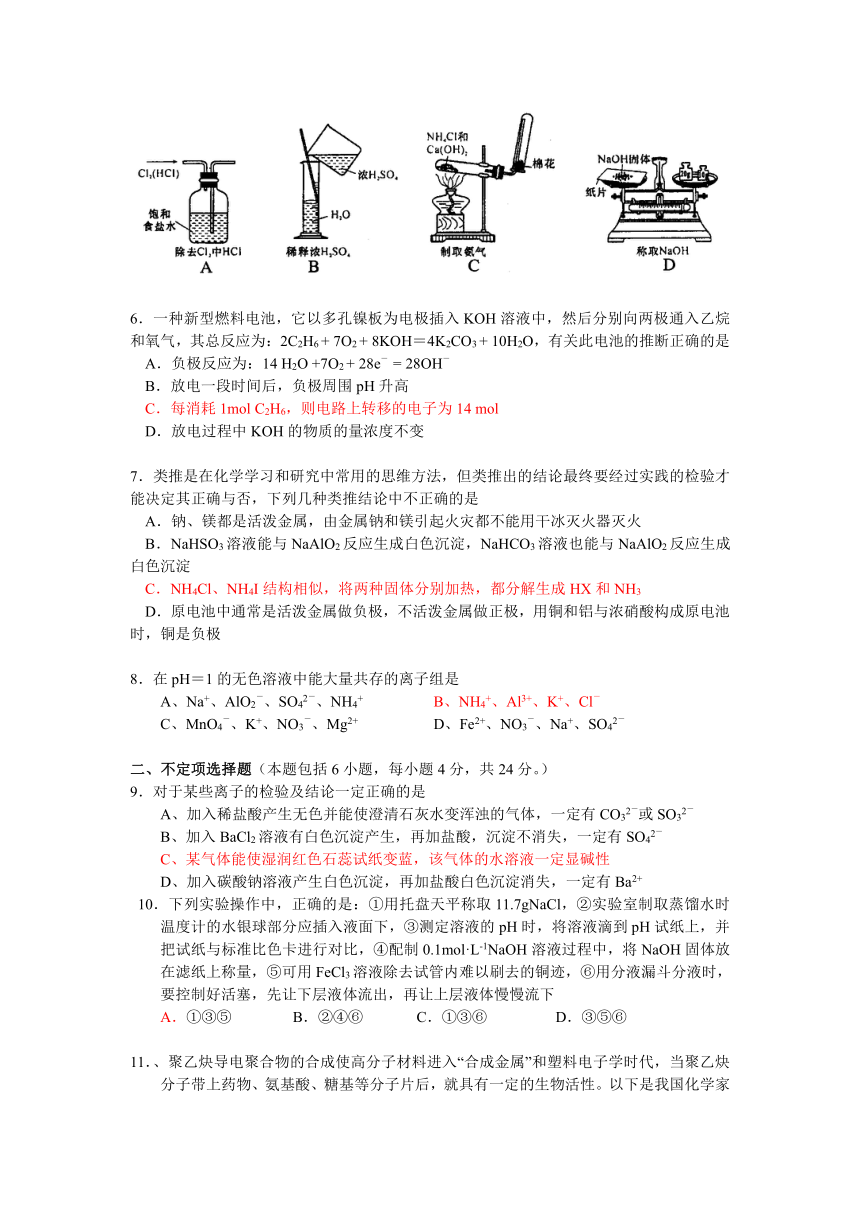
5.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是C
6.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 + 7O2 + 8KOH=4K2CO3 + 10H2O,有关此电池的推断正确的是
A.负极反应为:14 H2O +7O2 + 28e- = 28OH-
B.放电一段时间后,负极周围pH升高
C.每消耗1mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
7.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHSO3溶液能与NaAlO2反应生成白色沉淀,NaHCO3溶液也能与NaAlO2反应生成白色沉淀
C.NH4Cl、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铜是负极
8.在pH=1的无色溶液中能大量共存的离子组是
A、Na+、AlO2-、SO42-、NH4+ B、NH4+、Al3+、K+、Cl-
C、MnO4-、K+、NO3-、Mg2+ D、Fe2+、NO3-、Na+、SO42-
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.对于某些离子的检验及结论一定正确的是
A、加入稀盐酸产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-
B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C、某气体能使湿润红色石蕊试纸变蓝,该气体的水溶液一定显碱性
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
10.下列实验操作中,正确的是:①用托盘天平称取11.7gNaCl,②实验室制取蒸馏水时温度计的水银球部分应插入液面下,③测定溶液的pH时,将溶液滴到pH试纸上,并把试纸与标准比色卡进行对比,④配制0.1mol·L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量,⑤可用FeCl3溶液除去试管内难以刷去的铜迹,⑥用分液漏斗分液时,要控制好活塞,先让下层液体流出,再让上层液体慢慢流下
A.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥
11.、聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性。以下是我国化学家近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基)
下列关于上述高分子的说法不正确的是
A、A和B均能在一定条件下水解,且水解形成相同的高分子
B、A中药物小分子羧酸的分子式为C16H18O4
C、B中氨基酸为2-氨基-3-甲基丁酸
D、A和B各1mol与热碱液反应,均最多消耗2n mol NaOH
12.25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
13.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.HCl和NaAlO2溶液反应后铝元素的存在形式:
B.常温条件下,酚酞的变色范围:
C.分散系的分类:
D.CO2通入澄清石灰水中反应的产物:
14.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)则下列分析推理中不正确的是
50mL盐酸 50mL盐酸 50mL盐酸
m(混合物) 9.2g 15.7g 27.6g
V(CO2)(标况) 2.24L 3.36L 3.36L
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
15.(10分) 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
(1)本实验中生成CO2和SO2的有关反应的化学方程式为:
_________________________;________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是__________________________
_________________________________________________。
(3)用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是___________________________________________________
___________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
16.(10分)下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
⑴物质E的电子式是_____▲ _______;物质J的名称为 ▲ 。
⑵反应⑤的化学方程式为________▲ ___________________________________。
⑶反应③的现象为_______________________▲ ____________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为______▲ __。
17.(10分)下图是工业生产硝酸铵的流程。
(1)吸收塔C中通入空气的目的是 ▲ 。A、B、C、D四个容器中的反应,属于氧化
还原反应的是 ▲ (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ▲ ,氨催化氧化反应的化学平衡常数表达式K= ▲ 。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H=一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 ▲ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达
到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为 ▲ 。
18、(10分)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:①化合物G的化学式为 , ②1mol NH3 和0.75molE恰好完全反应生成G和HCl,则化合物E的分子式为 。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃的主要原料。与氧反应所得的产物还有一种单质,与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式 ;
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高
温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表达为Si6-xAlxOxY8-x。在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。试问:①赛伦中Y元素的化合价为: 。赛伦的晶体类型为 。
19、(12分)石油化工是是江苏省的支柱产业之一。丙烯是重要的化工原料,一定条件下可发生下列转化:
回答下列问题:
⑴A的结构简式为____________________。
⑵反应①~⑦中,属于取代反应的是___________________(填序号)。
⑶D与足量乙醇反应生成E的化学方程式为_______________________________。
⑷与足量NaOH溶液反应的化学方程式为___________________。
⑸B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体的结构简式为:_________________________________________________________
___________________________________________________________________。
20、(8分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
t(s) 0 1 2 3 4 5
n(NO)(mol) 0.50 0.35 0.28 0.25 0.25 0.25
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
21.(12分)铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。
⑵铜的熔点比钙高,其原因是 ▲ ;右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 ▲ 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 ▲ (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲ 。
2008~2009学年度江苏省宿迁中学市二统模拟练习参考答案
15 (每空2分,共10分)
16(每空2分,共10分)
⑴ (2分) 次氯酸钙(2分)
⑵Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O (2分)
⑶有白烟产生 (2分)
⑷CaCN2 (2分)
18、(每空2分,共10分)
(1)Si3N4 ; SiCl4
(2)Si3N4 + 6H2O = 3SiO2 + 4 NH3 (3) —3 ; 原子晶体(每空2分)
19.(第⑸小题4分,其余每空2分,共12分)
⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶+2C2H5OH+2H2O
⑷+2NaOH+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO HOCH2CH(CH3)CHO(写4个即可给满分)
20、(每空2分,共8分)
(1)BCD (2)BC (3)K=16 (4)2.8L(每空2分)
21.(每空2分,共12分)
⑴1s22s22p63s23p63d104s1 ⑵晶体中铜的金属键强度大于钙 1:5
⑶①A、C ②平面正方型 ③sp2
V(盐酸溶液)/mL
pH
a
7
c
b
A
C
D
B
0
20
A
B
C
D
E
F
G
I
J
K+H2O
H
C
H2O
高温
H2O
①
②
③
④
⑤
B
H2O,H+
CH3-CH-CH3
CN
KCN
A
HBr
CH3-CH=CH2
③
②
①
④
催化剂
Br2
CH3-C-CH3
Br
COOH
E
C2H5OH,H+
D
H2O,H+
C
KCN
⑦
⑥
⑤
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ca 40 Cu 64 Br 80 Ba 137
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.化学与科技、生活、社会密切相关,下列说法正确的是www.
A.08年10月以后,北京小汽车仍将按车牌号限时行弛,提倡公民坐公交车,这体现了世界能源危机,符合节约型社会的需要。
B.08年10月8日瑞典皇家科学院将今年诺贝尔化学奖授予华裔科学家钱永键(中国导弹之父钱学森的堂侄)、日本科学家下村修和美国科学家马丁·沙尔菲三人,这体现了科学无国界,国际间也要注重科技合作、科技继承与创新。
C.08年6月1日(农历二〇〇八年四月二十八),我国开始实施 “限塑令”,在商场购物,顾客所要塑料袋需付费使用,目的是刺激货币流通,应对08年世界性“金融危机”。
D.三聚氰胺(C3N6H6)俗称“伪蛋白”、“蛋白精”,加入到奶粉中,目的是提高含氮量,即提高蛋白质的含量,口感舒适,便于饮用。
2.下列离子方程式不正确的是
A.将0.1 mol/L HCl溶液数滴缓缓滴入1mol/L50mL Na2CO3溶液中,且不断搅拌
2H++CO32-=CO2↑+H2O
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入 HNO3再加入PbO2,则反应体系显紫红色
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
3.NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,1L液态水中含有的H+ 数目10-7NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.常温常压下,含有NA 个NO2分子的气体质量为4.6g
D.14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
4.向某硫酸铜的饱和溶液中加入含18O的无水硫酸铜粉末 g, 若保持溶液温度不变时, 其结果是
A.无水硫酸铜不再溶解, 粉末的质量不变, 仍为 g
B.溶液中进入含有18O的硫酸根离子, 且白色粉末变为蓝色晶体, 其质量大于 g
C.只发现白色粉末变为蓝色晶体,其质量大于 g
D.溶解平衡被破坏,达到平衡时,有部分含有 18O的硫酸根离子进入溶液,剩余的粉末质量小于 g
5.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是C
6.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 + 7O2 + 8KOH=4K2CO3 + 10H2O,有关此电池的推断正确的是
A.负极反应为:14 H2O +7O2 + 28e- = 28OH-
B.放电一段时间后,负极周围pH升高
C.每消耗1mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
7.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHSO3溶液能与NaAlO2反应生成白色沉淀,NaHCO3溶液也能与NaAlO2反应生成白色沉淀
C.NH4Cl、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铜是负极
8.在pH=1的无色溶液中能大量共存的离子组是
A、Na+、AlO2-、SO42-、NH4+ B、NH4+、Al3+、K+、Cl-
C、MnO4-、K+、NO3-、Mg2+ D、Fe2+、NO3-、Na+、SO42-
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.对于某些离子的检验及结论一定正确的是
A、加入稀盐酸产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-
B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C、某气体能使湿润红色石蕊试纸变蓝,该气体的水溶液一定显碱性
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
10.下列实验操作中,正确的是:①用托盘天平称取11.7gNaCl,②实验室制取蒸馏水时温度计的水银球部分应插入液面下,③测定溶液的pH时,将溶液滴到pH试纸上,并把试纸与标准比色卡进行对比,④配制0.1mol·L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量,⑤可用FeCl3溶液除去试管内难以刷去的铜迹,⑥用分液漏斗分液时,要控制好活塞,先让下层液体流出,再让上层液体慢慢流下
A.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥
11.、聚乙炔导电聚合物的合成使高分子材料进入“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸、糖基等分子片后,就具有一定的生物活性。以下是我国化学家近年来合成的一些聚乙炔衍生物分子的结构式:(Me指甲基)
下列关于上述高分子的说法不正确的是
A、A和B均能在一定条件下水解,且水解形成相同的高分子
B、A中药物小分子羧酸的分子式为C16H18O4
C、B中氨基酸为2-氨基-3-甲基丁酸
D、A和B各1mol与热碱液反应,均最多消耗2n mol NaOH
12.25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
13.化学与数学有着密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的效果。下列用数轴表示的化学知识中正确的是
A.HCl和NaAlO2溶液反应后铝元素的存在形式:
B.常温条件下,酚酞的变色范围:
C.分散系的分类:
D.CO2通入澄清石灰水中反应的产物:
14.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)则下列分析推理中不正确的是
50mL盐酸 50mL盐酸 50mL盐酸
m(混合物) 9.2g 15.7g 27.6g
V(CO2)(标况) 2.24L 3.36L 3.36L
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
15.(10分) 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
(1)本实验中生成CO2和SO2的有关反应的化学方程式为:
_________________________;________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是__________________________
_________________________________________________。
(3)用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是___________________________________________________
___________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
16.(10分)下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
⑴物质E的电子式是_____▲ _______;物质J的名称为 ▲ 。
⑵反应⑤的化学方程式为________▲ ___________________________________。
⑶反应③的现象为_______________________▲ ____________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为______▲ __。
17.(10分)下图是工业生产硝酸铵的流程。
(1)吸收塔C中通入空气的目的是 ▲ 。A、B、C、D四个容器中的反应,属于氧化
还原反应的是 ▲ (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ▲ ,氨催化氧化反应的化学平衡常数表达式K= ▲ 。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H=一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 ▲ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达
到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为 ▲ 。
18、(10分)未来的交通工具将采用新一代无机非金属材料制成的无水冷发动机。这类材料中研究得较多的是化合物G。
(1)化合物G的相对分子质量为140,G中硅元素的质量分数为60%,另有元素Y。G可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl气体。请推断:①化合物G的化学式为 , ②1mol NH3 和0.75molE恰好完全反应生成G和HCl,则化合物E的分子式为 。
(2)粉末状G能够与空气中的氧气和水作用,所得产物中都有一种酸性氧化物,它是工业上生产玻璃的主要原料。与氧反应所得的产物还有一种单质,与水反应生成另一种产物是该种单质元素的氢化物。请写出化合物G与水反应的化学方程式 ;
(3)为了使化合物G能成为新一代汽车发动机材料,现采用常压下在G中添加氧化铝,经高
温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表达为Si6-xAlxOxY8-x。在接近于1700℃时x的极限值约为4.0,在1400℃时x为2.0,以保持整个化合物呈电中性。试问:①赛伦中Y元素的化合价为: 。赛伦的晶体类型为 。
19、(12分)石油化工是是江苏省的支柱产业之一。丙烯是重要的化工原料,一定条件下可发生下列转化:
回答下列问题:
⑴A的结构简式为____________________。
⑵反应①~⑦中,属于取代反应的是___________________(填序号)。
⑶D与足量乙醇反应生成E的化学方程式为_______________________________。
⑷与足量NaOH溶液反应的化学方程式为___________________。
⑸B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体的结构简式为:_________________________________________________________
___________________________________________________________________。
20、(8分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
t(s) 0 1 2 3 4 5
n(NO)(mol) 0.50 0.35 0.28 0.25 0.25 0.25
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
21.(12分)铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。
⑵铜的熔点比钙高,其原因是 ▲ ;右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 ▲ 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 ▲ (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲ 。
2008~2009学年度江苏省宿迁中学市二统模拟练习参考答案
15 (每空2分,共10分)
16(每空2分,共10分)
⑴ (2分) 次氯酸钙(2分)
⑵Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O (2分)
⑶有白烟产生 (2分)
⑷CaCN2 (2分)
18、(每空2分,共10分)
(1)Si3N4 ; SiCl4
(2)Si3N4 + 6H2O = 3SiO2 + 4 NH3 (3) —3 ; 原子晶体(每空2分)
19.(第⑸小题4分,其余每空2分,共12分)
⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶+2C2H5OH+2H2O
⑷+2NaOH+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO HOCH2CH(CH3)CHO(写4个即可给满分)
20、(每空2分,共8分)
(1)BCD (2)BC (3)K=16 (4)2.8L(每空2分)
21.(每空2分,共12分)
⑴1s22s22p63s23p63d104s1 ⑵晶体中铜的金属键强度大于钙 1:5
⑶①A、C ②平面正方型 ③sp2
V(盐酸溶液)/mL
pH
a
7
c
b
A
C
D
B
0
20
A
B
C
D
E
F
G
I
J
K+H2O
H
C
H2O
高温
H2O
①
②
③
④
⑤
B
H2O,H+
CH3-CH-CH3
CN
KCN
A
HBr
CH3-CH=CH2
③
②
①
④
催化剂
Br2
CH3-C-CH3
Br
COOH
E
C2H5OH,H+
D
H2O,H+
C
KCN
⑦
⑥
⑤
同课章节目录
