原电池
图片预览



文档简介
课件16张PPT。专题2 化学反应与能量变化第三单元 化学能与电能的转化
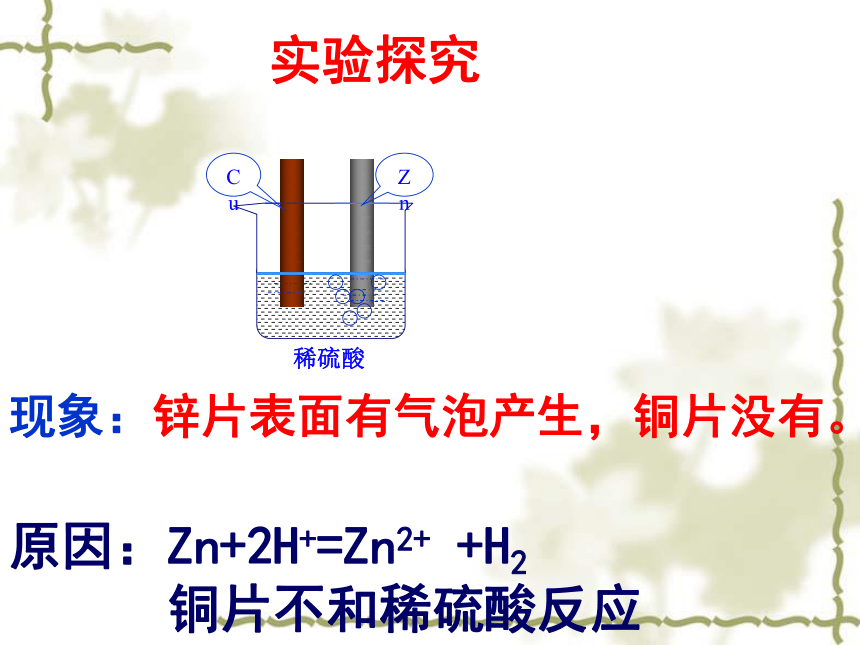
(原电池的工作原理)现象:锌片表面有气泡产生,铜片没有。原因:Zn+2H+=Zn2+ +H2
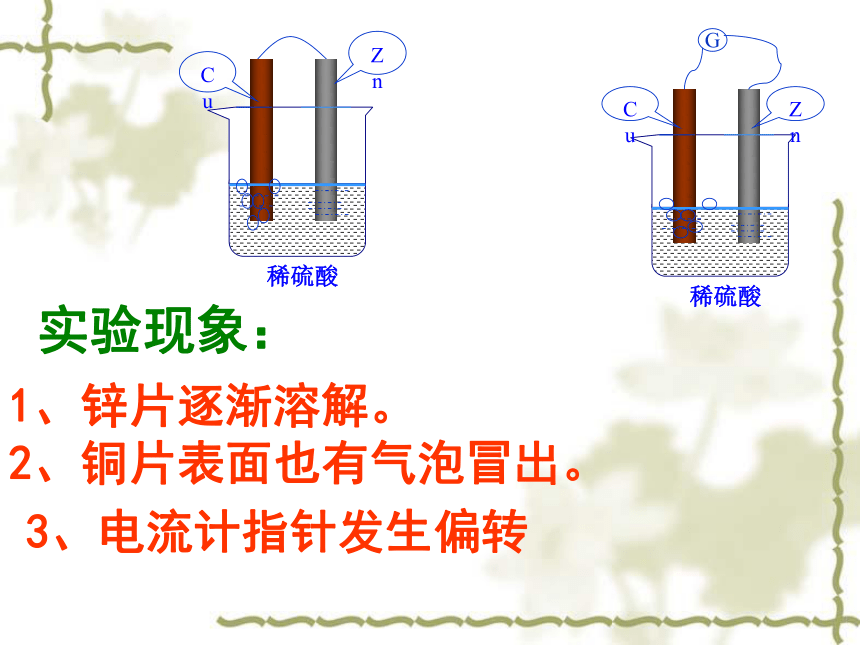
铜片不和稀硫酸反应CuZn实验探究实验现象:1、锌片逐渐溶解。
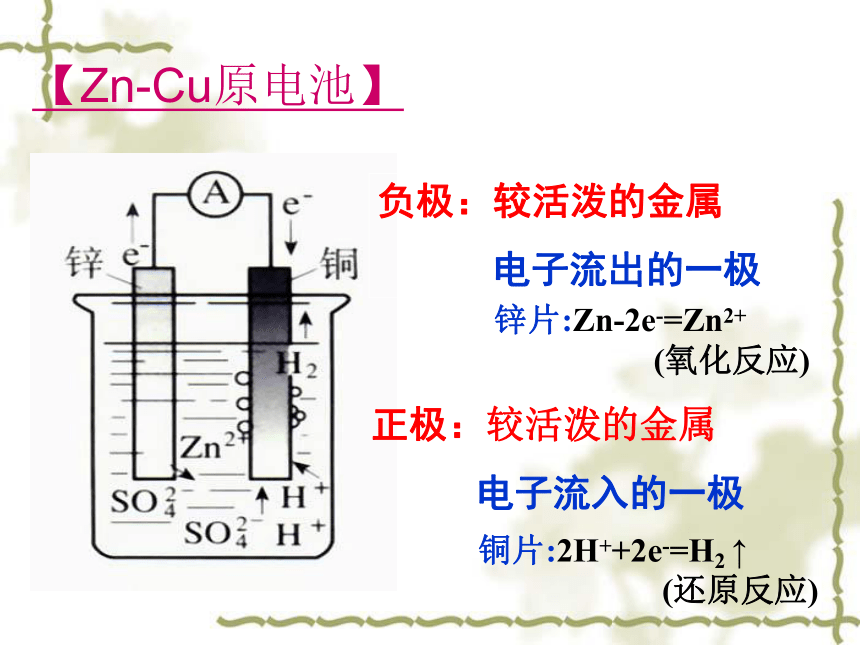
2、铜片表面也有气泡冒出。ZnCu3、电流计指针发生偏转【Zn-Cu原电池】 锌片:Zn-2e-=Zn2+
(氧化反应) 铜片:2H++2e-=H2 ↑
(还原反应)负极:较活泼的金属
电子流出的一极正极:较活泼的金属
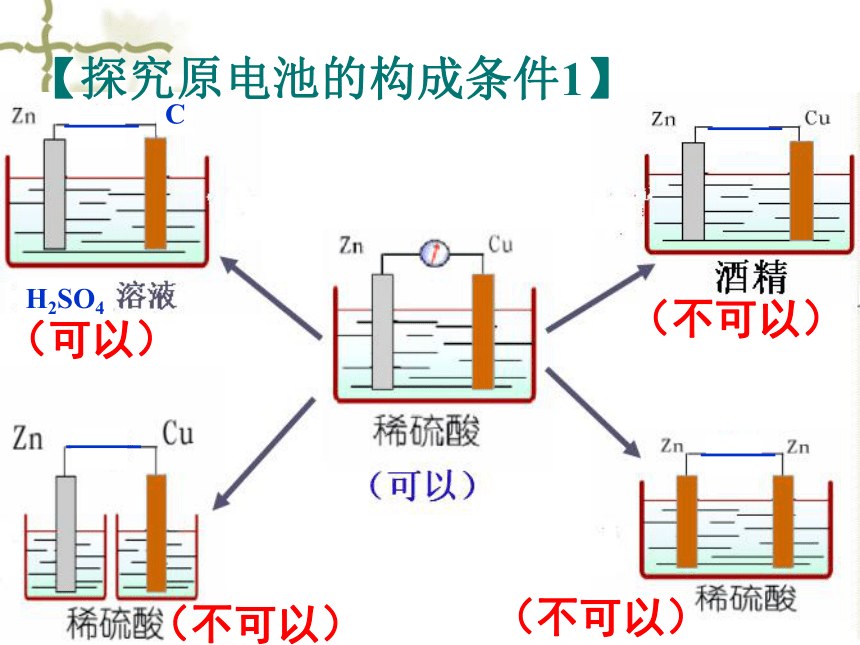
电子流入的一极【原电池】1、原电池是 的装置。将化学能转变为电能 2、原电池的工作实质:氧化还原反应3、原电池的正、负极和电极反应:正极:电子流入(得电子)负极:电子流出(失电子)负极为相对较活泼金属 正极为相对较不活泼金属或能导电的非金属(不可以)(可以)H2SO4(不可以)(不可以)C【探究原电池的构成条件1】【原电池的构成条件】①有活泼性不同的两个金属电极
(或金属与能导电的非金属);②形成闭合电路(或直接接触);③电极与电解质溶液接触;构成原电池的条件8(不可以)(可以)稀H2SO4
稀H2SO4CuC
【探究原电池的构成条件2】④一个能自发进行的氧化还原反应。你找到格林太太的病因了吗?
你能为她开一个药方吗?由于金与铁(钢的主要成分)
是活动性不同的两种金属,
唾液中含有电解质,故构成
了原电池,产生了微小的电
流,使得格林太太头痛,因
此必须换掉其中的一颗假牙。【练习:】1 书写电极反应式:用铁作负极,碳棒作正极。
负极: Fe - 2e-= Fe 2+
正极: Cu2+ + 2e- = Cu2、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADCB3、 原电池的设计(1) 请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 【小结:】 谢谢 !
(原电池的工作原理)现象:锌片表面有气泡产生,铜片没有。原因:Zn+2H+=Zn2+ +H2
铜片不和稀硫酸反应CuZn实验探究实验现象:1、锌片逐渐溶解。
2、铜片表面也有气泡冒出。ZnCu3、电流计指针发生偏转【Zn-Cu原电池】 锌片:Zn-2e-=Zn2+
(氧化反应) 铜片:2H++2e-=H2 ↑
(还原反应)负极:较活泼的金属
电子流出的一极正极:较活泼的金属
电子流入的一极【原电池】1、原电池是 的装置。将化学能转变为电能 2、原电池的工作实质:氧化还原反应3、原电池的正、负极和电极反应:正极:电子流入(得电子)负极:电子流出(失电子)负极为相对较活泼金属 正极为相对较不活泼金属或能导电的非金属(不可以)(可以)H2SO4(不可以)(不可以)C【探究原电池的构成条件1】【原电池的构成条件】①有活泼性不同的两个金属电极
(或金属与能导电的非金属);②形成闭合电路(或直接接触);③电极与电解质溶液接触;构成原电池的条件8(不可以)(可以)稀H2SO4
稀H2SO4CuC
【探究原电池的构成条件2】④一个能自发进行的氧化还原反应。你找到格林太太的病因了吗?
你能为她开一个药方吗?由于金与铁(钢的主要成分)
是活动性不同的两种金属,
唾液中含有电解质,故构成
了原电池,产生了微小的电
流,使得格林太太头痛,因
此必须换掉其中的一颗假牙。【练习:】1 书写电极反应式:用铁作负极,碳棒作正极。
负极: Fe - 2e-= Fe 2+
正极: Cu2+ + 2e- = Cu2、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADCB3、 原电池的设计(1) 请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 【小结:】 谢谢 !
