专题一复习(浙江省温州市)
图片预览





文档简介
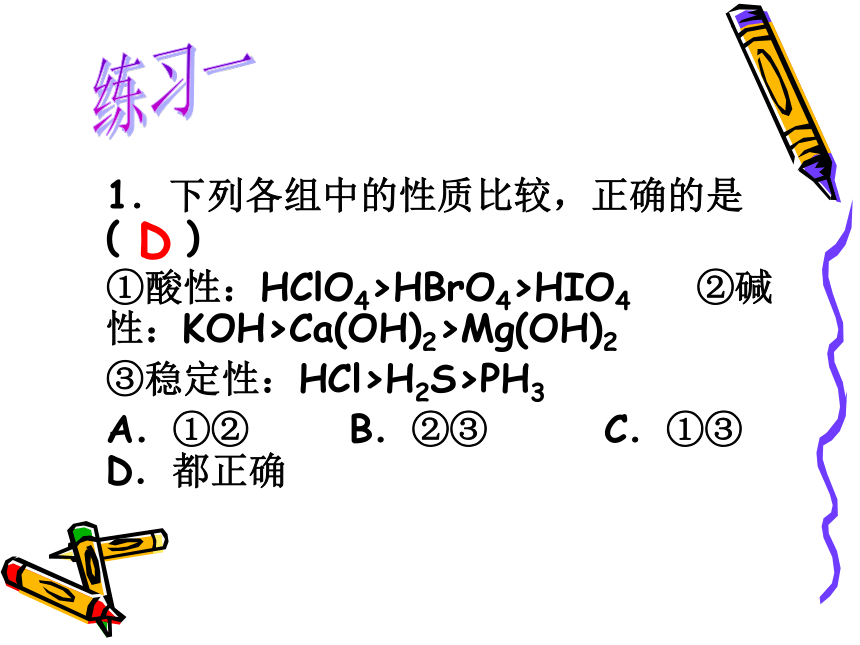
课件22张PPT。专题一 微粒结构与物质的多样性复习课 1.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:KOH>Ca(OH)2>Mg(OH)2
③稳定性:HCl>H2S>PH3
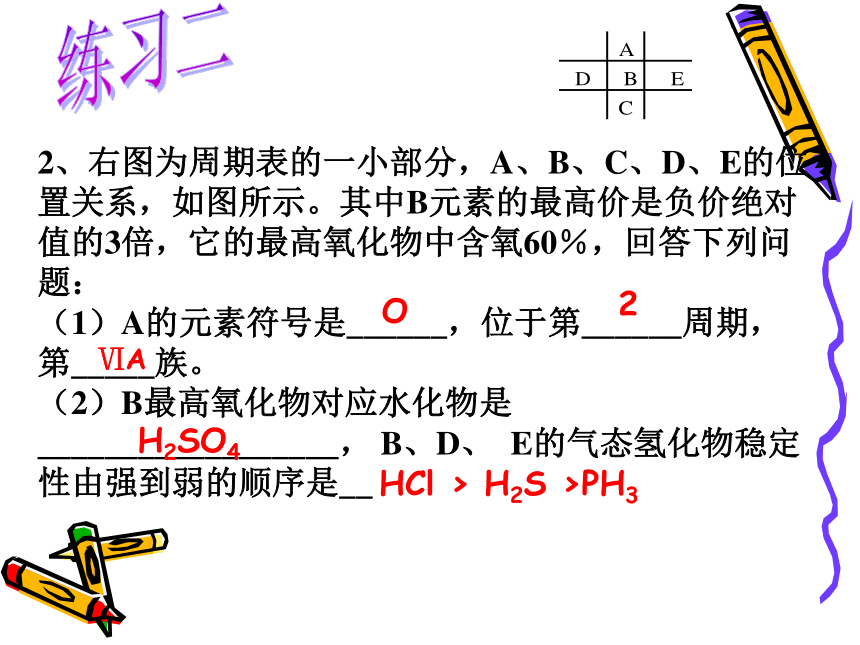
A.①② B.②③ C.①③ D.都正确练习一D练习二2、右图为周期表的一小部分,A、B、C、D、E的位置关系,如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
(1)A的元素符号是______,位于第______周期,第_____族。
(2)B最高氧化物对应水化物是__________________, B、D、 E的气态氢化物稳定性由强到弱的顺序是__ O2ⅥA
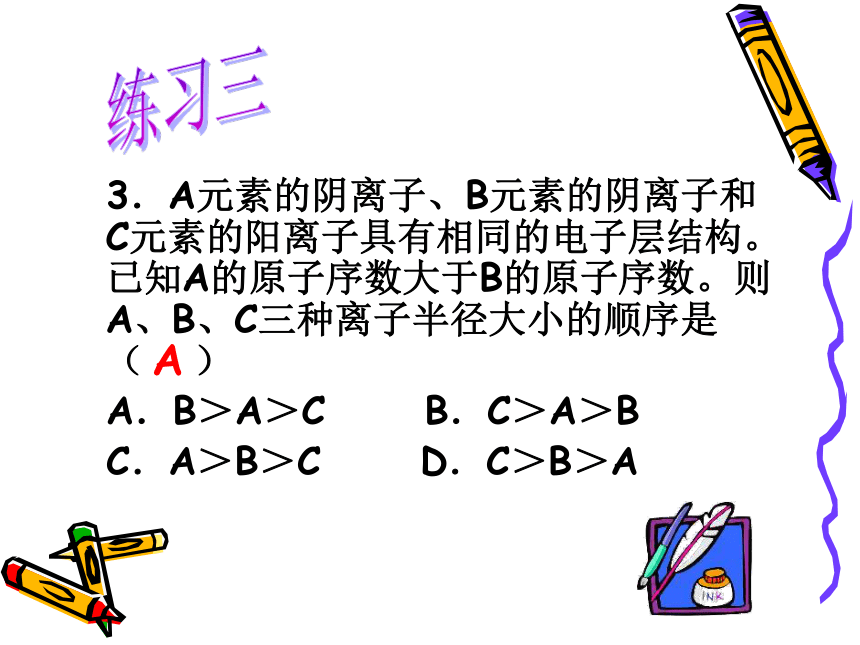
H2SO4HCl > H2S >PH3 3.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种离子半径大小的顺序是 ( )
A.B>A>C B.C>A>B
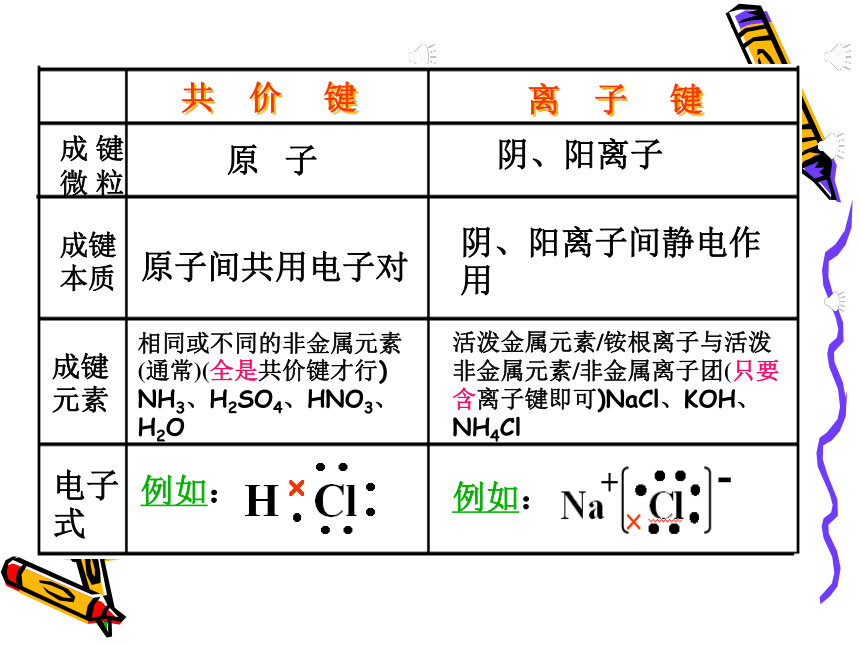
C.A>B>C D.C>B>A练习三A 微粒半径比较:1. 原子半径与离子半径关系: ①原子半径<相应的阴离子半径 如: Cl->Cl ②原子半径>相应的阳离子半径 如: Na>Na+ 2.比较离子之间半径大小的依据: ①同种元素的不同电荷数的离子,带正电荷多的半 径 如:Fe2+>Fe3+ ②不同元素比较:电子层数相同,核电荷数越大半 径越小。 如: S2- > Cl- > Ar > K+ > Ca2+ 4.最活泼的非金属元素位于周期表中第_____周期第 族。某元素A含有8个质子、10个中子,A的元素符号是_____。2VIIA188O练习四第二单元. 微粒之间的相互作用力化学键分子间作用力离子键共价键共 价 键离 子 键 成 键微 粒成键元素电子式 原 子阴、阳离子原子间共用电子对阴、阳离子间静电作用活泼金属元素/铵根离子与活泼非金属元素/非金属离子团(只要含离子键即可)NaCl、KOH、NH4Cl
成键本质相同或不同的非金属元素(通常)(全是共价键才行)
NH3、H2SO4、HNO3、H2O例如:例如:AB型AB2型、A2B型
(1)单个离子写在中间
(2)阴阳离子相间写, 相同的离子不得合并离子化合物电子式共价化合物的电子式1、共价分子的电子式不标电荷
2、原子最外层电子达到饱和
如:HCl分子共价分子的结构式:
原子间用一条短线表示一对共用电子对所得到的式子称为结构式。
如:HCl分子H—Cl 写出下列物质的电子式
(1)H2O (2) CO2
(3)Mg(OH)2 (4) NH4Cl练一练:1.含有离子键的化合物一定是离子化合物
2.含有共价键的化合物不一定就是共价化合物
3.离子化合物中可以含有共价键,但共价化合物中却不能含有离子键
注意:化学键与分子间作用力的比较原子间
离子间
强烈化学性质分子间较弱物理性质练习五5、物质在下列变化过程中克服的是:①分子间作用力 ②共价键 ③离子键。(填序号)
(1)冰融化 ,
(2)液溴挥发 ,
(3)电解熔融NaCl制Na ,
(4)H2S分解生成S和H2 ,
(5)碘升华 。
①①③②①第三单元. 从微观结构看物质的多样性比较同分异构体、同素异形体、同位素分子式相同,结
构不同的化合物
同一种元素能够
形成不同单质
质子数相同,中子数不同的原子单 质化合物 原子正丁烷和异丁烷O2和O3H和D、12C和14C1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:阴、阳离子分子原子金属阳离子和自由电子离子键分子间
作用力共价键金属键差距大大小较大较大小高差距大导电不导电溶液有些导电熔融或溶液导电
原子晶体 > 离子晶体 > 分子晶体四种晶体的区别离子晶体:大部分盐,强碱,活泼金属氧化物
分子晶体:绝大多数非金属单质,非金属氧化 物,含氧酸,气态氢化物,大部分有机物
原子晶体:金刚石,晶体硅,二氧化硅
金属晶体:大多数金属晶体的分类:短周期元素A、B、C,原子A最外层电子数是次外层的2倍,B的阴离子与C的阳离子电子层结构与氖相同。常温下,B2是气体,与氢气的相对分子质量比为16 :1。C的单质在B2中燃烧,生成淡黄色固体F。A、B可形成AB2型化合物求:
A、B两种元素的同素异形体分别有 A: 。 B: 。
F属于 化合物 晶体,AB2属于 化合物 晶体。
金刚石、石墨等O2、O3离子离子共价分子晶体练习六 完成作业本专题1复习题和检测题的选择题部分。(星期五早上上交!)作业:同学们,再见!!!
①酸性:HClO4>HBrO4>HIO4 ②碱性:KOH>Ca(OH)2>Mg(OH)2
③稳定性:HCl>H2S>PH3
A.①② B.②③ C.①③ D.都正确练习一D练习二2、右图为周期表的一小部分,A、B、C、D、E的位置关系,如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
(1)A的元素符号是______,位于第______周期,第_____族。
(2)B最高氧化物对应水化物是__________________, B、D、 E的气态氢化物稳定性由强到弱的顺序是__ O2ⅥA
H2SO4HCl > H2S >PH3 3.A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则A、B、C三种离子半径大小的顺序是 ( )
A.B>A>C B.C>A>B
C.A>B>C D.C>B>A练习三A 微粒半径比较:1. 原子半径与离子半径关系: ①原子半径<相应的阴离子半径 如: Cl->Cl ②原子半径>相应的阳离子半径 如: Na>Na+ 2.比较离子之间半径大小的依据: ①同种元素的不同电荷数的离子,带正电荷多的半 径 如:Fe2+>Fe3+ ②不同元素比较:电子层数相同,核电荷数越大半 径越小。 如: S2- > Cl- > Ar > K+ > Ca2+ 4.最活泼的非金属元素位于周期表中第_____周期第 族。某元素A含有8个质子、10个中子,A的元素符号是_____。2VIIA188O练习四第二单元. 微粒之间的相互作用力化学键分子间作用力离子键共价键共 价 键离 子 键 成 键微 粒成键元素电子式 原 子阴、阳离子原子间共用电子对阴、阳离子间静电作用活泼金属元素/铵根离子与活泼非金属元素/非金属离子团(只要含离子键即可)NaCl、KOH、NH4Cl
成键本质相同或不同的非金属元素(通常)(全是共价键才行)
NH3、H2SO4、HNO3、H2O例如:例如:AB型AB2型、A2B型
(1)单个离子写在中间
(2)阴阳离子相间写, 相同的离子不得合并离子化合物电子式共价化合物的电子式1、共价分子的电子式不标电荷
2、原子最外层电子达到饱和
如:HCl分子共价分子的结构式:
原子间用一条短线表示一对共用电子对所得到的式子称为结构式。
如:HCl分子H—Cl 写出下列物质的电子式
(1)H2O (2) CO2
(3)Mg(OH)2 (4) NH4Cl练一练:1.含有离子键的化合物一定是离子化合物
2.含有共价键的化合物不一定就是共价化合物
3.离子化合物中可以含有共价键,但共价化合物中却不能含有离子键
注意:化学键与分子间作用力的比较原子间
离子间
强烈化学性质分子间较弱物理性质练习五5、物质在下列变化过程中克服的是:①分子间作用力 ②共价键 ③离子键。(填序号)
(1)冰融化 ,
(2)液溴挥发 ,
(3)电解熔融NaCl制Na ,
(4)H2S分解生成S和H2 ,
(5)碘升华 。
①①③②①第三单元. 从微观结构看物质的多样性比较同分异构体、同素异形体、同位素分子式相同,结
构不同的化合物
同一种元素能够
形成不同单质
质子数相同,中子数不同的原子单 质化合物 原子正丁烷和异丁烷O2和O3H和D、12C和14C1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:阴、阳离子分子原子金属阳离子和自由电子离子键分子间
作用力共价键金属键差距大大小较大较大小高差距大导电不导电溶液有些导电熔融或溶液导电
原子晶体 > 离子晶体 > 分子晶体四种晶体的区别离子晶体:大部分盐,强碱,活泼金属氧化物
分子晶体:绝大多数非金属单质,非金属氧化 物,含氧酸,气态氢化物,大部分有机物
原子晶体:金刚石,晶体硅,二氧化硅
金属晶体:大多数金属晶体的分类:短周期元素A、B、C,原子A最外层电子数是次外层的2倍,B的阴离子与C的阳离子电子层结构与氖相同。常温下,B2是气体,与氢气的相对分子质量比为16 :1。C的单质在B2中燃烧,生成淡黄色固体F。A、B可形成AB2型化合物求:
A、B两种元素的同素异形体分别有 A: 。 B: 。
F属于 化合物 晶体,AB2属于 化合物 晶体。
金刚石、石墨等O2、O3离子离子共价分子晶体练习六 完成作业本专题1复习题和检测题的选择题部分。(星期五早上上交!)作业:同学们,再见!!!
