2009年中考化学热点专题全掌握:化学基本概念和原理(一)
文档属性
| 名称 | 2009年中考化学热点专题全掌握:化学基本概念和原理(一) |  | |
| 格式 | rar | ||
| 文件大小 | 60.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-12 20:26:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
专题复习一化学基本概念和原理(一)
一. 内容:
化学基本概念和原理
二. 重点、难点:
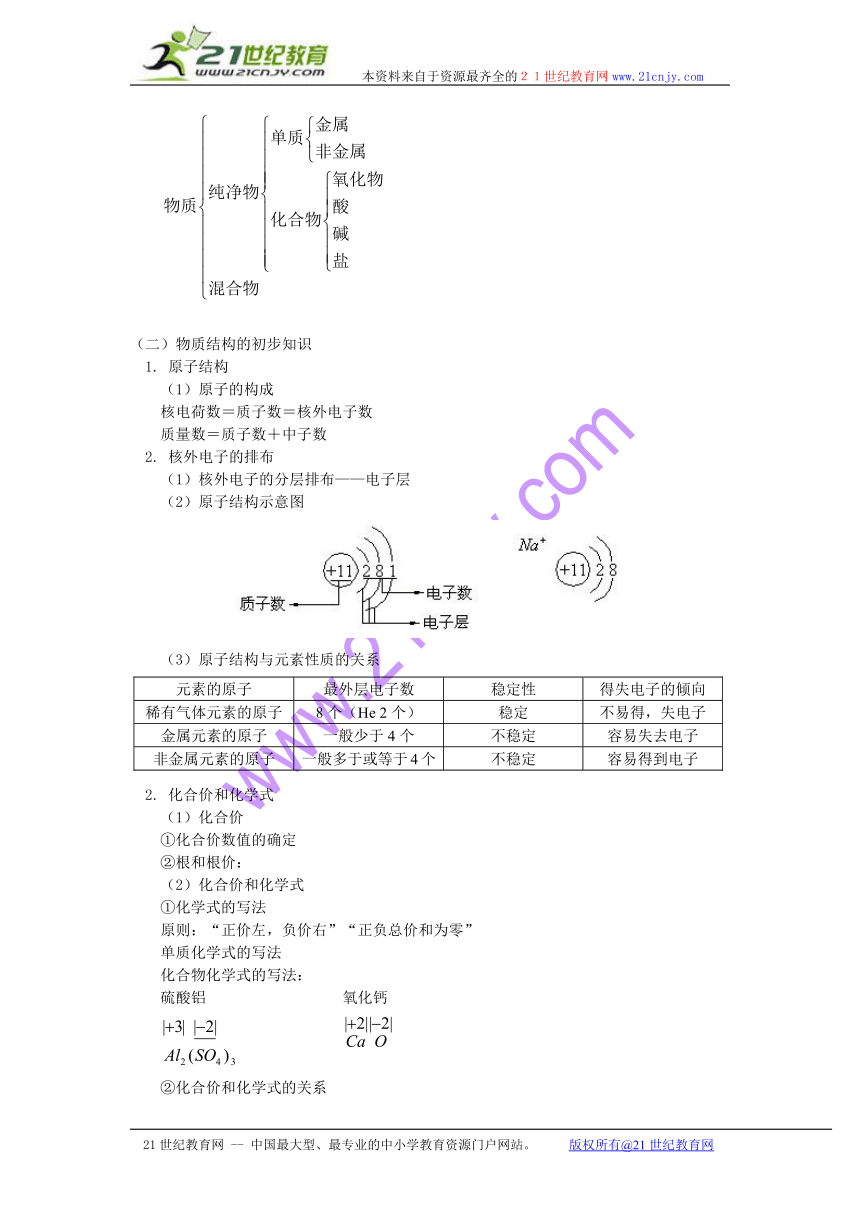
(一)物质的组成和分类
1. 分子、原子、离子
(1)分子
(2)原子
(3)离子
2. 元素
(1)定义
(2)O、Si、Al、Fe
(3)元素和原子的区别与联系
区别和联系 元素 原子
定义 具有相同核电荷数(即质子数)的一类原子的总称。 化学变化中的最小粒子。
涵义 只表示种类,不表示个数,是没有数量意义的概念。 既表示种类,又表示个数,有数量意义的概念,有一定的大小和质量。
适用范围 表示物质的宏观组成。 表示物质的微观构成。
联系 元素是具有相同核电荷数的一类原子的总称。原子则是个体,是体现元素性质的最小粒子。
(4)元素符号、化学式
①元素符号:
②化学式:
a. 表示物质及其组成
b. 表示物质的一个分子
c. 表示一个分子里各元素的原子个数
d. 表示组成物质的各元素质量比
e. 表示物质的相对分子质量
(5)相对原子质量,相对分子质量
3. 物质的简单分类
(二)物质结构的初步知识
1. 原子结构
(1)原子的构成
核电荷数=质子数=核外电子数
质量数=质子数+中子数
2. 核外电子的排布
(1)核外电子的分层排布——电子层
(2)原子结构示意图
(3)原子结构与元素性质的关系
元素的原子 最外层电子数 稳定性 得失电子的倾向
稀有气体元素的原子 8个(He 2个) 稳定 不易得,失电子
金属元素的原子 一般少于4个 不稳定 容易失去电子
非金属元素的原子 一般多于或等于4个 不稳定 容易得到电子
2. 化合价和化学式
(1)化合价
①化合价数值的确定
②根和根价:
(2)化合价和化学式
①化学式的写法
原则:“正价左,负价右”“正负总价和为零”
单质化学式的写法
化合物化学式的写法:
硫酸铝 氧化钙
②化合价和化学式的关系
【模拟试题】
相对原子质量:O—16,Cl—35.5,H—1
一. 我会选择(以下各题均有四个选项,只有一个选项符合题意)
1. 下列说法中,正确的是( )
A. 分子、原子、离子都是构成物质的粒子
B. 由同种元素组成的物质称为纯净物
C. 含有氧元素的化合物称为氧化物
D. 分子和原子在化学反应里都能生成新的分子和原子
2. 下列关于溶液的说法正确的是( )
A. 均一、稳定、透明的液体一定是溶液
B. 20℃时的溶解度是31.6g,是指在20℃时在100g溶液中含有31.6 g
C. 稀溶液可能是饱和溶液
D. 固体的溶解度都是随温度的升高而增大
3. 我国近年研制成功一种气体,这种气体的每个分子是由质子数为8,相对原子质量为18的两个原子构成。下列各说法错误的是( )
A. 这种气体的相对分子质量为36
B. 这种原子的核外不一定有8个电子
C. 这种气体中元素的化合价为0
D. 这种原子与氢原子能构成相对分子质量为20的水分子
4. 生活中处处有化学。请根据你所学的化学知识,判断下列说法错误的是( )
A. 医疗上常用体积分数为70%~75%的酒精溶液作消毒剂。
B. 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒。
C. 氯化钠是家庭常用的防腐剂,可用来腌制食品
D. 使用液化石油气可以杜绝厨房污染。
5. 对于化学反应的下列说法中,正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A是可溶性的碱,B是可溶性盐,则C和D不可能是两种沉淀
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
6. 影响固体物质在溶剂中溶解度大小的因素有( )
①固体物质的性质,②温度,③压强,④溶质的质量,⑤溶剂的质量,⑥溶剂的性质
A. ①②⑥ B. ①③⑤
C. ①④⑤ D. ②④⑥
7. 雷雨过后,空气特别清新,这是因为少量氧气在一定条件下能转化成臭氧(),反应方程式为:,下列说法:①该变化属于物理变化;②该变化属于化学变化;③与是同一种单质;④与是同一种元素组成的不同单质;⑤是混合物。
A. ②③ B. ①④ C. ①⑤ D. ②④
8. 下列对有关实验的叙述正确的是( )
A. 某固体加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸根离子
B. 某无色溶液中滴入酚酞试液显红色,该溶液一定是碱溶液
C. 将一杯接近饱和的石灰水降低温度,可变成饱和石灰水
D. 除去硝酸钾溶液中混有的少量硫酸铜时,先加适量的氢氧化钡溶液,然后过滤
9. 下列各组内物质能够在溶液中大量共存的是( )
A.
B.
C.
D.
10. 1999年诺贝尔化学奖授予开创“飞秒()化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是( )
A. 原子中原子核的内部结构
B. 化学反应中原子运动
C. 化学反应中生成物分子的形成
D. 化学反应中反应物分子的分解
11. 离子和离子的电子层结构相同,若X元素原子的核电荷数为n。则Y元素原子的原子核中质子数是( )
A. B.
C. D.
12. 将15克A物质、24克B物质、8克C物质混合加热,发生化学反应,经分析得知反应后的混合物中,含有A8克,C30克,还有一种物质D。若A、B、C、D的相对分子质量依次为28、32、44、18,则它们之间所发生的化学方程式为( )
A. B.
C. D.
13. 食盐在20℃时溶解度为36克,下列操作可以实现目的的是( )
A. 将100克15%的食盐溶液蒸发掉50克水,使溶液中食盐的质量分数达到30%
B. 向50克5%的食盐溶液中加入5克食盐,使溶液中食盐的质量分数达到10%
C. 向100克15%的食盐溶液中加入10克食盐,使溶液中食盐的质量分数达到25%
D. 将50克5%的食盐溶液蒸发掉25克水,使溶液中食盐的质量分数达到10%
14. 有A、B、C三种金属,将B、C浸入盐酸中,B溶解而C不溶解;若将C浸入A的硝酸盐溶液中,其表面上有A析出,则此三种金属活动性顺序为( )
A. B.
C. D.
15. 要使和中含有相同质量的氧元素,则和中含有相同质量的氧元素,则和的质量比是( )
A. 2:1 B. 1:2 C. 11:14 D. 11:7
16. 在和的混合物中,已知硫元素的质量分数为23%,则铁元素的质量分数为( )
A. 28% B. 31% C. 36.8% D. 无法计算
二. 我会多选:(每题各有一个或两个正确答案)
17. 将下列各组物质的溶液混合后(其中酸过量),仍有沉淀生成的是( )
A.
B.
C.
D.
18. 下列反应中能生成水的有( )
①化合反应 ②分解反应 ③置换反应 ④复分解反应
A. ① B. ①② C. ①②③ D. ①②③④
19. 下列转化能一步完成的是( )
① ②
③ ④
A. ①④ B. ②③ C. ③④ D. ④
20. 一定质量的某有机物在空气中完全燃烧时,生成8.8克二氧化碳和5.4克水,则该有机物可能是( )
A. B.
C. D.
21. 如下图所示,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两个球分别浸入有稀硫酸和硫酸铜溶液中片刻,下列说法中正确的是( )
A. 只有左边的烧杯中溶液的质量增加
B. 只有右边的烧杯中溶液的质量增加
C. 两个烧杯中溶液的质量都增加
D. 取掉烧杯后,杠杆仍然保持平衡
三. 我会填空:
22. 以前实验室用氯酸钾和二氧化锰混合加热制取氧气,反应物中若混有少量有机物杂质可能会发生危险。若用过氧化氢的水溶液和二氧化锰,可在常温下制取氧气,请回答:
(1)上述两个反应的反应类型都属于( )反应,收集氧气最好的方法是( )。
(2)过氧化氢中氢元素和氧元素的质量比为( )。
(3)用过氧化氢和二氧化锰制取氧气与用氯酸钾和二氧化锰在加热下制取氧气相比,其主要优点是( )。
23. 1806年,英国化学家戴维用电解法从苏打中得到一种新的金属,他对新金属做了如下实验:取一块金属,用小刀切下一小块,把一小块金属投入水中,它浮在水面上急速转动,发出嘶嘶声,并立刻熔化为一个闪亮的银白色小球,过一会儿小球逐渐变小,最后完全消失。请你归纳出这种金属的物理性质、化学性质。
24. 沿海某化工厂利用海水(含有氯化镁)和海边盛产的贝壳(主要成分是碳酸钙)为原料制取氯化镁。生产过程大致为:将海水引入蓄水池,取适量贝壳灼烧后的固体加入水池中,充分反应生成难溶于水的氢氧化镁,经过滤、洗涤、将沉淀与盐酸充分反应后,把得到的溶液加热蒸发,即可得到氯化镁。请按要求写出上述过程中有关的化学方程式。
四. 我会回答:
1. 曾报道:可以将水变成油。请你根据化学反应的实质,论证此说法为伪科学。
2. 请你用分子、原子的观点来描述电解水的过程。
3. 3克碳与10克氧气完全反应可生成13克二氧化碳,此话对吗?
4. “将30克水的某种物质放入100克水中,经搅拌完全溶解了,则该物质的溶解度为30克”这种说法对不对?请简要说明理由。
试题答案
一. 我会选择。
1. A 2. C 3. B 4. D 5. B 6. A 7. D 8. D
9. D 10. A 11. D 12. D 13. D 14. A 15. C 16. B
二. 我会多选。
17. BC 18. D 19. A 20. BD 21. B
三. 我会填空。
22. (1)分解;排水集气法
(2)1:16
(3)节能、安全
23. 物理性质:质软、密度比水小、熔点低、银白色固体
化学性质:与水反应生成气体
24.
四. 我会回答。
1. 答:水是由氢、氧元素组成的,没有碳元素,而油中必含有碳元素,所以水变不成油。
2. 答:,水是由许多水分子构成的,当通电时,每个水分子化分成两个氢原子和一个氧原子,每两个氢原子重新组合成一个氢分子,每两个氧原子组合成氧分子,许多氢分子构成氢气,许多氧分子构成氧气。
3. 不对,根据化学方程式计算
3克碳应与8g氧气恰好完全反应生成11g二氧化碳
4. 不对。因为没有说明温度和是否达饱和状态。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
专题复习一化学基本概念和原理(一)
一. 内容:
化学基本概念和原理
二. 重点、难点:
(一)物质的组成和分类
1. 分子、原子、离子
(1)分子
(2)原子
(3)离子
2. 元素
(1)定义
(2)O、Si、Al、Fe
(3)元素和原子的区别与联系
区别和联系 元素 原子
定义 具有相同核电荷数(即质子数)的一类原子的总称。 化学变化中的最小粒子。
涵义 只表示种类,不表示个数,是没有数量意义的概念。 既表示种类,又表示个数,有数量意义的概念,有一定的大小和质量。
适用范围 表示物质的宏观组成。 表示物质的微观构成。
联系 元素是具有相同核电荷数的一类原子的总称。原子则是个体,是体现元素性质的最小粒子。
(4)元素符号、化学式
①元素符号:
②化学式:
a. 表示物质及其组成
b. 表示物质的一个分子
c. 表示一个分子里各元素的原子个数
d. 表示组成物质的各元素质量比
e. 表示物质的相对分子质量
(5)相对原子质量,相对分子质量
3. 物质的简单分类
(二)物质结构的初步知识
1. 原子结构
(1)原子的构成
核电荷数=质子数=核外电子数
质量数=质子数+中子数
2. 核外电子的排布
(1)核外电子的分层排布——电子层
(2)原子结构示意图
(3)原子结构与元素性质的关系
元素的原子 最外层电子数 稳定性 得失电子的倾向
稀有气体元素的原子 8个(He 2个) 稳定 不易得,失电子
金属元素的原子 一般少于4个 不稳定 容易失去电子
非金属元素的原子 一般多于或等于4个 不稳定 容易得到电子
2. 化合价和化学式
(1)化合价
①化合价数值的确定
②根和根价:
(2)化合价和化学式
①化学式的写法
原则:“正价左,负价右”“正负总价和为零”
单质化学式的写法
化合物化学式的写法:
硫酸铝 氧化钙
②化合价和化学式的关系
【模拟试题】
相对原子质量:O—16,Cl—35.5,H—1
一. 我会选择(以下各题均有四个选项,只有一个选项符合题意)
1. 下列说法中,正确的是( )
A. 分子、原子、离子都是构成物质的粒子
B. 由同种元素组成的物质称为纯净物
C. 含有氧元素的化合物称为氧化物
D. 分子和原子在化学反应里都能生成新的分子和原子
2. 下列关于溶液的说法正确的是( )
A. 均一、稳定、透明的液体一定是溶液
B. 20℃时的溶解度是31.6g,是指在20℃时在100g溶液中含有31.6 g
C. 稀溶液可能是饱和溶液
D. 固体的溶解度都是随温度的升高而增大
3. 我国近年研制成功一种气体,这种气体的每个分子是由质子数为8,相对原子质量为18的两个原子构成。下列各说法错误的是( )
A. 这种气体的相对分子质量为36
B. 这种原子的核外不一定有8个电子
C. 这种气体中元素的化合价为0
D. 这种原子与氢原子能构成相对分子质量为20的水分子
4. 生活中处处有化学。请根据你所学的化学知识,判断下列说法错误的是( )
A. 医疗上常用体积分数为70%~75%的酒精溶液作消毒剂。
B. 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒。
C. 氯化钠是家庭常用的防腐剂,可用来腌制食品
D. 使用液化石油气可以杜绝厨房污染。
5. 对于化学反应的下列说法中,正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A是可溶性的碱,B是可溶性盐,则C和D不可能是两种沉淀
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
6. 影响固体物质在溶剂中溶解度大小的因素有( )
①固体物质的性质,②温度,③压强,④溶质的质量,⑤溶剂的质量,⑥溶剂的性质
A. ①②⑥ B. ①③⑤
C. ①④⑤ D. ②④⑥
7. 雷雨过后,空气特别清新,这是因为少量氧气在一定条件下能转化成臭氧(),反应方程式为:,下列说法:①该变化属于物理变化;②该变化属于化学变化;③与是同一种单质;④与是同一种元素组成的不同单质;⑤是混合物。
A. ②③ B. ①④ C. ①⑤ D. ②④
8. 下列对有关实验的叙述正确的是( )
A. 某固体加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸根离子
B. 某无色溶液中滴入酚酞试液显红色,该溶液一定是碱溶液
C. 将一杯接近饱和的石灰水降低温度,可变成饱和石灰水
D. 除去硝酸钾溶液中混有的少量硫酸铜时,先加适量的氢氧化钡溶液,然后过滤
9. 下列各组内物质能够在溶液中大量共存的是( )
A.
B.
C.
D.
10. 1999年诺贝尔化学奖授予开创“飞秒()化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是( )
A. 原子中原子核的内部结构
B. 化学反应中原子运动
C. 化学反应中生成物分子的形成
D. 化学反应中反应物分子的分解
11. 离子和离子的电子层结构相同,若X元素原子的核电荷数为n。则Y元素原子的原子核中质子数是( )
A. B.
C. D.
12. 将15克A物质、24克B物质、8克C物质混合加热,发生化学反应,经分析得知反应后的混合物中,含有A8克,C30克,还有一种物质D。若A、B、C、D的相对分子质量依次为28、32、44、18,则它们之间所发生的化学方程式为( )
A. B.
C. D.
13. 食盐在20℃时溶解度为36克,下列操作可以实现目的的是( )
A. 将100克15%的食盐溶液蒸发掉50克水,使溶液中食盐的质量分数达到30%
B. 向50克5%的食盐溶液中加入5克食盐,使溶液中食盐的质量分数达到10%
C. 向100克15%的食盐溶液中加入10克食盐,使溶液中食盐的质量分数达到25%
D. 将50克5%的食盐溶液蒸发掉25克水,使溶液中食盐的质量分数达到10%
14. 有A、B、C三种金属,将B、C浸入盐酸中,B溶解而C不溶解;若将C浸入A的硝酸盐溶液中,其表面上有A析出,则此三种金属活动性顺序为( )
A. B.
C. D.
15. 要使和中含有相同质量的氧元素,则和中含有相同质量的氧元素,则和的质量比是( )
A. 2:1 B. 1:2 C. 11:14 D. 11:7
16. 在和的混合物中,已知硫元素的质量分数为23%,则铁元素的质量分数为( )
A. 28% B. 31% C. 36.8% D. 无法计算
二. 我会多选:(每题各有一个或两个正确答案)
17. 将下列各组物质的溶液混合后(其中酸过量),仍有沉淀生成的是( )
A.
B.
C.
D.
18. 下列反应中能生成水的有( )
①化合反应 ②分解反应 ③置换反应 ④复分解反应
A. ① B. ①② C. ①②③ D. ①②③④
19. 下列转化能一步完成的是( )
① ②
③ ④
A. ①④ B. ②③ C. ③④ D. ④
20. 一定质量的某有机物在空气中完全燃烧时,生成8.8克二氧化碳和5.4克水,则该有机物可能是( )
A. B.
C. D.
21. 如下图所示,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡。然后将两个球分别浸入有稀硫酸和硫酸铜溶液中片刻,下列说法中正确的是( )
A. 只有左边的烧杯中溶液的质量增加
B. 只有右边的烧杯中溶液的质量增加
C. 两个烧杯中溶液的质量都增加
D. 取掉烧杯后,杠杆仍然保持平衡
三. 我会填空:
22. 以前实验室用氯酸钾和二氧化锰混合加热制取氧气,反应物中若混有少量有机物杂质可能会发生危险。若用过氧化氢的水溶液和二氧化锰,可在常温下制取氧气,请回答:
(1)上述两个反应的反应类型都属于( )反应,收集氧气最好的方法是( )。
(2)过氧化氢中氢元素和氧元素的质量比为( )。
(3)用过氧化氢和二氧化锰制取氧气与用氯酸钾和二氧化锰在加热下制取氧气相比,其主要优点是( )。
23. 1806年,英国化学家戴维用电解法从苏打中得到一种新的金属,他对新金属做了如下实验:取一块金属,用小刀切下一小块,把一小块金属投入水中,它浮在水面上急速转动,发出嘶嘶声,并立刻熔化为一个闪亮的银白色小球,过一会儿小球逐渐变小,最后完全消失。请你归纳出这种金属的物理性质、化学性质。
24. 沿海某化工厂利用海水(含有氯化镁)和海边盛产的贝壳(主要成分是碳酸钙)为原料制取氯化镁。生产过程大致为:将海水引入蓄水池,取适量贝壳灼烧后的固体加入水池中,充分反应生成难溶于水的氢氧化镁,经过滤、洗涤、将沉淀与盐酸充分反应后,把得到的溶液加热蒸发,即可得到氯化镁。请按要求写出上述过程中有关的化学方程式。
四. 我会回答:
1. 曾报道:可以将水变成油。请你根据化学反应的实质,论证此说法为伪科学。
2. 请你用分子、原子的观点来描述电解水的过程。
3. 3克碳与10克氧气完全反应可生成13克二氧化碳,此话对吗?
4. “将30克水的某种物质放入100克水中,经搅拌完全溶解了,则该物质的溶解度为30克”这种说法对不对?请简要说明理由。
试题答案
一. 我会选择。
1. A 2. C 3. B 4. D 5. B 6. A 7. D 8. D
9. D 10. A 11. D 12. D 13. D 14. A 15. C 16. B
二. 我会多选。
17. BC 18. D 19. A 20. BD 21. B
三. 我会填空。
22. (1)分解;排水集气法
(2)1:16
(3)节能、安全
23. 物理性质:质软、密度比水小、熔点低、银白色固体
化学性质:与水反应生成气体
24.
四. 我会回答。
1. 答:水是由氢、氧元素组成的,没有碳元素,而油中必含有碳元素,所以水变不成油。
2. 答:,水是由许多水分子构成的,当通电时,每个水分子化分成两个氢原子和一个氧原子,每两个氢原子重新组合成一个氢分子,每两个氧原子组合成氧分子,许多氢分子构成氢气,许多氧分子构成氧气。
3. 不对,根据化学方程式计算
3克碳应与8g氧气恰好完全反应生成11g二氧化碳
4. 不对。因为没有说明温度和是否达饱和状态。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
