2009年中考化学热点专题全掌握:物质构成的奥秘
文档属性
| 名称 | 2009年中考化学热点专题全掌握:物质构成的奥秘 | 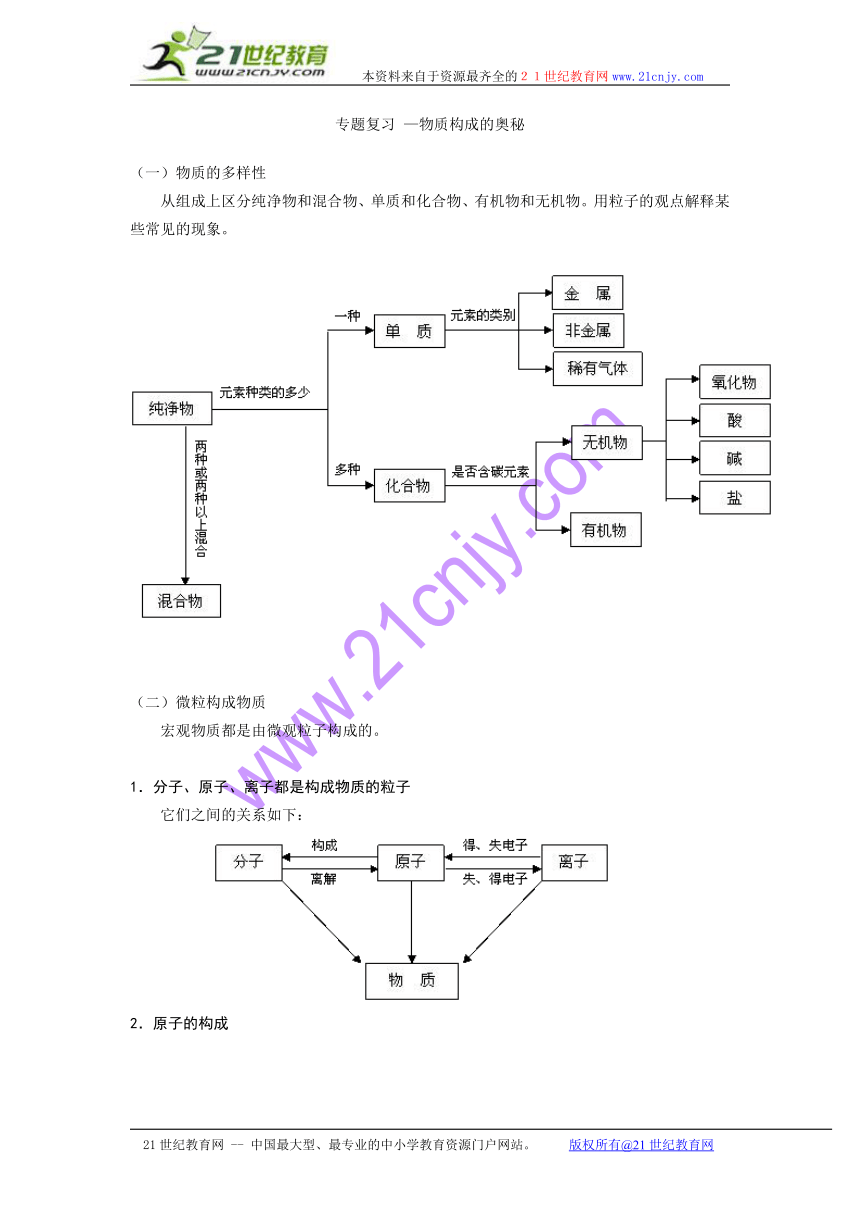 | |
| 格式 | rar | ||
| 文件大小 | 53.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-12 20:27:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
专题复习 —物质构成的奥秘
(一)物质的多样性
从组成上区分纯净物和混合物、单质和化合物、有机物和无机物。用粒子的观点解释某些常见的现象。
(二)微粒构成物质
宏观物质都是由微观粒子构成的。
1.分子、原子、离子都是构成物质的粒子
它们之间的关系如下:
2.原子的构成
(1)质子数=核电荷数=原子序数=核外电子数,原子不显电性。
(2)质子数+中子数=相对原子质量(数值),原子的质量主要集中在原子核上。
(3)不是所有原子的原子核都有中子。
(4)核外电子是分层排布的(认识原子结构示意图)。
3.分子和原子的本质区别
(1)分子的定义:分子是保持物质化学性质的最小粒子。
提示:分子在物理变化中不可分,分子间的距离可变化;分子在化学变化中可分,构成分子的原子可重新组合,构成新的分子。
原子的定义:原子是化学变化中的最小粒子。
提示:原子在化学变化中不可分,但原子可重新组合。
(2)认识分子的主要性质,并能用分子的性质解释一些基本问题。
a.分子的体积和质量都很小
b.分子总是在不停地运动
c.分子间有一定的间隔
d.分子在化学变化中可分
(三)化学元素
1.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
已经发现的元素有一百余种。地壳里和生命细胞中含量最多的元素是氧。地壳里含量较多的元素还有:硅、铝、铁、钙、钠、钾、镁等;生命细胞中含量较多的元素还有:碳、氢、氮、钙、磷等。
2.两个决定:
在原子结构中,核内质子数决定元素的种类;最外层电子数主要决定元素的化学性质。
3.元素的简单分类:金属元素、非金属元素和稀有气体元素。
元素的简单分类 最外层电子数 化学性质
金属元素 一般为1~3个 较易失电子形成阳离子
非金属元素 一般为5~7个 较易得电子形成阴离子
稀有气体元素 8个(氦为2个) 化学性质稳定
4.一些常见元素的名称和符号
5.提示:元素只论种类,不论个数。
(四)物质组成的表示
1.物质的构成
2.物质组成的表示
3.化学式:表示物质的组成。
纯净物的组成是固定不变的,一种物质只有一个化学式。
4.化学式与化合价的关系
根据化学式可以推算化合价,根据化合价可以书写化学式。
(1)在单质里,元素的化合价为零。
(2)在化合物里,正负化合价的代数和为零。
5.化学式的涵义(以H2O为例)
可以从宏观和微观来理解它的涵义。
宏观:(1)表示水这种物质。
(2)表示水是由氢元素和氧元素组成的。
(3)表示水中氢元素和氧元素的质量比为1∶8。
微观:(1)表示一个水分子。
(2)表示水是由大量的水分子构成的。
(3)表示一个水分子是由两个氢原子和一个氧原子构成的。
(五)溶液
1.溶液知识体系
2.几个概念
溶液:一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物叫做溶液。
溶剂:能溶解其他物质的物质叫溶剂。
溶质:被溶解的物质叫做溶质。
最常用的溶剂是水,汽油、乙醇等也可以做溶剂。如碘酒,碘是溶质,酒精是溶剂。溶质可以是固体,也可以是液体或气体。如果两种液体互相溶解时,一般把量多的一种叫做溶剂,量少的一种叫做溶质。如果其中有一种是水,一般把水叫做溶剂。
3.溶液的基本特征:均一性和稳定性。
4.溶液中,溶液质量=溶质质量+溶剂质量
5.溶解过程中的吸热、放热现象
在溶解过程中发生了两种变化,一种是溶质的分子(或离子)向水中扩散,这一过程吸收热量;另一种是溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),这一过程放出热量。
即:扩散──吸热; 水合──放热。
当Q吸>Q放:水溶液的温度降低,如NH4NO3溶于水时吸收热量;
当Q吸<Q放:水溶液的温度升高,如NaOH、浓硫酸等溶于水时放出热量;
当Q吸=Q放:水溶液的温度不变,如NaCl溶于水溶液的温度变化不大。
6.饱和溶液和不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做饱和溶液,还能继续溶解的溶液叫做不饱和溶液。
不饱和溶液与饱和溶液间的相互转化:
7.溶解度的概念
在一定温度下,某固态物质在100 g溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。
(1)“易溶”、“可溶”、“微溶”、“难溶”等表示的意思:
溶解度/g >10 1~10 0.01~1 <0.01
溶解性 易溶 可溶 微溶 难溶
(2)溶解度曲线
用纵坐标表示溶解度,横坐标表示温度,绘制出的溶解度随温度而变化的曲线叫做溶解度曲线。
溶解度曲线表示的有关信息:
①某物质在某温度时的溶解度;
②同一物质在不同温度时的溶解度是不同的;
③不同物质在同一温度时的溶解度可能不同;
④曲线的交点所表示某一温度下不同物质的溶解度相同。
⑤物质的溶解度受温度影响的变化;
……
(3)气体的溶解度
气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。一般情况下,气体的溶解度随外界压强的增大而增大;随温度的升高而降低。
气体溶解度在实际测定时比较复杂,非标准状况下的数据还应该换算成标准状况下的值。
8.溶质的质量分数
溶质质量=溶液质量×溶质的质量分数
溶剂质量=溶液质量-溶质质量
【典型例题】
1.以下物质属于纯净物的是( )
分析:本题考查物质的分类。A选项是自来水,属于混合物;B选项C70,一种碳的单质,故属于纯净物;C选项石灰石,是混合物,主要成分是碳酸钙。D选项石油是混合物。
答案:B
2.甲醛(化学式为CH2O)是一种对人体有毒害的物质,是室内装饰材料释放的主要污染物之一,也是一些不法分子为了增强食品耐煮、防腐等能力,不顾人们的身体健康而经常使用的一种添加剂和浸泡剂。国家为此对甲醛的使用进行了严格控制并严厉打击不法行为。下列关于甲醛的说法正确的是( )
A.甲醛是由碳、氢、氧三种元素组成的化合物
B.甲醛是由碳和水分子构成的物质
C.甲醛分子是由碳原子、氢分子、氧原子构成的物质
D.甲醛由1个碳元素、2个氢元素、1个氧元素组成物质
分析:本题考查物质组成的表示。甲醛的化学式为CH2O,故是由碳元素、氢元素和氧元素组成的化合物。甲醛是由大量的甲醛分子构成的,不存在氢分子或水分子;一个甲醛分子是由一个碳原子、两个氢原子和一个氧原子构成的。另外元素论种不论个,故B、C、D都是不正确的。
答案:A
3.a、b两物质的溶解度曲线如图1所示,请根据图回答:
(1)30℃时,a的溶解度是 g。
(2)a的溶解度小于b的溶解度的温度范围是 。
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的是 (不考虑溶剂的蒸发,析出的固体不含水)
A.a溶液中溶质质量增多,b溶液中溶质质量减少
B.a溶液中溶质质量分数小于b溶液中溶质质量分数
C.a溶液中溶剂质量小于b溶液中溶剂质量
D.试管底部a固体的质量小于b固体的质量
分析:本题考查溶解度及溶解度曲线的相关知识。从图1观察可得,a的溶解度在30℃时是40g,a的溶解度小于b的溶解度的温度范围是0℃≤t<20℃。
由于氢氧化钠固体溶于水是放热的,烧杯内的溶液温度升高,由于a的溶解度随着温度升高而升高,故a试管中的固体减少;由于b的溶解度随着温度的升高而减小,故b试管中有晶体析出。所以,a溶液中溶质质量增多,b溶液中溶质质量减少,但二者的溶液中溶剂的质量是不变的,始终保持相等。在20℃时等质量的a、b两物质的饱和溶液中溶质的质量分数相同,故加入氢氧化钠固体后,a溶液中溶质质量分数大于b溶液中溶质质量分数。
答案:
(1)40
(2)0℃≤t<20℃
(3)A D
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
专题复习 —物质构成的奥秘
(一)物质的多样性
从组成上区分纯净物和混合物、单质和化合物、有机物和无机物。用粒子的观点解释某些常见的现象。
(二)微粒构成物质
宏观物质都是由微观粒子构成的。
1.分子、原子、离子都是构成物质的粒子
它们之间的关系如下:
2.原子的构成
(1)质子数=核电荷数=原子序数=核外电子数,原子不显电性。
(2)质子数+中子数=相对原子质量(数值),原子的质量主要集中在原子核上。
(3)不是所有原子的原子核都有中子。
(4)核外电子是分层排布的(认识原子结构示意图)。
3.分子和原子的本质区别
(1)分子的定义:分子是保持物质化学性质的最小粒子。
提示:分子在物理变化中不可分,分子间的距离可变化;分子在化学变化中可分,构成分子的原子可重新组合,构成新的分子。
原子的定义:原子是化学变化中的最小粒子。
提示:原子在化学变化中不可分,但原子可重新组合。
(2)认识分子的主要性质,并能用分子的性质解释一些基本问题。
a.分子的体积和质量都很小
b.分子总是在不停地运动
c.分子间有一定的间隔
d.分子在化学变化中可分
(三)化学元素
1.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
已经发现的元素有一百余种。地壳里和生命细胞中含量最多的元素是氧。地壳里含量较多的元素还有:硅、铝、铁、钙、钠、钾、镁等;生命细胞中含量较多的元素还有:碳、氢、氮、钙、磷等。
2.两个决定:
在原子结构中,核内质子数决定元素的种类;最外层电子数主要决定元素的化学性质。
3.元素的简单分类:金属元素、非金属元素和稀有气体元素。
元素的简单分类 最外层电子数 化学性质
金属元素 一般为1~3个 较易失电子形成阳离子
非金属元素 一般为5~7个 较易得电子形成阴离子
稀有气体元素 8个(氦为2个) 化学性质稳定
4.一些常见元素的名称和符号
5.提示:元素只论种类,不论个数。
(四)物质组成的表示
1.物质的构成
2.物质组成的表示
3.化学式:表示物质的组成。
纯净物的组成是固定不变的,一种物质只有一个化学式。
4.化学式与化合价的关系
根据化学式可以推算化合价,根据化合价可以书写化学式。
(1)在单质里,元素的化合价为零。
(2)在化合物里,正负化合价的代数和为零。
5.化学式的涵义(以H2O为例)
可以从宏观和微观来理解它的涵义。
宏观:(1)表示水这种物质。
(2)表示水是由氢元素和氧元素组成的。
(3)表示水中氢元素和氧元素的质量比为1∶8。
微观:(1)表示一个水分子。
(2)表示水是由大量的水分子构成的。
(3)表示一个水分子是由两个氢原子和一个氧原子构成的。
(五)溶液
1.溶液知识体系
2.几个概念
溶液:一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物叫做溶液。
溶剂:能溶解其他物质的物质叫溶剂。
溶质:被溶解的物质叫做溶质。
最常用的溶剂是水,汽油、乙醇等也可以做溶剂。如碘酒,碘是溶质,酒精是溶剂。溶质可以是固体,也可以是液体或气体。如果两种液体互相溶解时,一般把量多的一种叫做溶剂,量少的一种叫做溶质。如果其中有一种是水,一般把水叫做溶剂。
3.溶液的基本特征:均一性和稳定性。
4.溶液中,溶液质量=溶质质量+溶剂质量
5.溶解过程中的吸热、放热现象
在溶解过程中发生了两种变化,一种是溶质的分子(或离子)向水中扩散,这一过程吸收热量;另一种是溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),这一过程放出热量。
即:扩散──吸热; 水合──放热。
当Q吸>Q放:水溶液的温度降低,如NH4NO3溶于水时吸收热量;
当Q吸<Q放:水溶液的温度升高,如NaOH、浓硫酸等溶于水时放出热量;
当Q吸=Q放:水溶液的温度不变,如NaCl溶于水溶液的温度变化不大。
6.饱和溶液和不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做饱和溶液,还能继续溶解的溶液叫做不饱和溶液。
不饱和溶液与饱和溶液间的相互转化:
7.溶解度的概念
在一定温度下,某固态物质在100 g溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。
(1)“易溶”、“可溶”、“微溶”、“难溶”等表示的意思:
溶解度/g >10 1~10 0.01~1 <0.01
溶解性 易溶 可溶 微溶 难溶
(2)溶解度曲线
用纵坐标表示溶解度,横坐标表示温度,绘制出的溶解度随温度而变化的曲线叫做溶解度曲线。
溶解度曲线表示的有关信息:
①某物质在某温度时的溶解度;
②同一物质在不同温度时的溶解度是不同的;
③不同物质在同一温度时的溶解度可能不同;
④曲线的交点所表示某一温度下不同物质的溶解度相同。
⑤物质的溶解度受温度影响的变化;
……
(3)气体的溶解度
气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。一般情况下,气体的溶解度随外界压强的增大而增大;随温度的升高而降低。
气体溶解度在实际测定时比较复杂,非标准状况下的数据还应该换算成标准状况下的值。
8.溶质的质量分数
溶质质量=溶液质量×溶质的质量分数
溶剂质量=溶液质量-溶质质量
【典型例题】
1.以下物质属于纯净物的是( )
分析:本题考查物质的分类。A选项是自来水,属于混合物;B选项C70,一种碳的单质,故属于纯净物;C选项石灰石,是混合物,主要成分是碳酸钙。D选项石油是混合物。
答案:B
2.甲醛(化学式为CH2O)是一种对人体有毒害的物质,是室内装饰材料释放的主要污染物之一,也是一些不法分子为了增强食品耐煮、防腐等能力,不顾人们的身体健康而经常使用的一种添加剂和浸泡剂。国家为此对甲醛的使用进行了严格控制并严厉打击不法行为。下列关于甲醛的说法正确的是( )
A.甲醛是由碳、氢、氧三种元素组成的化合物
B.甲醛是由碳和水分子构成的物质
C.甲醛分子是由碳原子、氢分子、氧原子构成的物质
D.甲醛由1个碳元素、2个氢元素、1个氧元素组成物质
分析:本题考查物质组成的表示。甲醛的化学式为CH2O,故是由碳元素、氢元素和氧元素组成的化合物。甲醛是由大量的甲醛分子构成的,不存在氢分子或水分子;一个甲醛分子是由一个碳原子、两个氢原子和一个氧原子构成的。另外元素论种不论个,故B、C、D都是不正确的。
答案:A
3.a、b两物质的溶解度曲线如图1所示,请根据图回答:
(1)30℃时,a的溶解度是 g。
(2)a的溶解度小于b的溶解度的温度范围是 。
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的是 (不考虑溶剂的蒸发,析出的固体不含水)
A.a溶液中溶质质量增多,b溶液中溶质质量减少
B.a溶液中溶质质量分数小于b溶液中溶质质量分数
C.a溶液中溶剂质量小于b溶液中溶剂质量
D.试管底部a固体的质量小于b固体的质量
分析:本题考查溶解度及溶解度曲线的相关知识。从图1观察可得,a的溶解度在30℃时是40g,a的溶解度小于b的溶解度的温度范围是0℃≤t<20℃。
由于氢氧化钠固体溶于水是放热的,烧杯内的溶液温度升高,由于a的溶解度随着温度升高而升高,故a试管中的固体减少;由于b的溶解度随着温度的升高而减小,故b试管中有晶体析出。所以,a溶液中溶质质量增多,b溶液中溶质质量减少,但二者的溶液中溶剂的质量是不变的,始终保持相等。在20℃时等质量的a、b两物质的饱和溶液中溶质的质量分数相同,故加入氢氧化钠固体后,a溶液中溶质质量分数大于b溶液中溶质质量分数。
答案:
(1)40
(2)0℃≤t<20℃
(3)A D
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
