2009年中考化学热点专题全掌握—分子和原子、元素、物质分类
文档属性
| 名称 | 2009年中考化学热点专题全掌握—分子和原子、元素、物质分类 |  | |
| 格式 | rar | ||
| 文件大小 | 62.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-12 20:27:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
专题复习—分子和原子、元素、物质分类
一. 内容
分子和原子、元素、物质分类
二. 重点、难点
1. 掌握分子、原子、元素等化学用语的概念及其异同点。
2. 了解物质的组成及分类的原则,从宏观、微观角度对物质组成进行描述。
3. 熟悉化学式的书写原则,熟练掌握有关化学式的写法及简单计算。
三. 知识要点
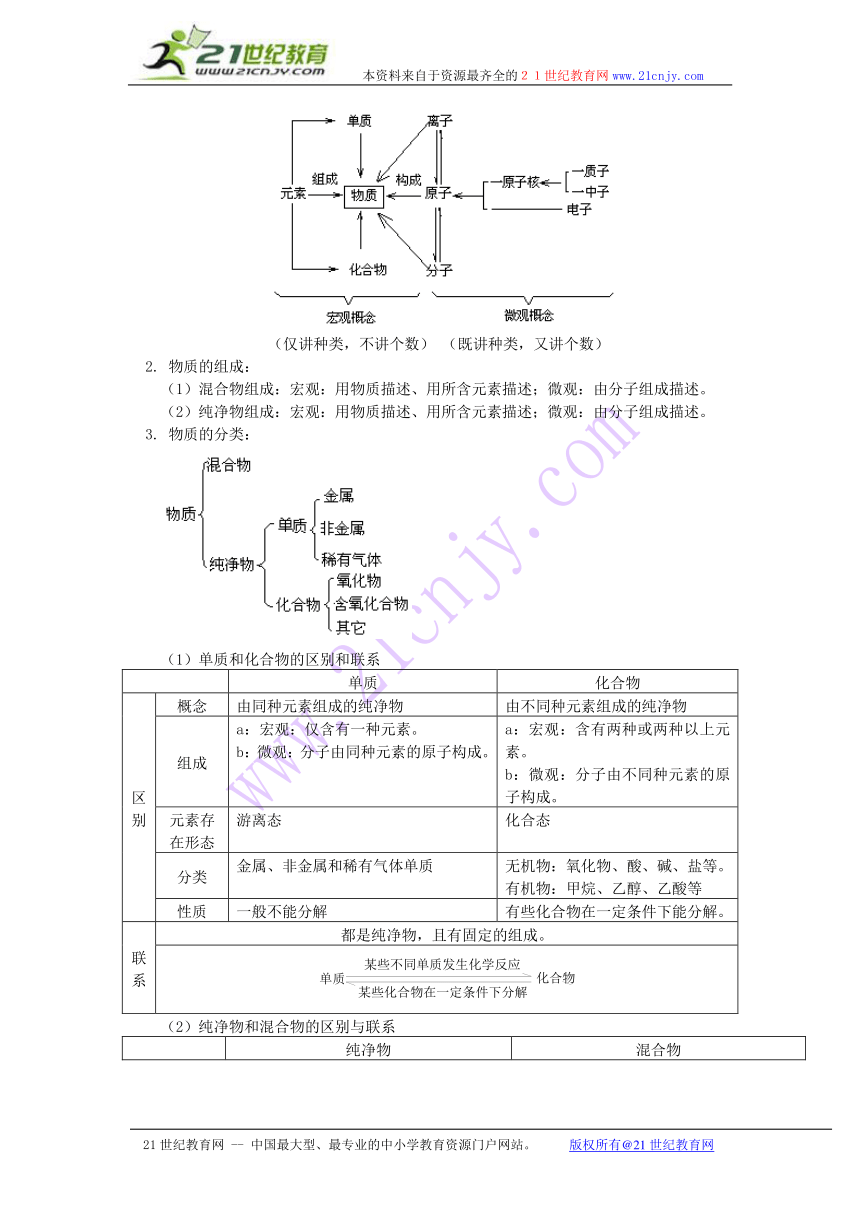
1. 物质的结构:
(1)原子
① 概念——原子是化学变化中的最小微粒。
② 结构
原子尽管很小,用化学方法不能再分,但用其它方法可以再分,因为原子也有一定的构成。
③ 各种关系
a. 核电荷数=核内质子数=核外电子数 所以整个原子不显电性
b. 质子数不一定等于中子数,它们之间没有必然联系
c. 某原子的相对原子质量
(2)分子
① 概念——分子是保持物质化学性质的最小粒子。
② 与原子的关系
(3)离子
① 概念——带电的原子或原子团。
② 与原子的关系
分子 原子 离子
区别 定义 保持物质化学性质的一种微粒 是化学变化中的最小微粒。 带电的原子或原子团。
化学变化中是否可分 在化学变化中可分,变化前后种类和数目可能发生变化。 在化学变化中不可分,变化前后种类和数目不发生变化。 在化学变化中,单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。
是否独立存在 能独立存在,构成物质并保持物质的化学性质不变 有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 阴、阳离子共同构成物质,形成离子化合物。
构成 由原子构成,且纯净物中仅含有一种分子。 一般由质子、中子和核外电子三种微粒构成。且: 由原子得失电子形成,原子得电子带负电荷成为阴离子,原子失电子带正电荷成为阳离子。
所带电性情况 不显电性 a:不显电性。 b:核电荷数 = 质子数 = 核外电子数 a:阴离子:核电荷数 = 质子数 < 核外电子数b:阳离子:核电荷数 = 质子数 > 核外电子数
表示方法 用化学式(分子式)表示 用元素符号表示。 分别以阴、阳离子符号表示。
联系 在化学反应中表现:
表达方法 均为微观粒子,既可讲个数,又可论种类。
性质 三种微粒都很小,一般用其相对质量表示质量;三种微粒都在不断地运动;且微粒间有间隙;三者皆为构成物质的一种微粒。
(4)元素
① 概念——具有相同核电荷数的同一类原子的总称。
② 在地壳中前五位的元素
③ 与原子的关系
元 素 原 子
不同点 概念 元素是具有相同核电荷数的同一类原子的总称。如氢原子(H)和氢离子(H+)都属于氢元素 原子是化学变化中的最小微粒
含义 元素只分种类,没有数量(个数)、大小和质量的含义 原子有种类之分,又有数量、大小、质量的含义
应用范围 元素在说明物质宏观组成时应用 原子是微观粒子,说明物质微观结构时应用
联系 具有相同核电荷数的同一类原子称为一种元素;原子是体现元素性质的最小微粒
(5)物质、元素、分子、原子的相互关系
(仅讲种类,不讲个数) (既讲种类,又讲个数)
2. 物质的组成:
(1)混合物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。
(2)纯净物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。
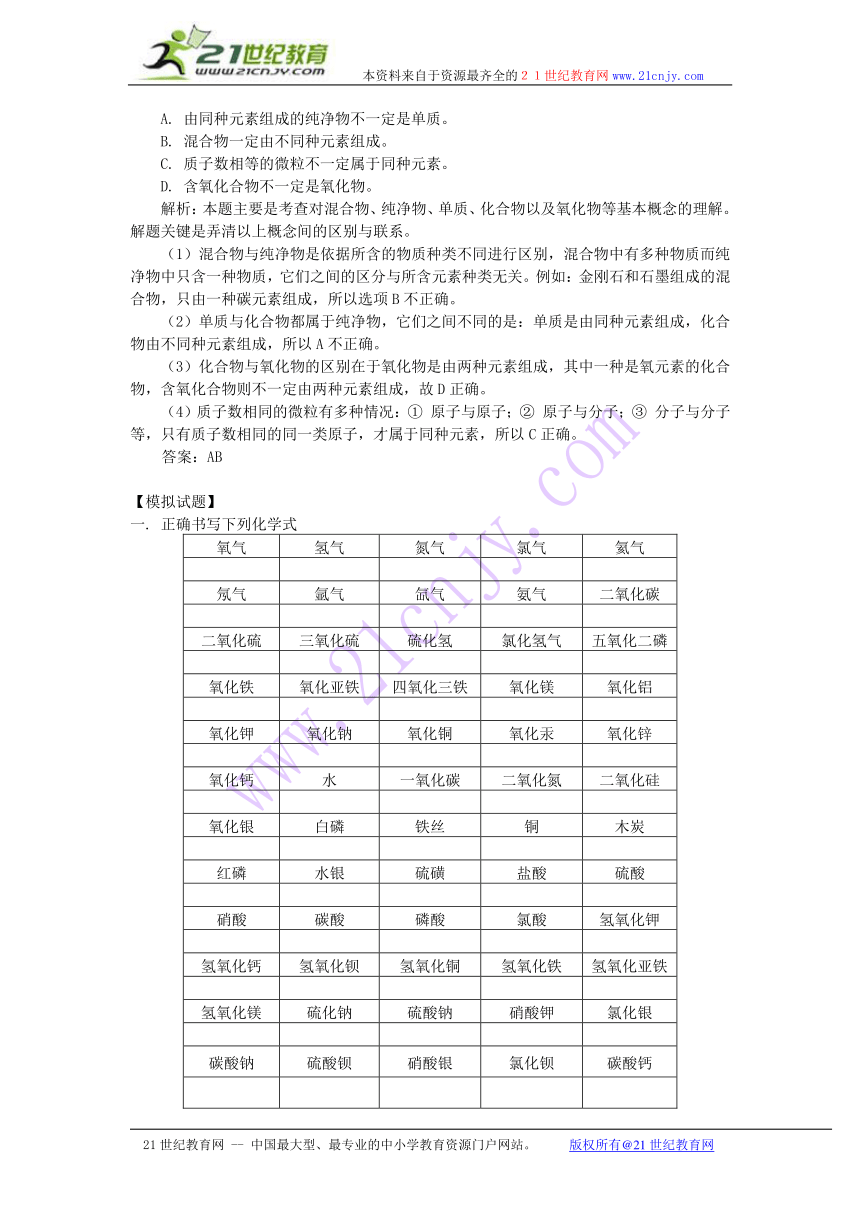
3. 物质的分类:
(1)单质和化合物的区别和联系
单质 化合物
区别 概念 由同种元素组成的纯净物 由不同种元素组成的纯净物
组成 a:宏观:仅含有一种元素。b:微观:分子由同种元素的原子构成。 a:宏观:含有两种或两种以上元素。b:微观:分子由不同种元素的原子构成。
元素存在形态 游离态 化合态
分类 金属、非金属和稀有气体单质 无机物:氧化物、酸、碱、盐等。有机物:甲烷、乙醇、乙酸等
性质 一般不能分解 有些化合物在一定条件下能分解。
联系 都是纯净物,且有固定的组成。
(2)纯净物和混合物的区别与联系
纯净物 混合物
区别 概念 由同一种物质组成 由两种或两种以上的物质组成,这些物质相互间没有发生化学反应,各自保持自己的性质。
组成 a:宏观:一种物质。b:微观:对由分子构成的物质而言,由一种分子构成。c:具有固定不变的组成。 a:宏观:两种或两种以上的物质。b:微观:由不同种分子构成。c:没有固定的组成。
性质 具有固定的性质。例如:固定的熔点、沸点等。 没有固定的性质。例如:没有固定的溶点、沸点等
联系
【典型例题】
[例1] 现有H、O、H+、O2-、H2、O2、OH-、H2O八种微粒,试用这些微粒的符号填写下列空白:
(1)能保持水的化学性质的微粒是 ;
(2)氢气和氧气化合生成水的过程中的最小微粒是 ;
(3)水变成水蒸气时 没有变化;
(4)电解水得到的产物是 ;
(5)没有电子的微粒是 ;
(6)质子数少于核外电子数的微粒是 ;
(7)电子数相同的微粒是 ;
解析:本题主要考查分子、原子和离子的概念以及对有关化学用语和原子结构等基本知识的理解程度。这就要求在学习中要注意结合一些具体物质将有关知识进行系统总结和分析,以解决各种复杂问题。各项解答分述如下:
(1)由于分子是保持物质化学性质的一种微粒,而水又是由水分子构成的,所以能保持水的化学性质的微粒是水分子(H2O);
(2)氢气和氧气化合时,氢分子与氧分子先各自分成氢原子(H)和氧原子(O),然后两种原子再重新组合生成水分子。因此,氢气与氧气化合时的最小微粒是氢原子和氧原子。
(3)水变成水蒸气只是水的状态改变,水的化学性质没变,因此,水分子本身没有变化;
(4)由电解水的实验可知:电解水的产物是氢气和氧气,而氢气和氧气分别由氢分子(H2)和氧分子(O2)构成;
(5)氢原子核外只有一个电子,失去后变成没有电子的氢离子(H+);
(6)由于质子带正电荷,电子带负电荷,所以,质子数小于电子数的微粒应带有负电荷,即O2-和OH-;
(7)经分析可知:OH-、H2O、O2-的电子数都是10个。
答案:
(1)H2O (2)H、O
(3)H2O (4)H2、O2
(5)H+ (6)O2-、OH-
(7)OH-、H2O、O2-
[例2] 下列说法中,不正确的是( )
A. 由同种元素组成的纯净物不一定是单质。
B. 混合物一定由不同种元素组成。
C. 质子数相等的微粒不一定属于同种元素。
D. 含氧化合物不一定是氧化物。
解析:本题主要是考查对混合物、纯净物、单质、化合物以及氧化物等基本概念的理解。解题关键是弄清以上概念间的区别与联系。
(1)混合物与纯净物是依据所含的物质种类不同进行区别,混合物中有多种物质而纯净物中只含一种物质,它们之间的区分与所含元素种类无关。例如:金刚石和石墨组成的混合物,只由一种碳元素组成,所以选项B不正确。
(2)单质与化合物都属于纯净物,它们之间不同的是:单质是由同种元素组成,化合物由不同种元素组成,所以A不正确。
(3)化合物与氧化物的区别在于氧化物是由两种元素组成,其中一种是氧元素的化合物,含氧化合物则不一定由两种元素组成,故D正确。
(4)质子数相同的微粒有多种情况:① 原子与原子;② 原子与分子;③ 分子与分子等,只有质子数相同的同一类原子,才属于同种元素,所以C正确。
答案:AB
【模拟试题】
一. 正确书写下列化学式
氧气 氢气 氮气 氯气 氦气
氖气 氩气 氙气 氨气 二氧化碳
二氧化硫 三氧化硫 硫化氢 氯化氢气 五氧化二磷
氧化铁 氧化亚铁 四氧化三铁 氧化镁 氧化铝
氧化钾 氧化钠 氧化铜 氧化汞 氧化锌
氧化钙 水 一氧化碳 二氧化氮 二氧化硅
氧化银 白磷 铁丝 铜 木炭
红磷 水银 硫磺 盐酸 硫酸
硝酸 碳酸 磷酸 氯酸 氢氧化钾
氢氧化钙 氢氧化钡 氢氧化铜 氢氧化铁 氢氧化亚铁
氢氧化镁 硫化钠 硫酸钠 硝酸钾 氯化银
碳酸钠 硫酸钡 硝酸银 氯化钡 碳酸钙
硝酸铵 碳酸氢铵 硫酸铵 氯化铵 硝酸钡
硝酸铜 硝酸锌 氯化铝 氯化亚铁 硫酸铝
碳酸亚铁 硫酸锌 硝酸镁 氯化钙 氨水
硫化镁 硝酸铁 硝酸亚铁 氯化铜 氯化亚铜
硫酸铁 硫酸亚铁 氢氧化铝 碳酸银 硝酸汞
氢氧化银 硫酸银 碳酸镁 碳酸铵 碳酸钡
磷酸钠 磷酸氢钠 磷酸二氢钠 磷酸钙 硫酸钙
氯酸钾 二氧化锰 高锰酸钾 锰酸钾 碱式碳酸铜
甲烷 乙炔 硫化铵 碳酸氢钠 胆矾(蓝矾)
甲醇 乙醇(酒精) 乙酸(醋酸) 纯 碱 小苏打
天然气(沼气) 煤 气 火 碱 食 盐 消(熟)石灰
生石灰 石灰石 碳 铵 干 冰 铁 锈
二. 选择题
1. 下列有关分子和原子的说法正确的是( )
A. 分子或原子都可以构成物质
B. 分子的体积比原子体积大
C. 分子可以再分而原子不能再分
D. 分子是保持物质性质的最小粒子
2. 单质不同于化合物,原因在于( )
A. 单质只由原子构成,化合物都由分子构成
B. 单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物
C. 单质能与另一单质发生化合反应,化合物则不能
D. 有些化合物能发生分解反应,单质不能发生分解反应
3. 下列说法中不正确的是( )
A. 原子在化学变化中不可分,分子在物理变化中不可分
B. 原子都是由原子核和电子构成的
C. 原子、分子都是构成物质的粒子
D. 原子核都是由质子和中子构成的
4. 互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”,这里的“铁”是指( )
A. 铁单质 B. 铁原子 C. 铁元素 D. 四氧化三铁
5. 自第十一届奥运会以来,历届奥运会开幕式都要举行颇为隆重的“火炬接力”,火炬的可燃物是丁烷(化学式C4H10),它燃烧时火苗高且亮,在白天,二百米以外也能清晰可见,下列关于丁烷的叙述正确的是( )
A. 每个丁烷分子由四个碳元素和十个氢元素组成
B. 丁烷由四个碳原子和十个氢原子组成
C. 丁烷由丁烷分子构成,丁烷分子是由碳、氢元素构成
D. 丁烷由碳、氢两种元素组成
6. m个CO2分子和m个SO2分子中,一样多的是( )
A. 氧元素 B. 氧分子数 C. 氧原子数 D. 氧元素的质量分数
7. 在符号2H、2SO3、2Ca、2H2O中,数字“2”表示的意义不尽相同,其中“2”的意义是用来表示分子个数的符号有( )
A. 1个 B. 2 C. 3个 D. 4个
8. 甲原子与乙原子的质量比为,而乙原子与碳12原子的质量比为,则甲原子的相对原子质量为( )
A. B. C. D.
9. 有一种氮的氧化物,氮和氧的质量比为7:4,则此氮的氧化物的化学式为( )
A. N2O B. NO2 C. N2O3 D. N2O5
10. 吸毒严重危害身心健康,一旦吸毒就很难戒除,所以其危害尤为严重。有一种称为“摇头丸”的毒品,已从国外流入我国某些省市,我国公安机关坚决予以查缉和打击。已知它的化学式为C9H13N,它的相对分子质量为( )
A. 121 B. 122 C. 130 D. 135
11. 同种元素组成的物质( )
A. 一定是单质 B. 一定是纯净物 C. 一定是混合物 D. 一定不是化合物
12. 在我们身边,下列各类物质存在最多的是( )
A. 纯净物 B. 混合物 C. 单质 D. 化合物
13. 下列物质① 空气;② MnO2;③ SO2;④ 液氧;⑤ 爆鸣气;⑥ KClO3;⑦ KMnO4其中存在氧分子的是( )
A. 全部 B. ①②③④ C. ①④⑤ D. ①④⑥⑦
14. 1.42gR元素可与氧元素组成2.38g氧化物X,或组成3.66g氧化物Y,则X、Y的化学式可能是( )
A. R2O和R2O5 B. R2O3和R2O5 C. R2O3和R2O7 D. R2O和R2O3
15.《中学生守则》明确规定:学生不能吸烟。吸烟对人体有害的主要原因是香烟在燃烧时产生多种有毒及致癌物质,其中元素质量比为3:4的物质是( )
A. NO B. SO2 C. CO D. CO2
三. 填空题
16. 现有① 空气 ② 高锰酸钾 ③ 水 ④ 氧化镁 ⑤ 氩气 ⑥ 碱式碳酸铜 ⑦ 铁 ⑧ 氯化钾等物质,其中属于单质的有(填序号,下同) ;属于化合物的有 ;属于氧化物的有 ;属于混合物的有 ;属于纯净物的有 。
17. 指出下列符号中“2”的含义:
(1)2N (2)N2 (3)H2O (4)2CO
18. 臭氧层里所含有的臭氧(O3),从宏观组成来看,它是 组成的 ,属于 ;从微观结构来看,它是由 构成的,1个臭氧分子又是由 构成的;O3与O2是
(填“相同”或“不同”)的分子;臭氧与氧气混合属 (填“纯净物”或“混合物”)。
19.“脑黄金”(DHA)是从深海鱼油中提取的,主要成分是一种不饱和脂肪酸,其化学式为C25H50COOH它是由 种元素组成,每个分子中有 个原子,该物质的相对分子质量是 。
20. 地壳里含量最多的非金属元素和含量最多的金属元素组成的化合物的化学式为 ;相对分子质量最小的氧化物的化学式是 ,其相对分子质量是 。
21. 把橘红色的氧化汞固体放在试管中加热,可以看到试管壁上有银白色的小液滴生成,用带火星的木条在试管中检验,发现木条复燃。
(1)从原子、分子的观点看,上述分解反应的实质是 。
(2)从上述反应的分析可以说明原子与分子的区别是 。
22. 取气密性良好的两支大小相同的医用注射器,将栓塞内外拉,分别吸入等体积的空气和水,用手指顶住针筒末端的小孔,将栓塞慢慢推入,哪支针筒内的物质易被压缩?
。用分子、原子的观点解释: 。
四. 实验题
23. 将滴有酚酞试液的滤纸条放在试管里如下图所示,放在实验台上。
(1)用仪器A吸取浓氨水,滴在试管口的脱脂棉上(10~15滴),A的名称是 ,仪器的用途是 。
(2)实验中往往在试管下放一张白纸,白纸的作用是 。
(3)实验中观察到的现象是 ,这一实验说明了 。
五. 计算题
24. 现有① FeO ② Fe2O3 ③ Fe3O4 ④ FeS四种含铁化合物,其含铁元素的质量分数由大到小的排列顺序是 。
25. 人体缺钙易产生“骨质疏松症”。一体重为60.0kg的缺钙病入每天从除食物中获得钙质外,还需从药物中补充钙质0.500g。若医生确定此人每天吃钙片6.25g,且知钙片中的有效成分为葡萄糖酸钙。试求该钙片中葡萄糖酸钙的质量分数多少?的相对分子质量为430。
试题答案
一.
氧气 氢气 氮气 氯气 氦气
O2 H2 N2 Cl2 He
氖气 氩气 氙气 氨气 二氧化碳
Ne Ar Xe NH3 CO2
二氧化硫 三氧化硫 硫化氢 氯化氢气 五氧化二磷
SO2 SO3 H2S HCl P2O5
氧化铁 氧化亚铁 四氧化三铁 氧化镁 氧化铝
Fe2O3 FeO Fe3O4 MgO Al2O3
氧化钾 氧化钠 氧化铜 氧化汞 氧化锌
K2O Na2O CuO HgO ZnO
氧化钙 水 一氧化碳 二氧化氮 二氧化硅
CaO H2O CO NO2 SiO2
氧化银 白磷 铁丝 铜 木炭
Ag2O P Fe Cu C
红磷 水银 硫磺 盐酸 硫酸
P4 Hg S HCl H2SO4
硝酸 碳酸 磷酸 氯酸 氢氧化钾
HNO3 H2CO3 H3PO4 HClO3 KOH
氢氧化钙 氢氧化钡 氢氧化铜 氢氧化铁 氢氧化亚铁
氢氧化镁 硫化钠 硫酸钠 硝酸钾 氯化银
Na2S Na2SO4 KNO3 AgCl
碳酸钠 硫酸钡 硝酸银 氯化钡 碳酸钙
Na2CO3 BaSO4 AgNO3 BaCl2 CaCO3
硝酸铵 碳酸氢铵 硫酸铵 氯化铵 硝酸钡
NH4NO3 NH4HCO3 NH4Cl
硝酸铜 硝酸锌 氯化铝 氯化亚铁 硫酸铝
AlCl3 FeCl2
碳酸亚铁 硫酸锌 硝酸镁 氯化钙 氨水
FeCO3 ZnSO4 CaCl2 NH3 H2O
硫化镁 硝酸铁 硝酸亚铁 氯化铜 氯化亚铜
MgS CuCl2 CuCl
硫酸铁 硫酸亚铁 氢氧化铝 碳酸银 硝酸汞
FeSO4 Ag2CO3
氢氧化银 硫酸银 碳酸镁 碳酸铵 碳酸钡
AgOH Ag2SO4 MgCO3 BaCO3
磷酸钠 磷酸氢钠 磷酸二氢钠 磷酸钙 硫酸钙
Na3PO4 Na2HPO4 NaH2PO4 CaSO4
氯酸钾 二氧化锰 高锰酸钾 锰酸钾 碱式碳酸铜
KClO3 MnO2 KMnO4 K2MnO4
甲烷 乙炔 硫化铵 碳酸氢钠 胆矾(蓝矾)
CH4 C2H2 NaHCO3 CuSO4 5H2O
甲醇 乙醇(酒精) 乙酸(醋酸) 纯 碱 小苏打
CH3OH C2H5OH CH3COOH Na2CO3 NaHCO3
天然气(沼气) 煤 气 火 碱 食 盐 消(熟)石灰
CH4 CO NaOH NaCl
生石灰 石灰石 碳 铵 干 冰 铁 锈
CaO CaCO3 NH4HCO3 CO2 Fe2O3
二.
1. A 2. B 3. D 4. C 5. D 6. C 7. B 8. A
9. A 10. D 11. D 12. B 13. C 14. C 15. C
三.
16. ⑤⑦;②③④⑥⑧;③④;①;②③④⑤⑥⑦⑧
17.
(1)2个氮原子
(2)每个氮分子由两个氮原子构成
(3)每个水分子中含有两个氢原子
(4)2个一氧化碳分子
18. 氧元素;单质;纯净物;臭氧分子;三个氧原子;不同;混合物
19. 三;79;395
20. Al2O3;H2O;18
21.
(1)氧化汞分子分解成汞原子和氧原子,两个氧原子又结合成一个氧分子,许多氧分子聚集成氧气;许多汞原子聚集成金属汞
(2)化学反应中,分子可以再分,而原子不能再分
22. 吸入空气的针筒内的物质易被压缩;分子间有间隔,气体物质分子间的间隔比液体物质分子间的间隔大得多,因而气体为被压缩。
四.
23.
(1)胶头滴管;吸取和滴加少量液体
(2)便于观察酚酞试液颜色的变化
(3)滤纸上出现红色的斑点,且由管口向管内延伸;分子总是不断运动的
五.
24. ①③②④
25. ~
430 40
∴ 葡萄糖酸钙的质量分数
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
专题复习—分子和原子、元素、物质分类
一. 内容
分子和原子、元素、物质分类
二. 重点、难点
1. 掌握分子、原子、元素等化学用语的概念及其异同点。
2. 了解物质的组成及分类的原则,从宏观、微观角度对物质组成进行描述。
3. 熟悉化学式的书写原则,熟练掌握有关化学式的写法及简单计算。
三. 知识要点
1. 物质的结构:
(1)原子
① 概念——原子是化学变化中的最小微粒。
② 结构
原子尽管很小,用化学方法不能再分,但用其它方法可以再分,因为原子也有一定的构成。
③ 各种关系
a. 核电荷数=核内质子数=核外电子数 所以整个原子不显电性
b. 质子数不一定等于中子数,它们之间没有必然联系
c. 某原子的相对原子质量
(2)分子
① 概念——分子是保持物质化学性质的最小粒子。
② 与原子的关系
(3)离子
① 概念——带电的原子或原子团。
② 与原子的关系
分子 原子 离子
区别 定义 保持物质化学性质的一种微粒 是化学变化中的最小微粒。 带电的原子或原子团。
化学变化中是否可分 在化学变化中可分,变化前后种类和数目可能发生变化。 在化学变化中不可分,变化前后种类和数目不发生变化。 在化学变化中,单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。
是否独立存在 能独立存在,构成物质并保持物质的化学性质不变 有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 阴、阳离子共同构成物质,形成离子化合物。
构成 由原子构成,且纯净物中仅含有一种分子。 一般由质子、中子和核外电子三种微粒构成。且: 由原子得失电子形成,原子得电子带负电荷成为阴离子,原子失电子带正电荷成为阳离子。
所带电性情况 不显电性 a:不显电性。 b:核电荷数 = 质子数 = 核外电子数 a:阴离子:核电荷数 = 质子数 < 核外电子数b:阳离子:核电荷数 = 质子数 > 核外电子数
表示方法 用化学式(分子式)表示 用元素符号表示。 分别以阴、阳离子符号表示。
联系 在化学反应中表现:
表达方法 均为微观粒子,既可讲个数,又可论种类。
性质 三种微粒都很小,一般用其相对质量表示质量;三种微粒都在不断地运动;且微粒间有间隙;三者皆为构成物质的一种微粒。
(4)元素
① 概念——具有相同核电荷数的同一类原子的总称。
② 在地壳中前五位的元素
③ 与原子的关系
元 素 原 子
不同点 概念 元素是具有相同核电荷数的同一类原子的总称。如氢原子(H)和氢离子(H+)都属于氢元素 原子是化学变化中的最小微粒
含义 元素只分种类,没有数量(个数)、大小和质量的含义 原子有种类之分,又有数量、大小、质量的含义
应用范围 元素在说明物质宏观组成时应用 原子是微观粒子,说明物质微观结构时应用
联系 具有相同核电荷数的同一类原子称为一种元素;原子是体现元素性质的最小微粒
(5)物质、元素、分子、原子的相互关系
(仅讲种类,不讲个数) (既讲种类,又讲个数)
2. 物质的组成:
(1)混合物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。
(2)纯净物组成:宏观:用物质描述、用所含元素描述;微观:由分子组成描述。
3. 物质的分类:
(1)单质和化合物的区别和联系
单质 化合物
区别 概念 由同种元素组成的纯净物 由不同种元素组成的纯净物
组成 a:宏观:仅含有一种元素。b:微观:分子由同种元素的原子构成。 a:宏观:含有两种或两种以上元素。b:微观:分子由不同种元素的原子构成。
元素存在形态 游离态 化合态
分类 金属、非金属和稀有气体单质 无机物:氧化物、酸、碱、盐等。有机物:甲烷、乙醇、乙酸等
性质 一般不能分解 有些化合物在一定条件下能分解。
联系 都是纯净物,且有固定的组成。
(2)纯净物和混合物的区别与联系
纯净物 混合物
区别 概念 由同一种物质组成 由两种或两种以上的物质组成,这些物质相互间没有发生化学反应,各自保持自己的性质。
组成 a:宏观:一种物质。b:微观:对由分子构成的物质而言,由一种分子构成。c:具有固定不变的组成。 a:宏观:两种或两种以上的物质。b:微观:由不同种分子构成。c:没有固定的组成。
性质 具有固定的性质。例如:固定的熔点、沸点等。 没有固定的性质。例如:没有固定的溶点、沸点等
联系
【典型例题】
[例1] 现有H、O、H+、O2-、H2、O2、OH-、H2O八种微粒,试用这些微粒的符号填写下列空白:
(1)能保持水的化学性质的微粒是 ;
(2)氢气和氧气化合生成水的过程中的最小微粒是 ;
(3)水变成水蒸气时 没有变化;
(4)电解水得到的产物是 ;
(5)没有电子的微粒是 ;
(6)质子数少于核外电子数的微粒是 ;
(7)电子数相同的微粒是 ;
解析:本题主要考查分子、原子和离子的概念以及对有关化学用语和原子结构等基本知识的理解程度。这就要求在学习中要注意结合一些具体物质将有关知识进行系统总结和分析,以解决各种复杂问题。各项解答分述如下:
(1)由于分子是保持物质化学性质的一种微粒,而水又是由水分子构成的,所以能保持水的化学性质的微粒是水分子(H2O);
(2)氢气和氧气化合时,氢分子与氧分子先各自分成氢原子(H)和氧原子(O),然后两种原子再重新组合生成水分子。因此,氢气与氧气化合时的最小微粒是氢原子和氧原子。
(3)水变成水蒸气只是水的状态改变,水的化学性质没变,因此,水分子本身没有变化;
(4)由电解水的实验可知:电解水的产物是氢气和氧气,而氢气和氧气分别由氢分子(H2)和氧分子(O2)构成;
(5)氢原子核外只有一个电子,失去后变成没有电子的氢离子(H+);
(6)由于质子带正电荷,电子带负电荷,所以,质子数小于电子数的微粒应带有负电荷,即O2-和OH-;
(7)经分析可知:OH-、H2O、O2-的电子数都是10个。
答案:
(1)H2O (2)H、O
(3)H2O (4)H2、O2
(5)H+ (6)O2-、OH-
(7)OH-、H2O、O2-
[例2] 下列说法中,不正确的是( )
A. 由同种元素组成的纯净物不一定是单质。
B. 混合物一定由不同种元素组成。
C. 质子数相等的微粒不一定属于同种元素。
D. 含氧化合物不一定是氧化物。
解析:本题主要是考查对混合物、纯净物、单质、化合物以及氧化物等基本概念的理解。解题关键是弄清以上概念间的区别与联系。
(1)混合物与纯净物是依据所含的物质种类不同进行区别,混合物中有多种物质而纯净物中只含一种物质,它们之间的区分与所含元素种类无关。例如:金刚石和石墨组成的混合物,只由一种碳元素组成,所以选项B不正确。
(2)单质与化合物都属于纯净物,它们之间不同的是:单质是由同种元素组成,化合物由不同种元素组成,所以A不正确。
(3)化合物与氧化物的区别在于氧化物是由两种元素组成,其中一种是氧元素的化合物,含氧化合物则不一定由两种元素组成,故D正确。
(4)质子数相同的微粒有多种情况:① 原子与原子;② 原子与分子;③ 分子与分子等,只有质子数相同的同一类原子,才属于同种元素,所以C正确。
答案:AB
【模拟试题】
一. 正确书写下列化学式
氧气 氢气 氮气 氯气 氦气
氖气 氩气 氙气 氨气 二氧化碳
二氧化硫 三氧化硫 硫化氢 氯化氢气 五氧化二磷
氧化铁 氧化亚铁 四氧化三铁 氧化镁 氧化铝
氧化钾 氧化钠 氧化铜 氧化汞 氧化锌
氧化钙 水 一氧化碳 二氧化氮 二氧化硅
氧化银 白磷 铁丝 铜 木炭
红磷 水银 硫磺 盐酸 硫酸
硝酸 碳酸 磷酸 氯酸 氢氧化钾
氢氧化钙 氢氧化钡 氢氧化铜 氢氧化铁 氢氧化亚铁
氢氧化镁 硫化钠 硫酸钠 硝酸钾 氯化银
碳酸钠 硫酸钡 硝酸银 氯化钡 碳酸钙
硝酸铵 碳酸氢铵 硫酸铵 氯化铵 硝酸钡
硝酸铜 硝酸锌 氯化铝 氯化亚铁 硫酸铝
碳酸亚铁 硫酸锌 硝酸镁 氯化钙 氨水
硫化镁 硝酸铁 硝酸亚铁 氯化铜 氯化亚铜
硫酸铁 硫酸亚铁 氢氧化铝 碳酸银 硝酸汞
氢氧化银 硫酸银 碳酸镁 碳酸铵 碳酸钡
磷酸钠 磷酸氢钠 磷酸二氢钠 磷酸钙 硫酸钙
氯酸钾 二氧化锰 高锰酸钾 锰酸钾 碱式碳酸铜
甲烷 乙炔 硫化铵 碳酸氢钠 胆矾(蓝矾)
甲醇 乙醇(酒精) 乙酸(醋酸) 纯 碱 小苏打
天然气(沼气) 煤 气 火 碱 食 盐 消(熟)石灰
生石灰 石灰石 碳 铵 干 冰 铁 锈
二. 选择题
1. 下列有关分子和原子的说法正确的是( )
A. 分子或原子都可以构成物质
B. 分子的体积比原子体积大
C. 分子可以再分而原子不能再分
D. 分子是保持物质性质的最小粒子
2. 单质不同于化合物,原因在于( )
A. 单质只由原子构成,化合物都由分子构成
B. 单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物
C. 单质能与另一单质发生化合反应,化合物则不能
D. 有些化合物能发生分解反应,单质不能发生分解反应
3. 下列说法中不正确的是( )
A. 原子在化学变化中不可分,分子在物理变化中不可分
B. 原子都是由原子核和电子构成的
C. 原子、分子都是构成物质的粒子
D. 原子核都是由质子和中子构成的
4. 互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”,这里的“铁”是指( )
A. 铁单质 B. 铁原子 C. 铁元素 D. 四氧化三铁
5. 自第十一届奥运会以来,历届奥运会开幕式都要举行颇为隆重的“火炬接力”,火炬的可燃物是丁烷(化学式C4H10),它燃烧时火苗高且亮,在白天,二百米以外也能清晰可见,下列关于丁烷的叙述正确的是( )
A. 每个丁烷分子由四个碳元素和十个氢元素组成
B. 丁烷由四个碳原子和十个氢原子组成
C. 丁烷由丁烷分子构成,丁烷分子是由碳、氢元素构成
D. 丁烷由碳、氢两种元素组成
6. m个CO2分子和m个SO2分子中,一样多的是( )
A. 氧元素 B. 氧分子数 C. 氧原子数 D. 氧元素的质量分数
7. 在符号2H、2SO3、2Ca、2H2O中,数字“2”表示的意义不尽相同,其中“2”的意义是用来表示分子个数的符号有( )
A. 1个 B. 2 C. 3个 D. 4个
8. 甲原子与乙原子的质量比为,而乙原子与碳12原子的质量比为,则甲原子的相对原子质量为( )
A. B. C. D.
9. 有一种氮的氧化物,氮和氧的质量比为7:4,则此氮的氧化物的化学式为( )
A. N2O B. NO2 C. N2O3 D. N2O5
10. 吸毒严重危害身心健康,一旦吸毒就很难戒除,所以其危害尤为严重。有一种称为“摇头丸”的毒品,已从国外流入我国某些省市,我国公安机关坚决予以查缉和打击。已知它的化学式为C9H13N,它的相对分子质量为( )
A. 121 B. 122 C. 130 D. 135
11. 同种元素组成的物质( )
A. 一定是单质 B. 一定是纯净物 C. 一定是混合物 D. 一定不是化合物
12. 在我们身边,下列各类物质存在最多的是( )
A. 纯净物 B. 混合物 C. 单质 D. 化合物
13. 下列物质① 空气;② MnO2;③ SO2;④ 液氧;⑤ 爆鸣气;⑥ KClO3;⑦ KMnO4其中存在氧分子的是( )
A. 全部 B. ①②③④ C. ①④⑤ D. ①④⑥⑦
14. 1.42gR元素可与氧元素组成2.38g氧化物X,或组成3.66g氧化物Y,则X、Y的化学式可能是( )
A. R2O和R2O5 B. R2O3和R2O5 C. R2O3和R2O7 D. R2O和R2O3
15.《中学生守则》明确规定:学生不能吸烟。吸烟对人体有害的主要原因是香烟在燃烧时产生多种有毒及致癌物质,其中元素质量比为3:4的物质是( )
A. NO B. SO2 C. CO D. CO2
三. 填空题
16. 现有① 空气 ② 高锰酸钾 ③ 水 ④ 氧化镁 ⑤ 氩气 ⑥ 碱式碳酸铜 ⑦ 铁 ⑧ 氯化钾等物质,其中属于单质的有(填序号,下同) ;属于化合物的有 ;属于氧化物的有 ;属于混合物的有 ;属于纯净物的有 。
17. 指出下列符号中“2”的含义:
(1)2N (2)N2 (3)H2O (4)2CO
18. 臭氧层里所含有的臭氧(O3),从宏观组成来看,它是 组成的 ,属于 ;从微观结构来看,它是由 构成的,1个臭氧分子又是由 构成的;O3与O2是
(填“相同”或“不同”)的分子;臭氧与氧气混合属 (填“纯净物”或“混合物”)。
19.“脑黄金”(DHA)是从深海鱼油中提取的,主要成分是一种不饱和脂肪酸,其化学式为C25H50COOH它是由 种元素组成,每个分子中有 个原子,该物质的相对分子质量是 。
20. 地壳里含量最多的非金属元素和含量最多的金属元素组成的化合物的化学式为 ;相对分子质量最小的氧化物的化学式是 ,其相对分子质量是 。
21. 把橘红色的氧化汞固体放在试管中加热,可以看到试管壁上有银白色的小液滴生成,用带火星的木条在试管中检验,发现木条复燃。
(1)从原子、分子的观点看,上述分解反应的实质是 。
(2)从上述反应的分析可以说明原子与分子的区别是 。
22. 取气密性良好的两支大小相同的医用注射器,将栓塞内外拉,分别吸入等体积的空气和水,用手指顶住针筒末端的小孔,将栓塞慢慢推入,哪支针筒内的物质易被压缩?
。用分子、原子的观点解释: 。
四. 实验题
23. 将滴有酚酞试液的滤纸条放在试管里如下图所示,放在实验台上。
(1)用仪器A吸取浓氨水,滴在试管口的脱脂棉上(10~15滴),A的名称是 ,仪器的用途是 。
(2)实验中往往在试管下放一张白纸,白纸的作用是 。
(3)实验中观察到的现象是 ,这一实验说明了 。
五. 计算题
24. 现有① FeO ② Fe2O3 ③ Fe3O4 ④ FeS四种含铁化合物,其含铁元素的质量分数由大到小的排列顺序是 。
25. 人体缺钙易产生“骨质疏松症”。一体重为60.0kg的缺钙病入每天从除食物中获得钙质外,还需从药物中补充钙质0.500g。若医生确定此人每天吃钙片6.25g,且知钙片中的有效成分为葡萄糖酸钙。试求该钙片中葡萄糖酸钙的质量分数多少?的相对分子质量为430。
试题答案
一.
氧气 氢气 氮气 氯气 氦气
O2 H2 N2 Cl2 He
氖气 氩气 氙气 氨气 二氧化碳
Ne Ar Xe NH3 CO2
二氧化硫 三氧化硫 硫化氢 氯化氢气 五氧化二磷
SO2 SO3 H2S HCl P2O5
氧化铁 氧化亚铁 四氧化三铁 氧化镁 氧化铝
Fe2O3 FeO Fe3O4 MgO Al2O3
氧化钾 氧化钠 氧化铜 氧化汞 氧化锌
K2O Na2O CuO HgO ZnO
氧化钙 水 一氧化碳 二氧化氮 二氧化硅
CaO H2O CO NO2 SiO2
氧化银 白磷 铁丝 铜 木炭
Ag2O P Fe Cu C
红磷 水银 硫磺 盐酸 硫酸
P4 Hg S HCl H2SO4
硝酸 碳酸 磷酸 氯酸 氢氧化钾
HNO3 H2CO3 H3PO4 HClO3 KOH
氢氧化钙 氢氧化钡 氢氧化铜 氢氧化铁 氢氧化亚铁
氢氧化镁 硫化钠 硫酸钠 硝酸钾 氯化银
Na2S Na2SO4 KNO3 AgCl
碳酸钠 硫酸钡 硝酸银 氯化钡 碳酸钙
Na2CO3 BaSO4 AgNO3 BaCl2 CaCO3
硝酸铵 碳酸氢铵 硫酸铵 氯化铵 硝酸钡
NH4NO3 NH4HCO3 NH4Cl
硝酸铜 硝酸锌 氯化铝 氯化亚铁 硫酸铝
AlCl3 FeCl2
碳酸亚铁 硫酸锌 硝酸镁 氯化钙 氨水
FeCO3 ZnSO4 CaCl2 NH3 H2O
硫化镁 硝酸铁 硝酸亚铁 氯化铜 氯化亚铜
MgS CuCl2 CuCl
硫酸铁 硫酸亚铁 氢氧化铝 碳酸银 硝酸汞
FeSO4 Ag2CO3
氢氧化银 硫酸银 碳酸镁 碳酸铵 碳酸钡
AgOH Ag2SO4 MgCO3 BaCO3
磷酸钠 磷酸氢钠 磷酸二氢钠 磷酸钙 硫酸钙
Na3PO4 Na2HPO4 NaH2PO4 CaSO4
氯酸钾 二氧化锰 高锰酸钾 锰酸钾 碱式碳酸铜
KClO3 MnO2 KMnO4 K2MnO4
甲烷 乙炔 硫化铵 碳酸氢钠 胆矾(蓝矾)
CH4 C2H2 NaHCO3 CuSO4 5H2O
甲醇 乙醇(酒精) 乙酸(醋酸) 纯 碱 小苏打
CH3OH C2H5OH CH3COOH Na2CO3 NaHCO3
天然气(沼气) 煤 气 火 碱 食 盐 消(熟)石灰
CH4 CO NaOH NaCl
生石灰 石灰石 碳 铵 干 冰 铁 锈
CaO CaCO3 NH4HCO3 CO2 Fe2O3
二.
1. A 2. B 3. D 4. C 5. D 6. C 7. B 8. A
9. A 10. D 11. D 12. B 13. C 14. C 15. C
三.
16. ⑤⑦;②③④⑥⑧;③④;①;②③④⑤⑥⑦⑧
17.
(1)2个氮原子
(2)每个氮分子由两个氮原子构成
(3)每个水分子中含有两个氢原子
(4)2个一氧化碳分子
18. 氧元素;单质;纯净物;臭氧分子;三个氧原子;不同;混合物
19. 三;79;395
20. Al2O3;H2O;18
21.
(1)氧化汞分子分解成汞原子和氧原子,两个氧原子又结合成一个氧分子,许多氧分子聚集成氧气;许多汞原子聚集成金属汞
(2)化学反应中,分子可以再分,而原子不能再分
22. 吸入空气的针筒内的物质易被压缩;分子间有间隔,气体物质分子间的间隔比液体物质分子间的间隔大得多,因而气体为被压缩。
四.
23.
(1)胶头滴管;吸取和滴加少量液体
(2)便于观察酚酞试液颜色的变化
(3)滤纸上出现红色的斑点,且由管口向管内延伸;分子总是不断运动的
五.
24. ①③②④
25. ~
430 40
∴ 葡萄糖酸钙的质量分数
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
